1 . 磷酸亚铁锂(LiFePO4)是生产锂电池的重要材料。实验室中用如图装置制备LiFePO4:在仪器A中加入40mL蒸馏水、少量抗坏血酸,再加入0.01molH3PO4和0.01molFeSO4•7H2O,用搅拌器搅拌溶解后,缓慢加入0.03molLiOH•H2O,继续搅拌5min。快速将反应液装入反应釜中,保持170℃恒温5h。
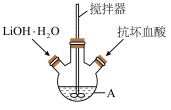
(1)仪器A的名称是___________ ;实验所用蒸馏水若未经煮沸直接使用,则可能发生反应的离子方程式为 ___________ 。
(2)实验中可用Na2SO3代替抗坏血酸,其原理是___________ (用离子方程式表示);不能用铁粉代替抗坏血酸的原因是 ___________ 。
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是___________ 、 ___________ 、过滤、洗涤、干燥。
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是___________ 。
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率约为 ___________。

(1)仪器A的名称是
(2)实验中可用Na2SO3代替抗坏血酸,其原理是
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率约为 ___________。
| A.85% | B.80% | C.75% | D.70% |
您最近一年使用:0次
2 . 硼镁泥是可贵的镁资源。硼镁泥的主要成分为 、
、 ,还含少量的
,还含少量的 、
、 、
、 、CaO、MnO,利用硼镁泥制备
、CaO、MnO,利用硼镁泥制备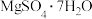 的工艺流程如图所示。
的工艺流程如图所示。

已知:①抽滤可以达到加速过滤的目的。
②常温下,部分金属阳离子以氢氧化物形式沉淀时溶液的pH范围如下表:
③两种盐的溶解度曲线如图:

请回答下列问题:
(1)“酸浸”时,加入的酸为_______ (填名称),“酸浸”时,一般煮沸10min,这样做的目的是_______ 。
(2)“滤渣1”的主要成分为_______ (写化学式)。
(3)“滤渣2”中含有 、
、 、
、 ,为了调节pH至6,物质Y可选用
,为了调节pH至6,物质Y可选用_______ ,检验铁离子是否完全沉淀的操作为_______ 。
(4)pH=6时,加入NaClO固体后,写出NaClO涉及反应的离子方程式:_______ 、_______ 。
(5)“操作Z”是为了除去硫酸钙,依据溶解度曲线,“操作Z”为蒸发浓缩、_______ ;“一系列操作”为_______ 、洗涤、干燥。
 、
、 ,还含少量的
,还含少量的 、
、 、
、 、CaO、MnO,利用硼镁泥制备
、CaO、MnO,利用硼镁泥制备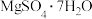 的工艺流程如图所示。
的工艺流程如图所示。
已知:①抽滤可以达到加速过滤的目的。
②常温下,部分金属阳离子以氢氧化物形式沉淀时溶液的pH范围如下表:
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Fe2+ | Mg2+ |
| pH范围 | 1.5~2.8 | 3.4~4.7 | 8.1~10.1 | 6.3~8.3 | 9.9~11.9 |

请回答下列问题:
(1)“酸浸”时,加入的酸为
(2)“滤渣1”的主要成分为
(3)“滤渣2”中含有
 、
、 、
、 ,为了调节pH至6,物质Y可选用
,为了调节pH至6,物质Y可选用(4)pH=6时,加入NaClO固体后,写出NaClO涉及反应的离子方程式:
(5)“操作Z”是为了除去硫酸钙,依据溶解度曲线,“操作Z”为蒸发浓缩、
您最近一年使用:0次
2023-04-21更新
|
126次组卷
|
2卷引用:贵州省遵义市部分高中2022-2023学年高二下学期期中联考化学试题
3 . 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如图:
,实验流程如图:

回答下列问题:
(1)从海水中提取NaCl固体时,为先后除去 、
、 、
、 ,除杂试剂应依次加入
,除杂试剂应依次加入 、
、_______ 、_______ (填化学式);
(2)生成 的总反应的化学方程式为
的总反应的化学方程式为_______ 。
(3)向母液中加入NaCl粉末,存在 过程。为使
过程。为使 沉淀充分析出并分离,根据NaCl和
沉淀充分析出并分离,根据NaCl和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为_______ 、过滤、洗涤、干燥。

(4)对固体 充分加热,产生的气体先通过足量浓硫酸,再通过足量
充分加热,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重0.28g,则固体
增重0.28g,则固体 的质量为
的质量为_______ g。
 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如图:
,实验流程如图:
回答下列问题:
(1)从海水中提取NaCl固体时,为先后除去
 、
、 、
、 ,除杂试剂应依次加入
,除杂试剂应依次加入 、
、(2)生成
 的总反应的化学方程式为
的总反应的化学方程式为(3)向母液中加入NaCl粉末,存在
 过程。为使
过程。为使 沉淀充分析出并分离,根据NaCl和
沉淀充分析出并分离,根据NaCl和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为
(4)对固体
 充分加热,产生的气体先通过足量浓硫酸,再通过足量
充分加热,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重0.28g,则固体
增重0.28g,则固体 的质量为
的质量为
您最近一年使用:0次
解题方法
4 . 下图为短周期元素的部分信息(图象中数值代表最高正化合价或最低负化合价),其中e的原子半径是短周期元素中最大的,y元素所构成的化合物已超过1亿种。

回答问题:
(1)z元素在周期表中的位置是第二周期、第_______ 族。
(2)画出e元素原子结构示意图_______ 。
(3)g元素的最高正价为_______ 。
(4)d、e元素能形成淡黄色的固体,该固体与水反应的化学方程式为_______ 。
(5)某探究小组探究镁与铝金属性强弱的关系,进行如下实验设计:
[实验操作]分别向装有少量 溶液、
溶液、 溶液的试管中逐滴滴加
溶液的试管中逐滴滴加 NaOH溶液直至过量,如下图:
NaOH溶液直至过量,如下图:

[实验现象]①中产生白色沉淀且不溶解;②中先产生白色沉淀后沉淀溶解。
[实验结论] 不溶于NaOH溶液;
不溶于NaOH溶液; 溶于NaOH溶液,显示两性,故碱性:
溶于NaOH溶液,显示两性,故碱性: 大于
大于 。证明金属性:
。证明金属性:_______ 。

回答问题:
(1)z元素在周期表中的位置是第二周期、第
(2)画出e元素原子结构示意图
(3)g元素的最高正价为
(4)d、e元素能形成淡黄色的固体,该固体与水反应的化学方程式为
(5)某探究小组探究镁与铝金属性强弱的关系,进行如下实验设计:
[实验操作]分别向装有少量
 溶液、
溶液、 溶液的试管中逐滴滴加
溶液的试管中逐滴滴加 NaOH溶液直至过量,如下图:
NaOH溶液直至过量,如下图:
[实验现象]①中产生白色沉淀且不溶解;②中先产生白色沉淀后沉淀溶解。
[实验结论]
 不溶于NaOH溶液;
不溶于NaOH溶液; 溶于NaOH溶液,显示两性,故碱性:
溶于NaOH溶液,显示两性,故碱性: 大于
大于 。证明金属性:
。证明金属性:
您最近一年使用:0次
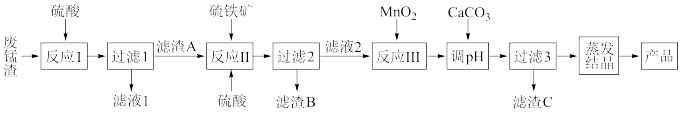
5 . 高锰酸钾生产过程中产生的废锰渣(主要成分为 、
、 和
和 )可用于制备
)可用于制备 晶体,工艺流程如下:
晶体,工艺流程如下:
已知:①硫铁矿的主要成分为下 (杂质不参与反应);
(杂质不参与反应);
② 为肉色。
为肉色。
回答下列问题:
(1)为了提高“反应I”的速率,可采取的措施有___________ (写两种即可)。
(2)“反应II”的离子方程式为___________ ,“滤渣B”的主要成分为过量的 和
和___________ (填化学式)。
(3)“反应III”中氧化剂和还原剂物质的量之比为___________ 。
(4)检验“滤液1”中是否含有 的方法是
的方法是___________ 。
(5)取 固体样品,溶于适量水中,加硫酸酸化,用过量
固体样品,溶于适量水中,加硫酸酸化,用过量 (难溶于水)将其完全氧化为
(难溶于水)将其完全氧化为 ,过滤,洗涤液并入滤液后,加入
,过滤,洗涤液并入滤液后,加入 固体,充分反应后,用
固体,充分反应后,用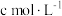 的
的 标准溶液滴定剩余的
标准溶液滴定剩余的 溶液,用去
溶液,用去 。
。
①达到滴定终点的现象是___________ 。
②样品中 的质量分数为
的质量分数为___________ (用含m、a、c、V的代数式表示)。
 、
、 和
和 )可用于制备
)可用于制备 晶体,工艺流程如下:
晶体,工艺流程如下:
已知:①硫铁矿的主要成分为下
 (杂质不参与反应);
(杂质不参与反应);②
 为肉色。
为肉色。回答下列问题:
(1)为了提高“反应I”的速率,可采取的措施有
(2)“反应II”的离子方程式为
 和
和(3)“反应III”中氧化剂和还原剂物质的量之比为
(4)检验“滤液1”中是否含有
 的方法是
的方法是(5)取
 固体样品,溶于适量水中,加硫酸酸化,用过量
固体样品,溶于适量水中,加硫酸酸化,用过量 (难溶于水)将其完全氧化为
(难溶于水)将其完全氧化为 ,过滤,洗涤液并入滤液后,加入
,过滤,洗涤液并入滤液后,加入 固体,充分反应后,用
固体,充分反应后,用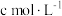 的
的 标准溶液滴定剩余的
标准溶液滴定剩余的 溶液,用去
溶液,用去 。
。①达到滴定终点的现象是
②样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
6 . 无水FeCl3是常用的芳香烃取代反应的催化剂,它具有易水解、易升华的性质。某同学用干燥铁粉与氯气反应制备无水FeCl3的实验装置如图所示:
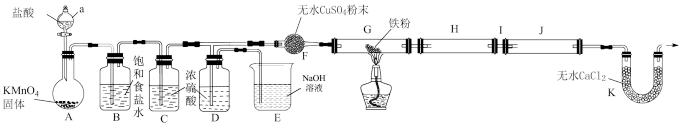
已知:①H装置和J装置用来收集产物;
②D装置的作用是便于观察实验过程中Ⅰ装置处是否出现堵塞。
回答下列问题:
(1)仪器a的名称为___________ 。
(2)实验开始前,先通一会儿氯气,其目的是___________ 。
(3)F装置中无水CuSO4粉末的作用是___________ 。
(4)A装置中发生反应的离子方程式为___________ 。
(5)某同学用11.20 g干燥铁粉制得无水FeCl3样品29.25 g,该次实验的产率为________ 。
(6)实验过程中,某同学发现该实验有不足之处,请提出改进措施:______ 。

已知:①H装置和J装置用来收集产物;
②D装置的作用是便于观察实验过程中Ⅰ装置处是否出现堵塞。
回答下列问题:
(1)仪器a的名称为
(2)实验开始前,先通一会儿氯气,其目的是
(3)F装置中无水CuSO4粉末的作用是
(4)A装置中发生反应的离子方程式为
(5)某同学用11.20 g干燥铁粉制得无水FeCl3样品29.25 g,该次实验的产率为
(6)实验过程中,某同学发现该实验有不足之处,请提出改进措施:
您最近一年使用:0次
解题方法
7 . 硼位于IIIA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
查阅资料:①BCl3的沸点为12.5℃,熔点为-107.3℃;②2B+6HCl 2BCl3↑+3H2↑。
2BCl3↑+3H2↑。
设计实验:某同学设计如图所示装置利用氯气和单质硼反应制备三氯化硼:

请回答下列问题:
(1)装置A盛装浓盐酸的仪器名称为_______ 。
(2)A中主要反应的化学方程式为:______ 。
(3)E装置的作用_____ ,装置F的作用是______ 、______ 。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:_____ 。
(5)装置B中若采用玻璃管,则制得的BCl3中常含有SiCl4(SiCl4)的熔点为-70℃,沸点为57.6℃)等杂质,可采用____ 的方法提纯BCl3。
查阅资料:①BCl3的沸点为12.5℃,熔点为-107.3℃;②2B+6HCl
 2BCl3↑+3H2↑。
2BCl3↑+3H2↑。设计实验:某同学设计如图所示装置利用氯气和单质硼反应制备三氯化硼:

请回答下列问题:
(1)装置A盛装浓盐酸的仪器名称为
(2)A中主要反应的化学方程式为:
(3)E装置的作用
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:
(5)装置B中若采用玻璃管,则制得的BCl3中常含有SiCl4(SiCl4)的熔点为-70℃,沸点为57.6℃)等杂质,可采用
您最近一年使用:0次
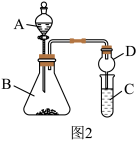
8 . 某化学兴趣小组利用如图1实验装置进行制取氯酸钾和验证元素的非金属性相对强弱的实验。已知氯气在加热条件下与氢氧化钾反应生成氯酸钾、水和氯化钾。
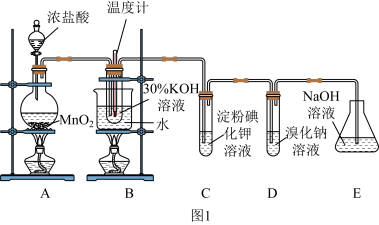
(1)A装置中反应的离子方程式为_______ ,B装置中反应的离子方程式为_______ ,B装置采用水浴加热的优点是_______ 。
(2)若对调B和C装置的位置,_____ (填“能”或“不能”)提高B中氯酸钾的产率。
(3)验证非金属性:Cl>I的实验现象是_______ ,该装置______ (填“能”或“不能”)验证非金属性:Cl>Br>I。
(4)利用如图2装置验证非金属性:C>Si,B中加Na2CO3,C中加Na2SiO3溶液,A中应该加入_____ ,C中反应的化学方程式:_____ ,D装置的作用是______ 。

(1)A装置中反应的离子方程式为
(2)若对调B和C装置的位置,
(3)验证非金属性:Cl>I的实验现象是
(4)利用如图2装置验证非金属性:C>Si,B中加Na2CO3,C中加Na2SiO3溶液,A中应该加入

您最近一年使用:0次
9 . 今有A,B两种元素,A的+1价阳离子与B的-2价阴离子的电子层结构与氖相同。
(1)用电子式表示A与B两种元素构成的两种化合物分别为__________________ 和__________________ ,前者只有__________ 键;后者既有________ 键,又有________ 键。
(2)A的氢化物的电子式为_______ ,其中含有________ 键,它与水反应的化学方程式为____________ 。
(3)元素B的气态氢化物的电子式为___________________________________________ ,该分子中的键属于________ (填“极性”或“非极性”)键,该氢化物与H+形成的键属于________ 。
(4)元素A的最高价氧化物的水化物的电子式为____________ ,其中既有________ 键,又有________ 键。
(5)B元素的单质有__________ 和__________ ,二者互称为______________________ 。
(1)用电子式表示A与B两种元素构成的两种化合物分别为
(2)A的氢化物的电子式为
(3)元素B的气态氢化物的电子式为
(4)元素A的最高价氧化物的水化物的电子式为
(5)B元素的单质有
您最近一年使用:0次
2018-12-19更新
|
175次组卷
|
2卷引用:贵州省遵义市正安县第一中学2018-2019学年高二上学期期中考试化学试题
名校
解题方法
10 . 某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O)晶体,设计了如下流程:
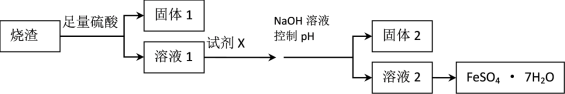
已知:(1)常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
(2)七水合硫酸亚铁(FeSO4·7H2O)的溶解度
(1)溶解烧渣选用足量硫酸,写出Fe2O3与硫酸反应的离子方程式_______________ ;检验溶液1中含有Fe3+的实验方法是___________________ ;
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式___________________ ;
(3)试剂X是__________________ ;固体2是___________________ ;
(4)加入NaOH溶液控制pH应不超过_________________ ;
(5)从溶液2中获得晶体的的方法为______________ , _____________ 过滤、洗涤、干燥。
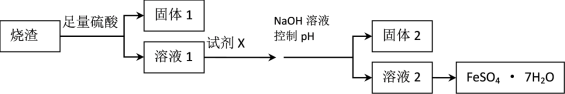
已知:(1)常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
| 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Al3+ | 3.3 | 5.0 |
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| FeSO4·7H2O溶解度(g) | 15.5 | 26.5 | 32.9 | 40.2 | 48.9 |
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式
(3)试剂X是
(4)加入NaOH溶液控制pH应不超过
(5)从溶液2中获得晶体的的方法为
您最近一年使用:0次
2018-10-06更新
|
98次组卷
|
2卷引用:贵州省遵义市航天高级中学2018-2019学年高二(理)上学期第一次月考化学试题



