解题方法
1 . 绿矾( )可用作局部收敛剂及补血剂。某工厂产生的烧渣(主要含
)可用作局部收敛剂及补血剂。某工厂产生的烧渣(主要含 、FeO,还有一定量的
、FeO,还有一定量的 )可用于制绿矾晶体,其工艺流程如下:
)可用于制绿矾晶体,其工艺流程如下:
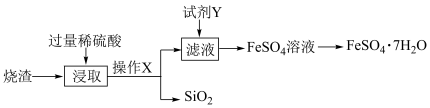
查阅资料: 不溶于水,也不与稀硫酸反应。
不溶于水,也不与稀硫酸反应。
(1)操作X的名称为________ 。
(2)“浸取”步骤中,反应的离子方程式分别为________ 、________ 。
(3)试剂Y的作用是将 转化为
转化为 。
。
①若试剂Y是 ,转化原理用离子方程式表示为
,转化原理用离子方程式表示为 ,
, 属于
属于________ (填“氧化产物”或“还原产物”)。
②若试剂Y是Fe,转化原理用离子方程式表示为________ ,化工生产中②比①好,从物质利用率角度考虑,其原因是________ 。
(4)加入试剂Y充分反应后,如何证明滤液中已不含 ,写出实验操作和现象:
,写出实验操作和现象:________ 。
 )可用作局部收敛剂及补血剂。某工厂产生的烧渣(主要含
)可用作局部收敛剂及补血剂。某工厂产生的烧渣(主要含 、FeO,还有一定量的
、FeO,还有一定量的 )可用于制绿矾晶体,其工艺流程如下:
)可用于制绿矾晶体,其工艺流程如下:
查阅资料:
 不溶于水,也不与稀硫酸反应。
不溶于水,也不与稀硫酸反应。(1)操作X的名称为
(2)“浸取”步骤中,反应的离子方程式分别为
(3)试剂Y的作用是将
 转化为
转化为 。
。①若试剂Y是
 ,转化原理用离子方程式表示为
,转化原理用离子方程式表示为 ,
, 属于
属于②若试剂Y是Fe,转化原理用离子方程式表示为
(4)加入试剂Y充分反应后,如何证明滤液中已不含
 ,写出实验操作和现象:
,写出实验操作和现象:
您最近一年使用:0次
名校
2 . 84消毒液是常用消毒剂,主要成分为NaClO,某化学小组在实验室制备84消毒液并探究其相关性质。回答下列问题:
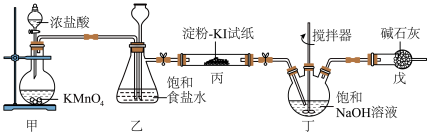
(1)装置甲中盛放浓盐酸的仪器名称是___________ ,装置甲中反应的离子方程式为___________ 。
(2)装置丙中淀粉-KI试纸变蓝,所发生反应的化学方程式为___________ 。
(3)装置丁制备 的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取
的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取 ,理论上反应中转移电子数为
,理论上反应中转移电子数为___________ 。
(4)装置戊的作用是___________ 。
(5)为了进一步研究消毒液的性质,兴趣小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。
猜测1:双氧水与消毒液发生反应产生氧气。
猜测2:……
①猜测1中反应的化学方程式为___________ ;猜测2可能为___________ 。
②为了验证猜想,某探究小组设计用如图装置进行实验。操作如下:在相同条件下,用注射器取等量的双氧水,分别加入盛有足量84消毒液和二氧化锰的锥形瓶中,做对照实验,若观察到___________ ,则证明猜测1正确。

(1)装置甲中盛放浓盐酸的仪器名称是
(2)装置丙中淀粉-KI试纸变蓝,所发生反应的化学方程式为
(3)装置丁制备
 的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取
的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取 ,理论上反应中转移电子数为
,理论上反应中转移电子数为(4)装置戊的作用是
(5)为了进一步研究消毒液的性质,兴趣小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。
猜测1:双氧水与消毒液发生反应产生氧气。
猜测2:……
①猜测1中反应的化学方程式为
②为了验证猜想,某探究小组设计用如图装置进行实验。操作如下:在相同条件下,用注射器取等量的双氧水,分别加入盛有足量84消毒液和二氧化锰的锥形瓶中,做对照实验,若观察到

您最近一年使用:0次
2024-01-13更新
|
143次组卷
|
2卷引用:甘肃省酒泉市2023-2024学年高二上学期1月期末化学试题
3 . 我国是稀土储量大国,氧化铈 是一种应用广泛的稀土氧化物。为节约和充分利用资源,以废料(主要含
是一种应用广泛的稀土氧化物。为节约和充分利用资源,以废料(主要含 ,还含少量的
,还含少量的 、
、 、
、 )为原料,通过如图工艺流程制备
)为原料,通过如图工艺流程制备 。
。

已知: 具有强氧化性,通常情况下不与无机酸反应。
具有强氧化性,通常情况下不与无机酸反应。
回答下列问题:
(1)“酸浸1”的目的是________________ ,“浸液A”中主要含有的阳离子为________ 。
(2)“酸浸2”中反应的离子方程式为________________________ ;该过程中用浓盐酸代替双氧水和稀硫酸也可反应,但不用浓盐酸的原因是________ ;“浸渣B”的主要成分的主要用途为_____________ (写一种)。
(3)“酸浸2”中Ce的浸出率与 、温度的关系如图所示,应选择的适宜条件为
、温度的关系如图所示,应选择的适宜条件为____________ 。

(4)取上述流程中得到的 产品1.000g,用高氯酸和磷酸的混合液加热溶解,冷却至室温后,与
产品1.000g,用高氯酸和磷酸的混合液加热溶解,冷却至室温后,与 标准溶液恰好完全反应(反应时存在关系式:
标准溶液恰好完全反应(反应时存在关系式: ,其他杂质均不反应),则该产品中
,其他杂质均不反应),则该产品中 的质量分数为
的质量分数为________ (填含c、V的表达式)。
 是一种应用广泛的稀土氧化物。为节约和充分利用资源,以废料(主要含
是一种应用广泛的稀土氧化物。为节约和充分利用资源,以废料(主要含 ,还含少量的
,还含少量的 、
、 、
、 )为原料,通过如图工艺流程制备
)为原料,通过如图工艺流程制备 。
。
已知:
 具有强氧化性,通常情况下不与无机酸反应。
具有强氧化性,通常情况下不与无机酸反应。回答下列问题:
(1)“酸浸1”的目的是
(2)“酸浸2”中反应的离子方程式为
(3)“酸浸2”中Ce的浸出率与
 、温度的关系如图所示,应选择的适宜条件为
、温度的关系如图所示,应选择的适宜条件为
(4)取上述流程中得到的
 产品1.000g,用高氯酸和磷酸的混合液加热溶解,冷却至室温后,与
产品1.000g,用高氯酸和磷酸的混合液加热溶解,冷却至室温后,与 标准溶液恰好完全反应(反应时存在关系式:
标准溶液恰好完全反应(反应时存在关系式: ,其他杂质均不反应),则该产品中
,其他杂质均不反应),则该产品中 的质量分数为
的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 某实验小组用 溶液和
溶液和 硫酸溶液进行中和热的测定。
硫酸溶液进行中和热的测定。
Ⅰ.配制 溶液
溶液
(1)若实验中需要配制 溶液,则需要称量NaOH固体
溶液,则需要称量NaOH固体_______ g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):_______ 。
Ⅱ.中和热的测定:
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。_______ ,实验中还需要用到量取溶液体积的玻璃仪器是_______ 。
(4)取 溶液和30mL硫酸溶液进行实验,实验数据如表。
溶液和30mL硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
②近似认为 溶液和
溶液和 硫酸溶液的密度都是
硫酸溶液的密度都是 ,中和后生成溶液的比热容
,中和后生成溶液的比热容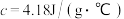 。则中和热
。则中和热
_______  (保留一位小数)。
(保留一位小数)。
③上述实验数值结果与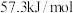 有偏差,产生偏差的原因可能是
有偏差,产生偏差的原因可能是_______ (填字母)。
a.实验装置保温、隔热效果差
b.配制 溶液时俯视刻度线读数
溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用量筒量取NaOH溶液的体积时仰视读数
 溶液和
溶液和 硫酸溶液进行中和热的测定。
硫酸溶液进行中和热的测定。Ⅰ.配制
 溶液
溶液(1)若实验中需要配制
 溶液,则需要称量NaOH固体
溶液,则需要称量NaOH固体(2)从图中选择称量NaOH固体所需要的仪器是(填字母):
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |
|
|
|
|
|
|
| 序号 | a | b | c | d | e | f |
Ⅱ.中和热的测定:
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(4)取
 溶液和30mL硫酸溶液进行实验,实验数据如表。
溶液和30mL硫酸溶液进行实验,实验数据如表。①请填写表中的空白:
温度 实验次数 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | 温度差平均值( )/℃ )/℃ | ||
 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
 溶液和
溶液和 硫酸溶液的密度都是
硫酸溶液的密度都是 ,中和后生成溶液的比热容
,中和后生成溶液的比热容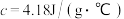 。则中和热
。则中和热
 (保留一位小数)。
(保留一位小数)。③上述实验数值结果与
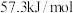 有偏差,产生偏差的原因可能是
有偏差,产生偏差的原因可能是a.实验装置保温、隔热效果差
b.配制
 溶液时俯视刻度线读数
溶液时俯视刻度线读数c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用量筒量取NaOH溶液的体积时仰视读数
您最近一年使用:0次
2023-02-01更新
|
239次组卷
|
2卷引用:甘肃省白银市靖远县第四中学2023-2024学年高二下学期开学化学试题
解题方法
5 . 某混合物的无色溶液中,可能含有以下离子中的若干种:K+、Ca2+、Fe3+、NH 、Cl-、CO
、Cl-、CO 和SO
和SO 。现每次取10.00mL进行实验:
。现每次取10.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体448mL(标准状况下);
③第三份加入足量BaCl2溶液后,生成白色沉淀,过滤、干燥,得到固体4.30g,该固体经足量盐酸洗涤,干燥后剩余2.33g。
(1)c(CO )=
)=___________ mol·L−1;
(2)某同学认为该溶液中一定存在K+,浓度是___________ ;
(3)根据以上实验,氯离子可能存在。检验该离子是否存在的方法是:___________ ;
(4)写出③中固体加入足量盐酸洗涤的离子方程式为___________ 。
 、Cl-、CO
、Cl-、CO 和SO
和SO 。现每次取10.00mL进行实验:
。现每次取10.00mL进行实验:①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体448mL(标准状况下);
③第三份加入足量BaCl2溶液后,生成白色沉淀,过滤、干燥,得到固体4.30g,该固体经足量盐酸洗涤,干燥后剩余2.33g。
(1)c(CO
 )=
)=(2)某同学认为该溶液中一定存在K+,浓度是
(3)根据以上实验,氯离子可能存在。检验该离子是否存在的方法是:
(4)写出③中固体加入足量盐酸洗涤的离子方程式为
您最近一年使用:0次
6 . 某合金X由常见的两种元素组成。为探究该合金X的元素组成和性质,设计并进行如下实验:

根据上述信息,回答下列问题:
(1)X的化学式为_______ 。
(2)实验过程中无色气体A的收集方法为_______ 。
(3)用离子方程式解释溶液中滴加H2O2后呈血红色的原因_______ 。

根据上述信息,回答下列问题:
(1)X的化学式为
(2)实验过程中无色气体A的收集方法为
(3)用离子方程式解释溶液中滴加H2O2后呈血红色的原因
您最近一年使用:0次
2022-06-11更新
|
221次组卷
|
2卷引用:甘肃省武威第十八中学2021-2022学年高二下学期期末考试化学试卷
名校
解题方法
7 . 为了探究硫、碳、硅元素的非金属性的相对强弱,某实验小组设计了如图装置。_______ 。
(2)实验步骤:连接仪器、_______ 、加药品后、打开a、滴入浓硫酸、加热。
(3)问题探究
①装置D中足量酸性 溶液的作用是
溶液的作用是_______ 。
②实验装置E中有白色沉淀生成,_______ (填“能”或“不能”)作为判断碳元素的非金属性比硅元素非金属性强的依据,请说明理由:_______ 。
③写出铜与浓硫酸反应的化学方程式:_______ 。
(4)设计实验比较 和
和 的氧化性,操作与现象是取少量新制氯水和
的氧化性,操作与现象是取少量新制氯水和 于试管中,
于试管中,_______ 。
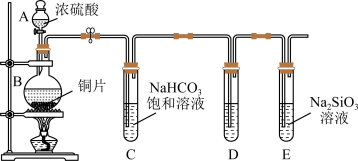
(2)实验步骤:连接仪器、
(3)问题探究
①装置D中足量酸性
 溶液的作用是
溶液的作用是②实验装置E中有白色沉淀生成,
③写出铜与浓硫酸反应的化学方程式:
(4)设计实验比较
 和
和 的氧化性,操作与现象是取少量新制氯水和
的氧化性,操作与现象是取少量新制氯水和 于试管中,
于试管中,
您最近一年使用:0次
2022-05-05更新
|
190次组卷
|
3卷引用:甘肃省临洮中学2021-2022学年高二下学期期中考试化学试题
名校
解题方法
8 . 铁红(Fe2O3)常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为Fe2O3、Fe3O4,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:

回答下列问题:
(1)工业常将硫铁矿烧渣经过粉碎后再进行“酸浸”,其目的是_______ 。
(2)“酸浸”时加入的硫酸不宜过量太多的原因是_______ 。
(3)“过滤1”所得滤液中含有的阳离子有_______ 。
(4)“过滤2”所得滤渣的主要成分为FeOOH和FeCO3,所得滤液中的主要溶质是_______ (填化学式)。
(5)写出FeCO3在空气中焙烧生成铁红的化学方程式:_______ 。

回答下列问题:
(1)工业常将硫铁矿烧渣经过粉碎后再进行“酸浸”,其目的是
(2)“酸浸”时加入的硫酸不宜过量太多的原因是
(3)“过滤1”所得滤液中含有的阳离子有
(4)“过滤2”所得滤渣的主要成分为FeOOH和FeCO3,所得滤液中的主要溶质是
(5)写出FeCO3在空气中焙烧生成铁红的化学方程式:
您最近一年使用:0次
9 . 下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
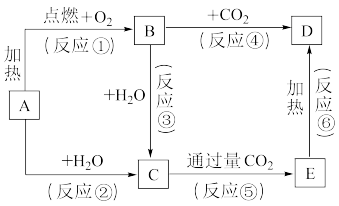
请填写下列空白:
(1)写出B的化学式:___________ 。
(2)以上反应中,属于氧化还原反应的有___________ (填写编号)
(3)写出A→C反应的离子方程式:___________ ,写出E→D的化学方程式:___________ 。

请填写下列空白:
(1)写出B的化学式:
(2)以上反应中,属于氧化还原反应的有
(3)写出A→C反应的离子方程式:
您最近一年使用:0次
名校
10 . 下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)在此元素周期表的一部分中,金属性最强的元素是___________ (填元素符号)。
(2)⑤、⑥的原子半径由大到小的顺序为___________ (填元素符号)。
(3)⑦、⑧两种元素的氢化物稳定性较强的是___________ (用化学式表示)。
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的化学式:___________ 。

(1)在此元素周期表的一部分中,金属性最强的元素是
(2)⑤、⑥的原子半径由大到小的顺序为
(3)⑦、⑧两种元素的氢化物稳定性较强的是
(4)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的化学式:
您最近一年使用:0次









