1 . 氯、铁及其化合物在很多领域有重要的用途。
Ⅰ.“84消毒液”能有效杀灭新冠病毒,其有效成分是NaClO。已知某“84消毒液”中NaClO的物质的量浓度为4.00 mol/L。
(1)某化学实验小组用该品牌消毒液配制480 mL0.20 mol/L的NaClO稀溶液,需要此消毒液___________ mL。
(2)完成上述实验必须用到的仪器有玻璃棒、烧杯、胶头滴管、量筒、还有___________ 。
(3)请写出用氢氧化钠溶液和氯气反应制备“84消毒液”的化学方程式:___________ 。
Ⅱ.某工厂的工业废水中含有大量的FeSO4和较多的Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属铜。请根据以下流程图,回答下列问题:

(4)操作a的名称为___________ 。
(5)工业上常用绿矾(FeSO4·7H2O)处理工业废水中有毒的重铬酸根离子( )。反应的离子方程式为
)。反应的离子方程式为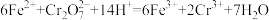 。该反应中
。该反应中___________ 是还原剂;若消耗1 mol Cr2O ,则转移电子的物质的量为
,则转移电子的物质的量为___________ mol。
(6)若取2 mL溶液⑥加入试管中,然后滴加氢氧化钠溶液,产生的现象是___________ 。
Ⅰ.“84消毒液”能有效杀灭新冠病毒,其有效成分是NaClO。已知某“84消毒液”中NaClO的物质的量浓度为4.00 mol/L。
(1)某化学实验小组用该品牌消毒液配制480 mL0.20 mol/L的NaClO稀溶液,需要此消毒液
(2)完成上述实验必须用到的仪器有玻璃棒、烧杯、胶头滴管、量筒、还有
(3)请写出用氢氧化钠溶液和氯气反应制备“84消毒液”的化学方程式:
Ⅱ.某工厂的工业废水中含有大量的FeSO4和较多的Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收FeSO4和金属铜。请根据以下流程图,回答下列问题:

(4)操作a的名称为
(5)工业上常用绿矾(FeSO4·7H2O)处理工业废水中有毒的重铬酸根离子(
 )。反应的离子方程式为
)。反应的离子方程式为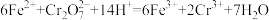 。该反应中
。该反应中 ,则转移电子的物质的量为
,则转移电子的物质的量为(6)若取2 mL溶液⑥加入试管中,然后滴加氢氧化钠溶液,产生的现象是
您最近一年使用:0次
名校
解题方法
2 . 某校化学实验兴趣小组为了探究 和浓盐酸反应制备
和浓盐酸反应制备 的过程中有水蒸气和
的过程中有水蒸气和 挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。已知:氯气、溴单质、碘单质都易溶于有机溶剂。
挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。已知:氯气、溴单质、碘单质都易溶于有机溶剂。

(1)A中制备氯气的化学反应方程式为:_____ 。
(2)若用含有
 的浓盐酸与足量的
的浓盐酸与足量的 反应制
反应制 ,制得的
,制得的 体积总是小于理论值的原因是
体积总是小于理论值的原因是_____ 。
(3)①装置B中盛放的药品为_____ 。
②装置D和E中出现的不同现象说明_____ 。
③装置F的作用是_____ 。
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入 溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入
溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入 溶液的气体只有一种,乙同学提出在F与G之间加一个检验装置,装置中应放
溶液的气体只有一种,乙同学提出在F与G之间加一个检验装置,装置中应放_____ 。
A. 溶液 B.湿润的淀粉
溶液 B.湿润的淀粉 试纸 C.浓硫酸
试纸 C.浓硫酸
 和浓盐酸反应制备
和浓盐酸反应制备 的过程中有水蒸气和
的过程中有水蒸气和 挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。已知:氯气、溴单质、碘单质都易溶于有机溶剂。
挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题。已知:氯气、溴单质、碘单质都易溶于有机溶剂。
(1)A中制备氯气的化学反应方程式为:
(2)若用含有

 的浓盐酸与足量的
的浓盐酸与足量的 反应制
反应制 ,制得的
,制得的 体积总是小于理论值的原因是
体积总是小于理论值的原因是(3)①装置B中盛放的药品为
②装置D和E中出现的不同现象说明
③装置F的作用是
(4)乙同学认为甲同学的实验有缺陷,不能确保最终通入
 溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入
溶液中的气体只有一种,为了确保实验结论的可靠性,证明最终通入 溶液的气体只有一种,乙同学提出在F与G之间加一个检验装置,装置中应放
溶液的气体只有一种,乙同学提出在F与G之间加一个检验装置,装置中应放A.
 溶液 B.湿润的淀粉
溶液 B.湿润的淀粉 试纸 C.浓硫酸
试纸 C.浓硫酸
您最近一年使用:0次
2023-08-11更新
|
181次组卷
|
4卷引用:山西省朔州市怀仁市第九中学高中部2023-2024学年高二上学期11月期中化学试题
名校
解题方法
3 . 钨锰铁矿也叫黑钨矿,主要成分是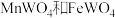 ,以下是湿法炼钨并回收废渣中锰的工艺流程:
,以下是湿法炼钨并回收废渣中锰的工艺流程:
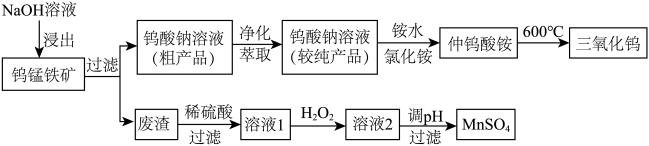
有关信息
①钨酸钠: ;仲钨酸铵:
;仲钨酸铵: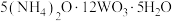
②相关离子沉降pH范围如表:
(1)为了加快氢氧化钠溶液和钨矿粉的“浸出”速率,可采取哪些措施:___________ (写出两种)。
(2)“废渣”主要有两个成分,其中一个成分在空气中由白色变成灰绿色到红褐色,请写出黑钨矿中 和氢氧化钠“浸出”化学方程式:
和氢氧化钠“浸出”化学方程式:___________ 。
(3)焦炭和氢气都可以将三氧化钨还原成钨单质,但工业上常用氢气作还原剂,不用焦炭的原因是___________ 。
(4)“溶液1”加 发生的离子方程式:
发生的离子方程式:___________ 。
(5)“调pH”的范围:___________ 。
(6)已知 溶度积
溶度积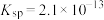 ,表中
,表中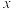 值为
值为___________ (已知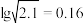 ,计算结果保留1位小数)。
,计算结果保留1位小数)。
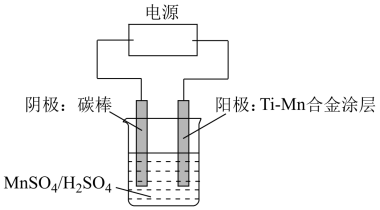
(7)下面是电解硫酸锰制备二氧化锰的简易示意图,阴极有无色气体产生,请写出阳极电极反应式:___________ 。
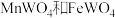 ,以下是湿法炼钨并回收废渣中锰的工艺流程:
,以下是湿法炼钨并回收废渣中锰的工艺流程:
有关信息
①钨酸钠:
 ;仲钨酸铵:
;仲钨酸铵: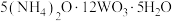
②相关离子沉降pH范围如表:
| 金属离子 | 开始沉淀pH | 完全沉淀pH |
 | 7 | 9 |
 | 1.9 | 3.2 |
 | 8.1 | 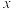 |
(2)“废渣”主要有两个成分,其中一个成分在空气中由白色变成灰绿色到红褐色,请写出黑钨矿中
 和氢氧化钠“浸出”化学方程式:
和氢氧化钠“浸出”化学方程式:(3)焦炭和氢气都可以将三氧化钨还原成钨单质,但工业上常用氢气作还原剂,不用焦炭的原因是
(4)“溶液1”加
 发生的离子方程式:
发生的离子方程式:(5)“调pH”的范围:
(6)已知
 溶度积
溶度积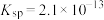 ,表中
,表中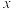 值为
值为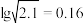 ,计算结果保留1位小数)。
,计算结果保留1位小数)。(7)下面是电解硫酸锰制备二氧化锰的简易示意图,阴极有无色气体产生,请写出阳极电极反应式:

您最近一年使用:0次
4 . 硼镁泥是可贵的镁资源。硼镁泥的主要成分为 、
、 ,还含少量的
,还含少量的 、
、 、
、 、CaO、MnO,利用硼镁泥制备
、CaO、MnO,利用硼镁泥制备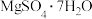 的工艺流程如图所示。
的工艺流程如图所示。

已知:①抽滤可以达到加速过滤的目的。
②常温下,部分金属阳离子以氢氧化物形式沉淀时溶液的pH范围如下表:
③两种盐的溶解度曲线如图:

请回答下列问题:
(1)“酸浸”时,加入的酸为_______ (填名称),“酸浸”时,一般煮沸10min,这样做的目的是_______ 。
(2)“滤渣1”的主要成分为_______ (写化学式)。
(3)“滤渣2”中含有 、
、 、
、 ,为了调节pH至6,物质Y可选用
,为了调节pH至6,物质Y可选用_______ ,检验铁离子是否完全沉淀的操作为_______ 。
(4)pH=6时,加入NaClO固体后,写出NaClO涉及反应的离子方程式:_______ 、_______ 。
(5)“操作Z”是为了除去硫酸钙,依据溶解度曲线,“操作Z”为蒸发浓缩、_______ ;“一系列操作”为_______ 、洗涤、干燥。
 、
、 ,还含少量的
,还含少量的 、
、 、
、 、CaO、MnO,利用硼镁泥制备
、CaO、MnO,利用硼镁泥制备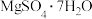 的工艺流程如图所示。
的工艺流程如图所示。
已知:①抽滤可以达到加速过滤的目的。
②常温下,部分金属阳离子以氢氧化物形式沉淀时溶液的pH范围如下表:
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Fe2+ | Mg2+ |
| pH范围 | 1.5~2.8 | 3.4~4.7 | 8.1~10.1 | 6.3~8.3 | 9.9~11.9 |

请回答下列问题:
(1)“酸浸”时,加入的酸为
(2)“滤渣1”的主要成分为
(3)“滤渣2”中含有
 、
、 、
、 ,为了调节pH至6,物质Y可选用
,为了调节pH至6,物质Y可选用(4)pH=6时,加入NaClO固体后,写出NaClO涉及反应的离子方程式:
(5)“操作Z”是为了除去硫酸钙,依据溶解度曲线,“操作Z”为蒸发浓缩、
您最近一年使用:0次
2023-04-21更新
|
126次组卷
|
2卷引用:山西省吕梁市孝义市2022-2023学年高二下学期3月月考化学试题
5 . 含氯物质在生产生活中有重要作用,某研究性学习小组用如图装置制备氯气并对氯气及其化合物的性质进行实验探究。

回答下列问题:
(1)制取干燥 时,仪器连接顺序为→_______→_______→_______
时,仪器连接顺序为→_______→_______→______________ (用接口字母表示)。
(2)该实验制取 的化学方程式为
的化学方程式为_______ 。
(3) 通入水中制得氯水。某氯水久置后不能使品红溶液褪色,可推测氯水中
通入水中制得氯水。某氯水久置后不能使品红溶液褪色,可推测氯水中_______ (填化学式)已分解,检验此久置氯水中 存在的操作及现象是
存在的操作及现象是_______ 。
(4)若将装置D中集气瓶换成盛紫色石蕊溶液的锥形瓶,锥形瓶中溶液颜色的变化为______ 。
(5)烧杯中NaOH溶液的作用是______ ,还可选用试剂______ (填字母)。
A. 溶液 B.NaCl溶液 C.KOH溶液 D.
溶液 B.NaCl溶液 C.KOH溶液 D.  溶液
溶液

回答下列问题:
(1)制取干燥
 时,仪器连接顺序为→_______→_______→_______
时,仪器连接顺序为→_______→_______→_______(2)该实验制取
 的化学方程式为
的化学方程式为(3)
 通入水中制得氯水。某氯水久置后不能使品红溶液褪色,可推测氯水中
通入水中制得氯水。某氯水久置后不能使品红溶液褪色,可推测氯水中 存在的操作及现象是
存在的操作及现象是(4)若将装置D中集气瓶换成盛紫色石蕊溶液的锥形瓶,锥形瓶中溶液颜色的变化为
(5)烧杯中NaOH溶液的作用是
A.
 溶液 B.NaCl溶液 C.KOH溶液 D.
溶液 B.NaCl溶液 C.KOH溶液 D.  溶液
溶液
您最近一年使用:0次
名校
解题方法
6 . 柠檬酸亚铁(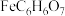 )是一种易吸收的高效铁制剂,工业上以硫铁矿(主要成分为
)是一种易吸收的高效铁制剂,工业上以硫铁矿(主要成分为 )为原料,制备柠檬酸亚铁,其流程如下:
)为原料,制备柠檬酸亚铁,其流程如下:

回答下列问题:
(1)在空气中焙烧时产生对环境有危害的气体是_______ (填化学式);培烧后得到的固体主要成分为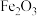 ,焙烧时反应的化学方程式是
,焙烧时反应的化学方程式是_______ 。
(2)滤渣1的成分为_______ (填化学式)。
(3)“还原”过程中与 有关的离子方程式为
有关的离子方程式为_______ ;加入Fe粉还原后,可用_______ (填试剂)检验还原反应是否已经完全反应。
(4)“沉铁”时,反应温度不宜太高的可能原因是_______ 。
(5)生成的 固体需充分洗涤,检验洗涤是否完全的方法是
固体需充分洗涤,检验洗涤是否完全的方法是_______ 。
(6)将制得的 加入到足量柠檬酸溶液中,充分反应后再加入少量铁粉。铁粉的作用是
加入到足量柠檬酸溶液中,充分反应后再加入少量铁粉。铁粉的作用是_______ 。
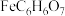 )是一种易吸收的高效铁制剂,工业上以硫铁矿(主要成分为
)是一种易吸收的高效铁制剂,工业上以硫铁矿(主要成分为 )为原料,制备柠檬酸亚铁,其流程如下:
)为原料,制备柠檬酸亚铁,其流程如下:
回答下列问题:
(1)在空气中焙烧时产生对环境有危害的气体是
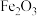 ,焙烧时反应的化学方程式是
,焙烧时反应的化学方程式是(2)滤渣1的成分为
(3)“还原”过程中与
 有关的离子方程式为
有关的离子方程式为(4)“沉铁”时,反应温度不宜太高的可能原因是
(5)生成的
 固体需充分洗涤,检验洗涤是否完全的方法是
固体需充分洗涤,检验洗涤是否完全的方法是(6)将制得的
 加入到足量柠檬酸溶液中,充分反应后再加入少量铁粉。铁粉的作用是
加入到足量柠檬酸溶液中,充分反应后再加入少量铁粉。铁粉的作用是
您最近一年使用:0次
2022-10-14更新
|
180次组卷
|
2卷引用:山西省长治市、忻州市2022-2023学年高二上学期10月月考化学试题
解题方法
7 . 有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C燃烧时呈现黄色火焰,C的单质在点燃条件下与B的单质充分反应,可以得到淡黄色固态化合物,D的M层电子数为K层电子数的3倍。试根据以上叙述回答:
(1)写出元素名称:A_______ 、D_______ ;
(2)画出D的原子结构示意图_______ ;
(1)写出元素名称:A
(2)画出D的原子结构示意图
您最近一年使用:0次
解题方法
8 . 高铁酸盐是优良的多功能水处理剂。 为紫色固体,可溶于水,微溶于KOH浓溶液,难溶于有机物;在
为紫色固体,可溶于水,微溶于KOH浓溶液,难溶于有机物;在 的强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
的强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 。某实验小组制备高铁酸钾
。某实验小组制备高铁酸钾 的装置如图所示。
的装置如图所示。
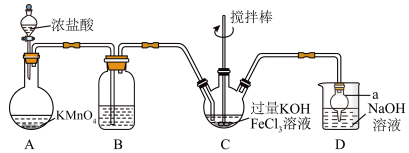
回答下列问题:
(1)仪器a的名称为_______ 。
(2)装置A中发生反应的离子方程式为_______ 。
(3)装置B中盛放的试剂为饱和氯化钠溶液,主要作用是除去挥发出来的氯化氢气体,还有一个作用是_______ 。
(4)装置C中生成 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为_______ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
(5)装置D中尾气处理时,除了生成 、
、 外,还有可能生成
外,还有可能生成_______ (填化学式)。
(6)往装有一定量的 晶体的试管中滴入稀硫酸,振荡。
晶体的试管中滴入稀硫酸,振荡。
①写出其发生反应的离子方程式:_______ 。
②检验生成气体为氧气的方法是_______ 。
 为紫色固体,可溶于水,微溶于KOH浓溶液,难溶于有机物;在
为紫色固体,可溶于水,微溶于KOH浓溶液,难溶于有机物;在 的强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
的强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 。某实验小组制备高铁酸钾
。某实验小组制备高铁酸钾 的装置如图所示。
的装置如图所示。
回答下列问题:
(1)仪器a的名称为
(2)装置A中发生反应的离子方程式为
(3)装置B中盛放的试剂为饱和氯化钠溶液,主要作用是除去挥发出来的氯化氢气体,还有一个作用是
(4)装置C中生成
 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为(5)装置D中尾气处理时,除了生成
 、
、 外,还有可能生成
外,还有可能生成(6)往装有一定量的
 晶体的试管中滴入稀硫酸,振荡。
晶体的试管中滴入稀硫酸,振荡。①写出其发生反应的离子方程式:
②检验生成气体为氧气的方法是
您最近一年使用:0次
2022-05-01更新
|
226次组卷
|
3卷引用:山西省长治市2021-2022学年高二下学期期末联考化学试题
解题方法
9 . X、Y、Z、L、M五种元素的原子序数依次增大,X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量较高的金属元素,回答下列问题:
(1)L的元素符号为___________ ;五种元素的原子半径从大到小的顺序为___________ (用元素符号表示)。
(2)Z、X两元素原子数目比1:3和2:4构成分子A和B,A的电子式为___________ ,B的结构式为___________ 。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的E原子序数为___________ ,其最高价氧化物对应的水化物的化学式为___________ 。
(4)Z的最简单气态氢化物甲的水溶液显碱性,在微电子工业中,甲的水溶液可作刻蚀剂 的清除剂,且产物不污染环境,该过程发生反应的化学方程式为
的清除剂,且产物不污染环境,该过程发生反应的化学方程式为___________ 。
(1)L的元素符号为
(2)Z、X两元素原子数目比1:3和2:4构成分子A和B,A的电子式为
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的E原子序数为
(4)Z的最简单气态氢化物甲的水溶液显碱性,在微电子工业中,甲的水溶液可作刻蚀剂
 的清除剂,且产物不污染环境,该过程发生反应的化学方程式为
的清除剂,且产物不污染环境,该过程发生反应的化学方程式为
您最近一年使用:0次
10 . 亚硝酸钠( )的外观与NaCl相似,有毒。它在工业上可作染料、助染剂,医药上能用作器碱消毒剂、防腐剂等。
)的外观与NaCl相似,有毒。它在工业上可作染料、助染剂,医药上能用作器碱消毒剂、防腐剂等。
已知:
① 有强氧化性又有还原性;
有强氧化性又有还原性;
②NO能被酸性 氧化成硝酸根离子。
氧化成硝酸根离子。
某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的 。
。
反应原理为:

回答下列问题:
(1)甲装置中盛稀硝酸的仪器名称是___________ ;反应过程中观察到丙中的现象为___________ 。
(2)甲装置中发生反应的化学方程式:___________ 。
(3)甲中滴入稀硝酸前需先通入 ,原因是
,原因是___________ 。
(4)丁中酸性 的作用
的作用___________ 。
(5)人体正常的血红蛋白含有 ,但若误食亚硝酸钠,会导致血红蛋白含有的
,但若误食亚硝酸钠,会导致血红蛋白含有的 转化为
转化为 而中毒,服用维生素C可解毒。解毒时维生素C的作用是
而中毒,服用维生素C可解毒。解毒时维生素C的作用是___________ (填“还原性”或“氧化性”)。
(6)某学生将新制氯水滴加到 溶液中,观察到氯水褪色,生成
溶液中,观察到氯水褪色,生成 利HCl,写出该反应的离子方程式:
利HCl,写出该反应的离子方程式:___________ 。
 )的外观与NaCl相似,有毒。它在工业上可作染料、助染剂,医药上能用作器碱消毒剂、防腐剂等。
)的外观与NaCl相似,有毒。它在工业上可作染料、助染剂,医药上能用作器碱消毒剂、防腐剂等。已知:
①
 有强氧化性又有还原性;
有强氧化性又有还原性;②NO能被酸性
 氧化成硝酸根离子。
氧化成硝酸根离子。某兴趣小组用下列装置(夹持仪器已省略)制取较纯净的
 。
。反应原理为:


回答下列问题:
(1)甲装置中盛稀硝酸的仪器名称是
(2)甲装置中发生反应的化学方程式:
(3)甲中滴入稀硝酸前需先通入
 ,原因是
,原因是(4)丁中酸性
 的作用
的作用(5)人体正常的血红蛋白含有
 ,但若误食亚硝酸钠,会导致血红蛋白含有的
,但若误食亚硝酸钠,会导致血红蛋白含有的 转化为
转化为 而中毒,服用维生素C可解毒。解毒时维生素C的作用是
而中毒,服用维生素C可解毒。解毒时维生素C的作用是(6)某学生将新制氯水滴加到
 溶液中,观察到氯水褪色,生成
溶液中,观察到氯水褪色,生成 利HCl,写出该反应的离子方程式:
利HCl,写出该反应的离子方程式:
您最近一年使用:0次
2022-03-07更新
|
391次组卷
|
3卷引用:山西省怀仁市大地中学高中部2021-2022学年高二下学期第三次月考化学试题
山西省怀仁市大地中学高中部2021-2022学年高二下学期第三次月考化学试题陕西省渭南市大荔县2021-2022学年高一上学期期末考试化学试题(已下线)【期末复习】必刷题(1)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)



