1 . 84消毒液适用于家庭、医院、饭店及其他公共场所的物体表面消毒。某小组针对84消毒液的性质展开探究。
实验一:探究84消毒液的氧化性
资料显示:洁厕灵(含盐酸)和84消毒液不能混合使用,否则易产生有毒气体。
他们利用如图所示装置探究上述资料的真实性。
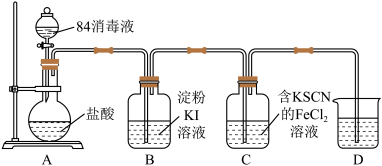
(1)盛装84消毒液的仪器名称是
(2)D装置中应盛装
(3)若B装置中出现
(4)若实验中观察到C装置中溶液先变红色后变黄色,则红色变黄色的原因可能是
实验二:探究84消毒液的漂白性
(5)一定体积和浓度的84消毒液的漂白效率与温度的关系如图所示:
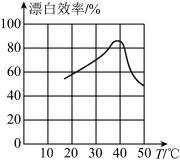
温度高于40℃时,漂白效率急剧减弱的原因可能是
(6)为了探究84消毒液的漂白效率与pH的关系,设计如下实验:
3%的84消毒液 |
|
| 5%品红溶液 | 蒸馏水 | 实验现象 | |
① | 0 | 0 | 2mL | 5滴 | 0 | 不褪色 |
② | 0 | 2mL | 0 | 5滴 | 0 | 不褪色 |
③ | 10mL | 0 | 0 | 5滴 | 5mL | 较快褪色 |
④ | 10mL | 2mL | 0 | 5滴 | 3mL | 缓慢褪色 |
⑤ | 10mL | 0 | 2mL | 5滴 | 3mL | 很快褪色 |
由上述实验可得出的结论是
您最近一年使用:0次
解题方法
2 . 实验室用NaCl固体配制 的NaCl溶液。
的NaCl溶液。
(1)需要用托盘天平称取NaCl固体___________ g。
(2)配制溶液时,必须用的玻璃仪器有烧杯、玻璃棒、量筒___________ 、___________ ,其中,玻璃棒作用是___________ 。
(3)用胶头滴管滴加蒸馏水至刻度线时,某同学俯视容量瓶上的刻度线,最后配成的溶液中NaCl的实际浓度比所要求的___________ (填“偏大”或“偏小”)。
 的NaCl溶液。
的NaCl溶液。(1)需要用托盘天平称取NaCl固体
(2)配制溶液时,必须用的玻璃仪器有烧杯、玻璃棒、量筒
(3)用胶头滴管滴加蒸馏水至刻度线时,某同学俯视容量瓶上的刻度线,最后配成的溶液中NaCl的实际浓度比所要求的
您最近一年使用:0次
3 . 高铁酸钾( )是一种高效净水剂。已知:
)是一种高效净水剂。已知: 易溶于水,其溶液呈紫色、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。某小组同学用下图装置制备并探究
易溶于水,其溶液呈紫色、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。某小组同学用下图装置制备并探究 的性质。
的性质。
制备原理: ,装置如图所示(夹持装置略)
,装置如图所示(夹持装置略)

回答下列问题:
(1)安装好仪器后先进行的操作是___________ ;
(2)盛放浓盐酸的仪器名称___________ ;C装置的作用是___________ 。
(3)装置A中反应的化学方程式是___________ 。
(4)实验时采用冰水浴的原因是_______ ,此装置存在一处明显缺陷,请指出________ 。
(5) 粗产品含有
粗产品含有 、KCl等杂质,一般用75%乙醇进行洗涤,不用水洗的原因是
、KCl等杂质,一般用75%乙醇进行洗涤,不用水洗的原因是___________ 。
 )是一种高效净水剂。已知:
)是一种高效净水剂。已知: 易溶于水,其溶液呈紫色、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。某小组同学用下图装置制备并探究
易溶于水,其溶液呈紫色、微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。某小组同学用下图装置制备并探究 的性质。
的性质。制备原理:
 ,装置如图所示(夹持装置略)
,装置如图所示(夹持装置略)
回答下列问题:
(1)安装好仪器后先进行的操作是
(2)盛放浓盐酸的仪器名称
(3)装置A中反应的化学方程式是
(4)实验时采用冰水浴的原因是
(5)
 粗产品含有
粗产品含有 、KCl等杂质,一般用75%乙醇进行洗涤,不用水洗的原因是
、KCl等杂质,一般用75%乙醇进行洗涤,不用水洗的原因是
您最近一年使用:0次
名校
解题方法
4 . 已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,M为红褐色。
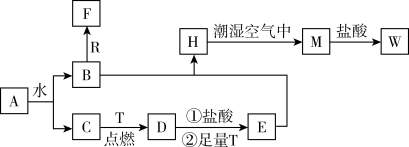
请回答下列问题:
(1)A的电子式是______ ,R元素在元素周期表中位置为______ ,D的俗称是______ 。
(2)A与水反应的离子方程式为__________________ 。
(3)检验W溶液中金属阳离子的操作方法是__________________ 。
(4)H转化为M的化学方程式为__________________ 。

请回答下列问题:
(1)A的电子式是
(2)A与水反应的离子方程式为
(3)检验W溶液中金属阳离子的操作方法是
(4)H转化为M的化学方程式为
您最近一年使用:0次
名校
解题方法
5 . 某研究小组利用含硫酸亚铁和硫酸铜的工业废料制备铁红 氧化铁
氧化铁 和硫酸铵晶体。流程如图:
和硫酸铵晶体。流程如图:
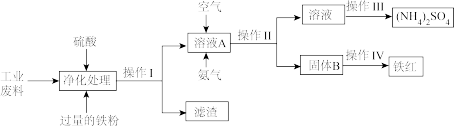
请回答下列问题:
(1)操作Ⅰ的名称是_____________ ,滤渣的成分为______________ 。
(2)简述下列实验操作:
①检验溶液A中金属阳离子的方法为__________________________ ;
②检验固体B是否被洗涤干净的方法是____________ 。
(3)测定废料中硫酸铜的质量分数:称取a g废料样品,将操作Ⅰ得到的滤渣用足量稀硫酸溶解、过滤、洗涤、干燥,称得固体质量为b g,则废料中硫酸铜的质量分数______________  写出含a、b的表达式
写出含a、b的表达式 。
。
 氧化铁
氧化铁 和硫酸铵晶体。流程如图:
和硫酸铵晶体。流程如图:
请回答下列问题:
(1)操作Ⅰ的名称是
(2)简述下列实验操作:
①检验溶液A中金属阳离子的方法为
②检验固体B是否被洗涤干净的方法是
(3)测定废料中硫酸铜的质量分数:称取a g废料样品,将操作Ⅰ得到的滤渣用足量稀硫酸溶解、过滤、洗涤、干燥,称得固体质量为b g,则废料中硫酸铜的质量分数
 写出含a、b的表达式
写出含a、b的表达式 。
。
您最近一年使用:0次
名校
解题方法
6 . 4种相邻主族短周期元素的相对位置如下表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
回答下列问题:
(1)元素x在周期表中的位置是_______________________ ,其单质可采用电解法方法制备,其反应方程式为_________________________________ 。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是___________ ,碱性最强的是________________ 。 填化学式
填化学式
(3)气体分子 的电子式为
的电子式为___________________________ , 称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为
称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为_________________ 。
| m | n | ||
| x | y |
(1)元素x在周期表中的位置是
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是
 填化学式
填化学式
(3)气体分子
 的电子式为
的电子式为 称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为
称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为
您最近一年使用:0次
7 . 某研究性学习小组欲探究氯气的化学性质,设计的实验装置如图所示。

已知:该装置气密性良好,铁粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铁粉被空气中的氧气氧化,在加热之前应该进行的操作为___________ 。
(2)实验中,观察到紫色石蕊溶液颜色的变化为___________ 。
(3)实验装置中空试管的作用是___________ 。
(4)烧杯中氢氧化钠溶液的作用是___________ ,此处发生反应的化学方程式为___________ 。
(5)实验进行一段时间后,盛水的试管中液体的颜色为___________ ,说明氯气___________ (填“能”或“不能”)溶于水。

已知:该装置气密性良好,铁粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铁粉被空气中的氧气氧化,在加热之前应该进行的操作为
(2)实验中,观察到紫色石蕊溶液颜色的变化为
(3)实验装置中空试管的作用是
(4)烧杯中氢氧化钠溶液的作用是
(5)实验进行一段时间后,盛水的试管中液体的颜色为
您最近一年使用:0次
2021-03-01更新
|
144次组卷
|
3卷引用:海南省2020-2021学年高二上学期期末考试化学试题
解题方法
8 . 高铁酸钾(K2FeO4)是一种新型、高效的多功能绿色消毒剂,下列为制备K2FeO4的几种方案。按要求回答下列问题:
方案一:以绿矾(FeSO4·7H2O)为原料,通过铁黄(FeOOH,一种不溶于水的黄色固体)制备高铁酸钾(K2FeO4)可降低生产成本且产品质量优,工艺流程如图:
FeSO4溶液 铁黄(FeOOH)
铁黄(FeOOH) Na2FeO4
Na2FeO4 K2FeO4晶体
K2FeO4晶体
(1)写出由高铁酸钠制得高铁酸钾的化学方程式:___________ 。
方案二:以硫酸铁为原料加入过量NaOH溶液,同时加入NaClO溶液。充分反应后,加入过量饱和KOH溶液,使高铁酸钾析出。
(2)此方案中生成高铁酸钠的离子方程式为___________ 。
(3)碱性条件下,氧化性:NaClO___________ (填“>”或“<”)Na2FeO4。
方案三:若将FeSO4固体和Na2O2固体混合,一定条件下可以先制得高铁酸钠;其主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,再转化为高铁酸钾。
(4)该反应中的氧化剂为___________ (填化学式),每生成标准状况下112 mL气体,转移电子的物质的量为___________ mol。
方案一:以绿矾(FeSO4·7H2O)为原料,通过铁黄(FeOOH,一种不溶于水的黄色固体)制备高铁酸钾(K2FeO4)可降低生产成本且产品质量优,工艺流程如图:
FeSO4溶液
 铁黄(FeOOH)
铁黄(FeOOH) Na2FeO4
Na2FeO4 K2FeO4晶体
K2FeO4晶体(1)写出由高铁酸钠制得高铁酸钾的化学方程式:
方案二:以硫酸铁为原料加入过量NaOH溶液,同时加入NaClO溶液。充分反应后,加入过量饱和KOH溶液,使高铁酸钾析出。
(2)此方案中生成高铁酸钠的离子方程式为
(3)碱性条件下,氧化性:NaClO
方案三:若将FeSO4固体和Na2O2固体混合,一定条件下可以先制得高铁酸钠;其主要反应为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,再转化为高铁酸钾。
(4)该反应中的氧化剂为
您最近一年使用:0次
9 . 某班同学分成A、B两组,并分别设计如下实验探究能较长时间观察到白色Fe(OH)2沉淀的制取方法。回答下列问题:
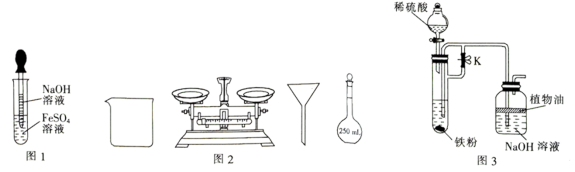
A组实验:用NaOH溶液和FeSO4溶液直接反应。(如图1)
(1)用FeSO4·7H2O固体配制220 mL 0.10 mol·L-1 FeSO4溶液,需要用到的仪器有药匙、玻璃棒、___________ (从图2中选择,填名称)。
(2)该方法能观察到白色的Fe(OH)2沉淀,但沉淀颜色快速发生变化。请分析沉淀颜色变化的原因:___________ (用化学方程式表示)。
B组实验:选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图3。
(3)实验时,先___________ (填“打开”或“关闭”)止水夹K,然后打开___________ 的玻璃塞和活塞,使稀硫酸与铁粉反应,一段时间后,___________ (填“打开”或“关闭”)止水夹K,制得白色Fe(OH)2沉淀,且沉淀能一段时间不变色,原因是___________ 。
A组实验:用NaOH溶液和FeSO4溶液直接反应。(如图1)
(1)用FeSO4·7H2O固体配制220 mL 0.10 mol·L-1 FeSO4溶液,需要用到的仪器有药匙、玻璃棒、

(2)该方法能观察到白色的Fe(OH)2沉淀,但沉淀颜色快速发生变化。请分析沉淀颜色变化的原因:
B组实验:选用稀硫酸、铁粉、NaOH溶液进行实验,装置如图3。
(3)实验时,先
您最近一年使用:0次
2021-03-01更新
|
180次组卷
|
2卷引用:海南省2020-2021学年高二上学期期末考试化学试题
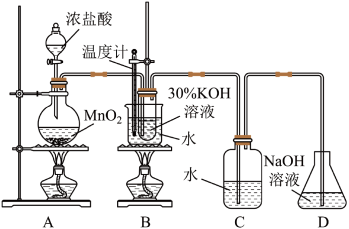
10 . 某化学兴趣小组欲制取氯酸钾和氯水并进行有关探究实验。
实验一:制取氯酸钾和氯水。
利用如图所示的实验装置(部分夹持装置已省略)进行实验。
(1)将Cl2通入B装置中得到的含氯产物为KClO3和KCl,该反应的离子方程式为___ 。
(2)制取实验结束后,取出B中试管冷却结晶、过滤洗涤。过滤时需要用到的玻璃仪器有烧杯、玻璃棒、___ 。
实验二:比较Cl2、Br2、I2的氧化性强弱。
为比较Cl2、Br2、I2的氧化性强弱,设计了如图所示的实验步骤:
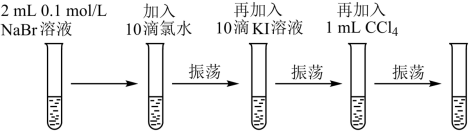
(3)加入10滴氯水时发生反应的离子方程式为___ 。
(4)加入10滴KI溶液时,溶液的颜色由橙黄色变为橙红色,说明氧化性:___ (填“Br2”或“I2”,下同)>___ 。
(5)加入1mLCCl4后,振荡静置,最终试管中的现象为___ 。
实验一:制取氯酸钾和氯水。
利用如图所示的实验装置(部分夹持装置已省略)进行实验。

(1)将Cl2通入B装置中得到的含氯产物为KClO3和KCl,该反应的离子方程式为
(2)制取实验结束后,取出B中试管冷却结晶、过滤洗涤。过滤时需要用到的玻璃仪器有烧杯、玻璃棒、
实验二:比较Cl2、Br2、I2的氧化性强弱。
为比较Cl2、Br2、I2的氧化性强弱,设计了如图所示的实验步骤:

(3)加入10滴氯水时发生反应的离子方程式为
(4)加入10滴KI溶液时,溶液的颜色由橙黄色变为橙红色,说明氧化性:
(5)加入1mLCCl4后,振荡静置,最终试管中的现象为
您最近一年使用:0次


 溶液
溶液

