名校
解题方法
1 . 下表中数据是第三周期的三种金属元素X、Y、Z逐渐失去电子的电离能。
试回答下列问题
(1)根据数据分析,X、Y、Z的最外层电子数,简述理由___________ 。
(2)X元素的原子核外最外层电子排布式为___________ 。
(3)X、Y、Z三种元素的原子半径由大到小顺序为___________ ;X、Y、Z三种元素的离子半径由大到小顺序为___________ 。
(4)第三周期中能与Y元素形成YD型化合物的元素D位于___________ 族,用电子式表示化合物YD的形成过程___________ 。
(5)写出金属Y与石墨电极、稀硫酸构成的原电池的电极反应式:负极:___________ ;正极:___________ 。
| 电离能/kJ•mol-1 | |||||||
| X | 578 | 1817 | 2745 | 11575 | 14830 | 18376 | 23293 |
| Y | 738 | 1451 | 7733 | 10540 | 13630 | 17995 | 21703 |
| Z | 496 | 4562 | 6912 | 9943 | 13353 | 16610 | 20114 |
(1)根据数据分析,X、Y、Z的最外层电子数,简述理由
(2)X元素的原子核外最外层电子排布式为
(3)X、Y、Z三种元素的原子半径由大到小顺序为
(4)第三周期中能与Y元素形成YD型化合物的元素D位于
(5)写出金属Y与石墨电极、稀硫酸构成的原电池的电极反应式:负极:
您最近一年使用:0次
2022·北京·高考真题
2 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
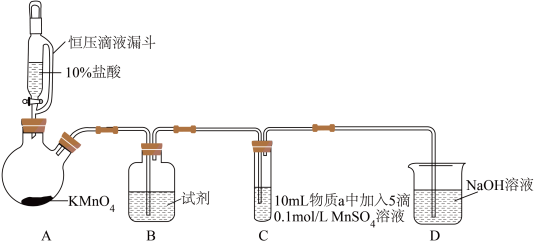
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
801次组卷
|
29卷引用:第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)
(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)2022年北京市高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题2022年北京市高考真题化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题变式题1-14(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京一零一中学2023-2024学年高三上学期11月统练五化学试题(已下线)微专题 物质性质综合实验探究北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题
3 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。如图是以铁屑为原料制备K2FeO4的工艺流程图:
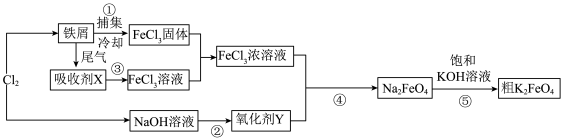
请回答下列问题:
(1)氯气与铁屑反应生成FeCl3的条件是___ 。其生成物氯化铁也可作净水剂,其净水原理为____ 。
(2)流程图中的吸收剂X为____(填字母)。
(3)氯气与NaOH溶液反应生成氧化剂Y的离子方程式为_____ 。
(4)反应④的化学方程式中氧化剂与还原剂的物质的量之比为_______ 。
(5)K2FeO4的净水原理是4FeO +10H2O
+10H2O 4Fe(OH)3+8OH-+3O2↑,该反应生成具有吸附性的Fe(OH)3胶体。提纯K2FeO4往往采用重结晶、洗涤、低温烘干的方法,在提纯过程中洗涤剂可选用稀的KOH溶液,原因是
4Fe(OH)3+8OH-+3O2↑,该反应生成具有吸附性的Fe(OH)3胶体。提纯K2FeO4往往采用重结晶、洗涤、低温烘干的方法,在提纯过程中洗涤剂可选用稀的KOH溶液,原因是____________ 。

请回答下列问题:
(1)氯气与铁屑反应生成FeCl3的条件是
(2)流程图中的吸收剂X为____(填字母)。
| A.NaOH溶液 | B.Fe粉 |
| C.FeSO4溶液 | D.FeCl2溶液 |
(3)氯气与NaOH溶液反应生成氧化剂Y的离子方程式为
(4)反应④的化学方程式中氧化剂与还原剂的物质的量之比为
(5)K2FeO4的净水原理是4FeO
 +10H2O
+10H2O 4Fe(OH)3+8OH-+3O2↑,该反应生成具有吸附性的Fe(OH)3胶体。提纯K2FeO4往往采用重结晶、洗涤、低温烘干的方法,在提纯过程中洗涤剂可选用稀的KOH溶液,原因是
4Fe(OH)3+8OH-+3O2↑,该反应生成具有吸附性的Fe(OH)3胶体。提纯K2FeO4往往采用重结晶、洗涤、低温烘干的方法,在提纯过程中洗涤剂可选用稀的KOH溶液,原因是
您最近一年使用:0次
2023高二·全国·专题练习
解题方法
4 . 如图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。填写下列空白:

(1)B中盛有一定量的NaOH溶液,A中应预先加入的药品是_______ ,A中反应的离子方程式是_______
(2)实验开始时先将止水夹a_______ (填“打开”或“关闭”),其目的是_______

(1)B中盛有一定量的NaOH溶液,A中应预先加入的药品是
(2)实验开始时先将止水夹a
您最近一年使用:0次
5 . 以萃铜余液为原料制备工业活性氧化锌,其生产工艺流程如图所示:

(1)铜萃余液含硫酸30~60g/L,设计采用过硫酸钠(Na2S2O8)氧化法除锰,写出Mn2+被氧化成MnO2的离子方程式___________ ; 采用石灰石粉中和除去铝和铁,则中和渣中主要成分为___________ 。
(2)流程中用到最多的操作是___________ ,该操作中玻璃棒的作用是___________ 。
(3)用锌粉除镉(Cd2+ )的离子方程式为___________ ;沉锌生成碱式碳酸锌[2Zn(OH2)·ZnCO3·H2O]的化学方程式为___________ 。
(4)检验碱式碳酸锌洗涤干净的操作及现象为___________ 。
(5)煅烧炉中发生反应的化学方程式为___________ ,工艺流程设计中选用高效真空负压内转盘浓缩沉锌后液一体化设备生产无水___________ ,蒸发生产过程可实现零排放。

(1)铜萃余液含硫酸30~60g/L,设计采用过硫酸钠(Na2S2O8)氧化法除锰,写出Mn2+被氧化成MnO2的离子方程式
(2)流程中用到最多的操作是
(3)用锌粉除镉(Cd2+ )的离子方程式为
(4)检验碱式碳酸锌洗涤干净的操作及现象为
(5)煅烧炉中发生反应的化学方程式为
您最近一年使用:0次
名校
6 . 元素周期表对化学的发展有很大影响,在材料、能源、环境和生命科学研究上发挥着越来越重要的作用。下表是元素周期表的一部分。
(2)a-h元素的最高价氧化物对应的水化物中,酸性最强的是___________ (填化学式)。
(3)b元素有三种稳定核素,其式量分别为16、17、18,则三种核素的中子数之比为___________ 。
(4)c、g、h三种元素形成的气态氢化物中,稳定性最小的物质的结构式是___________ 。
(5)d元素的简单离子的结构示意图为___________ 。
(6)d的最高价氧化物对应水化物与f的最高价氧化物对应水化物的溶液反应的离子方程式为___________ 。
(7)若d单质着火,可用于灭火的物质是___________。
(8)下列关于元素周期表的叙述正确的是___________。
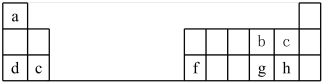
| A.第三周期第6族 | B.第三周期VI主族 |
| C.第三周期第6A族 | D.第三周期VIA族 |
(3)b元素有三种稳定核素,其式量分别为16、17、18,则三种核素的中子数之比为
(4)c、g、h三种元素形成的气态氢化物中,稳定性最小的物质的结构式是
(5)d元素的简单离子的结构示意图为
(6)d的最高价氧化物对应水化物与f的最高价氧化物对应水化物的溶液反应的离子方程式为
(7)若d单质着火,可用于灭火的物质是___________。
| A.自来水 | B.CO2 | C.干沙子 | D.湿抹布 |
| A.元素周期表中所含元素最多的族是BVII族 |
| B.IA族的元素全部是金属元素 |
| C.在元素周期表中金属与非金属的分界处可以找到半导体材料 |
| D.只有IIA族元素的原子最外层有2个电子 |
您最近一年使用:0次
2023-04-25更新
|
192次组卷
|
2卷引用:上海市松江二中2022-2023学年高二下学期期中合格考化学试题
2023高三·全国·专题练习
解题方法
7 . 过氧化钙( )是水产养殖中广泛使用的一种化学试剂。
)是水产养殖中广泛使用的一种化学试剂。 微溶于水,可与水缓慢反应。实验室用如下方法制备
微溶于水,可与水缓慢反应。实验室用如下方法制备 并测定其纯度。
并测定其纯度。
Ⅰ.过氧化钙的制备
实验装置和步骤如下:
步骤1:向盛有 溶液和浓氨水混合液的三颈烧瓶中加入稳定剂,置于冷水浴中;
溶液和浓氨水混合液的三颈烧瓶中加入稳定剂,置于冷水浴中;
步骤2:向上述混合液中逐滴加入浓 溶液,边加边搅拌,析出固体
溶液,边加边搅拌,析出固体 ;
;
步骤3:充分反应后,将所得固体过滤、洗涤、脱水干燥,得产品过氧化钙。

请回答:
(1)支管a的作用为_______ 。
(2)步骤1中将三颈烧瓶置于冷水浴中(反应为放热反应),其主要目的为_______ 。
(3)三颈烧瓶中发生反应的化学方程式为_______ 。
 )是水产养殖中广泛使用的一种化学试剂。
)是水产养殖中广泛使用的一种化学试剂。 微溶于水,可与水缓慢反应。实验室用如下方法制备
微溶于水,可与水缓慢反应。实验室用如下方法制备 并测定其纯度。
并测定其纯度。Ⅰ.过氧化钙的制备
实验装置和步骤如下:
步骤1:向盛有
 溶液和浓氨水混合液的三颈烧瓶中加入稳定剂,置于冷水浴中;
溶液和浓氨水混合液的三颈烧瓶中加入稳定剂,置于冷水浴中;步骤2:向上述混合液中逐滴加入浓
 溶液,边加边搅拌,析出固体
溶液,边加边搅拌,析出固体 ;
;步骤3:充分反应后,将所得固体过滤、洗涤、脱水干燥,得产品过氧化钙。

请回答:
(1)支管a的作用为
(2)步骤1中将三颈烧瓶置于冷水浴中(反应为放热反应),其主要目的为
(3)三颈烧瓶中发生反应的化学方程式为
您最近一年使用:0次
名校
解题方法
8 . 2022年1月10日上午10时15分,一辆装载76桶、共计22吨硫酰氯(SO2Cl2)的箱式危化品车在杭金衢高速衢向K328处发生事故,导致4桶破损,部分硫酰氯流出,与潮湿空气接触后,现场散发出刺鼻性的烟雾,情况十分危急。硫酰氯是一种重要的化工试剂,常温下为无色液体,熔点为-54.1℃,沸点为69.1℃。如今,氯化法是合成硫酰氯的常用方法。实验室合成硫酰氯的实验装置如图所示(部分夹持装置未画出]:

已知:①

②100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。回答下列问题:
(1)硫酰氯(SO2Cl2)中S的化合价为_______ 。
(2)实验室常用高锰酸钾和浓盐酸来制备氯气,请写出装置A中制氯气的离子方程式_______ 。
(3)装置B盛装的试剂为_______ ;装置F的作用为_______ 。
(4)二氧化硫是合成硫酰氯的关键试剂之一,下列有关 的描述正确的是_______。
的描述正确的是_______。
(5)合成的硫酰氯在空气中不稳定,能与空气中的水蒸气生成两种常见的强酸,并产生白雾。请写出相应的化学方程式_______ 。
(6)若装置A中排出氯气4.48L(已折算成标准状况),用仪器检测到装置D中放出12kJ的热量,则氯气的转化率为_______ 。

已知:①


②100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气。回答下列问题:
(1)硫酰氯(SO2Cl2)中S的化合价为
(2)实验室常用高锰酸钾和浓盐酸来制备氯气,请写出装置A中制氯气的离子方程式
(3)装置B盛装的试剂为
(4)二氧化硫是合成硫酰氯的关键试剂之一,下列有关
 的描述正确的是_______。
的描述正确的是_______。A.实验室常用稀硫酸和亚硫酸钠溶液反应来制备 |
| B.二氧化硫是一种酸性氧化物,与水反应生成硫酸,是造成酸雨的主要原因 |
| C.二氧化硫能够抑制细菌和真菌的滋生,因此,某些食品也可以用二氧化硫来防腐 |
| D.二氧化硫具有漂白性,能使湿润的蓝色石蕊试纸先变红后褪色 |
(6)若装置A中排出氯气4.48L(已折算成标准状况),用仪器检测到装置D中放出12kJ的热量,则氯气的转化率为
您最近一年使用:0次
2022-11-05更新
|
155次组卷
|
3卷引用:湘湖教育三新探索协作体2022-2023学年高二上学期11月期中联考化学试题
解题方法
9 .  是中学常用的氧化剂。实验室制备
是中学常用的氧化剂。实验室制备 并探究其性质:
并探究其性质:
实验一:制备 。①高温下,在熔融KOH中用
。①高温下,在熔融KOH中用 氧化
氧化 制备
制备 ;②水浸后冷却,调整溶液pH至弱碱性,
;②水浸后冷却,调整溶液pH至弱碱性, 歧化生成
歧化生成 和
和 ;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得
;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得 。
。
(1)步骤①选择_______(填字母)。
(2)步骤②中发生反应的离子方程式为_______ 。
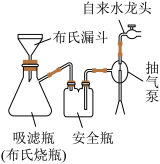
(3)利用如图所示装置过滤。减压过滤的优点是_______ (答一条即可)。用饱和高锰酸钾溶液洗涤 晶体的操作是
晶体的操作是_______ 。
实验二:探究 性质。在5.0mL 0.1
性质。在5.0mL 0.1
 溶液(含稀硫酸)中加入10.0mL 0.5
溶液(含稀硫酸)中加入10.0mL 0.5
 溶液,测得
溶液,测得 体积(V)与时间(t)关系如图所示。
体积(V)与时间(t)关系如图所示。
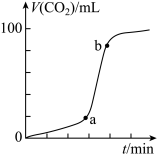
(4)关于ab段速率“突增”的原因(不考虑热效应),有同学猜想:可能是 对反应起催化作用。为了证实其猜想,请完成下列实验方案。
对反应起催化作用。为了证实其猜想,请完成下列实验方案。
实验结果, ,上述猜想正确。①
,上述猜想正确。①_______ ;②_______ 。
实验三:测定 样品纯度(杂质不参与反应)。准确称量m g高锰酸钾样品溶于水,加入稀硫酸酸化,加入
样品纯度(杂质不参与反应)。准确称量m g高锰酸钾样品溶于水,加入稀硫酸酸化,加入 mL
mL

 溶液(过量),充分反应后,用
溶液(过量),充分反应后,用
 标准
标准 溶液滴定至终点,消耗滴定液
溶液滴定至终点,消耗滴定液 mL。
mL。
(5)滴定终点现象是_______ 。
(6)该样品纯度为_______ (用含m、 、
、 、
、 、
、 的式子表示)。若滴定
的式子表示)。若滴定 溶液前俯视读数,滴定后仰视读数,则测得结果
溶液前俯视读数,滴定后仰视读数,则测得结果_______ (填“偏高”“偏低”或“无影响”)。
 是中学常用的氧化剂。实验室制备
是中学常用的氧化剂。实验室制备 并探究其性质:
并探究其性质:实验一:制备
 。①高温下,在熔融KOH中用
。①高温下,在熔融KOH中用 氧化
氧化 制备
制备 ;②水浸后冷却,调整溶液pH至弱碱性,
;②水浸后冷却,调整溶液pH至弱碱性, 歧化生成
歧化生成 和
和 ;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得
;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得 。
。(1)步骤①选择_______(填字母)。
| A.瓷坩埚 | B.铝坩埚 | C.铁坩埚 | D.石英坩埚 |
(3)利用如图所示装置过滤。减压过滤的优点是
 晶体的操作是
晶体的操作是
实验二:探究
 性质。在5.0mL 0.1
性质。在5.0mL 0.1
 溶液(含稀硫酸)中加入10.0mL 0.5
溶液(含稀硫酸)中加入10.0mL 0.5
 溶液,测得
溶液,测得 体积(V)与时间(t)关系如图所示。
体积(V)与时间(t)关系如图所示。
(4)关于ab段速率“突增”的原因(不考虑热效应),有同学猜想:可能是
 对反应起催化作用。为了证实其猜想,请完成下列实验方案。
对反应起催化作用。为了证实其猜想,请完成下列实验方案。| 实验 | 0.1  (aq)(含稀硫酸) (aq)(含稀硫酸) | 0.5  (aq) (aq) | 添加物质 | 记录溶液褪色时间/s |
| Ⅰ | 2.0mL | 2.0mL | 无 |  |
| Ⅱ | ①_______。 | 2.0mL | ②_______。 |  |
 ,上述猜想正确。①
,上述猜想正确。①实验三:测定
 样品纯度(杂质不参与反应)。准确称量m g高锰酸钾样品溶于水,加入稀硫酸酸化,加入
样品纯度(杂质不参与反应)。准确称量m g高锰酸钾样品溶于水,加入稀硫酸酸化,加入 mL
mL

 溶液(过量),充分反应后,用
溶液(过量),充分反应后,用
 标准
标准 溶液滴定至终点,消耗滴定液
溶液滴定至终点,消耗滴定液 mL。
mL。(5)滴定终点现象是
(6)该样品纯度为
 、
、 、
、 、
、 的式子表示)。若滴定
的式子表示)。若滴定 溶液前俯视读数,滴定后仰视读数,则测得结果
溶液前俯视读数,滴定后仰视读数,则测得结果
您最近一年使用:0次
2022-11-05更新
|
98次组卷
|
2卷引用:湖南省河南省湘豫名校联考2022- 2023学年高二上学期阶段考试(一)化学试题
10 . 甲醛与新制氢氧化铜反应的产物随反应条件改变而有所不同。实验室对该反应在一定条件下所得产物成分进行探究,具体过程如下。取一定量的 溶液、
溶液、 溶液和甲醛于锥形瓶中,控制温度
溶液和甲醛于锥形瓶中,控制温度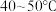 回流
回流 ,收集到大量气体X,并有砖红色沉淀生成。
,收集到大量气体X,并有砖红色沉淀生成。
(1)①“控制温度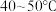 ”的常用加热方法是
”的常用加热方法是___________ 。
②气体X能燃烧且完全燃烧产物不会使澄清石灰水变浑浊,说明该气体是___________ 。
(2)在探究甲醛的氧化产物时,发现未生成 。为了进一步确定甲醛是否被氧化为
。为了进一步确定甲醛是否被氧化为 ,进行如图实验(省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
,进行如图实验(省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
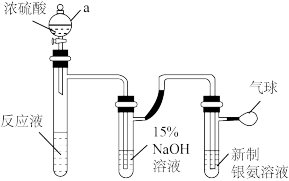
①仪器a的名称是___________ 。
②b中, 溶液的作用是
溶液的作用是___________ 。
③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为___________ 。
 溶液、
溶液、 溶液和甲醛于锥形瓶中,控制温度
溶液和甲醛于锥形瓶中,控制温度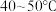 回流
回流 ,收集到大量气体X,并有砖红色沉淀生成。
,收集到大量气体X,并有砖红色沉淀生成。(1)①“控制温度
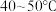 ”的常用加热方法是
”的常用加热方法是②气体X能燃烧且完全燃烧产物不会使澄清石灰水变浑浊,说明该气体是
(2)在探究甲醛的氧化产物时,发现未生成
 。为了进一步确定甲醛是否被氧化为
。为了进一步确定甲醛是否被氧化为 ,进行如图实验(省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
,进行如图实验(省略夹持和加热装置,甲酸与浓硫酸反应能生成CO,而CO可将银氨溶液还原成银单质)。
①仪器a的名称是
②b中,
 溶液的作用是
溶液的作用是③c中,银氨溶液中出现黑色沉淀,则氧化剂与还原剂的物质的量之比为
您最近一年使用:0次



