1 . 磷酸亚铁锂(LiFePO4)是生产锂电池的重要材料。实验室中用如图装置制备LiFePO4:在仪器A中加入40mL蒸馏水、少量抗坏血酸,再加入0.01molH3PO4和0.01molFeSO4•7H2O,用搅拌器搅拌溶解后,缓慢加入0.03molLiOH•H2O,继续搅拌5min。快速将反应液装入反应釜中,保持170℃恒温5h。
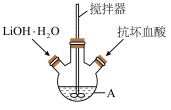
(1)仪器A的名称是___________ ;实验所用蒸馏水若未经煮沸直接使用,则可能发生反应的离子方程式为 ___________ 。
(2)实验中可用Na2SO3代替抗坏血酸,其原理是___________ (用离子方程式表示);不能用铁粉代替抗坏血酸的原因是 ___________ 。
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是___________ 、 ___________ 、过滤、洗涤、干燥。
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是___________ 。
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率约为 ___________。

(1)仪器A的名称是
(2)实验中可用Na2SO3代替抗坏血酸,其原理是
(3)反应釜中反应充分后,要得到LiFePO4固体产品的实验操作是
(4)检验产品中是否混有Fe(OH)3或FePO4杂质的方法是
(5)若实验得到无杂质产品1.28g,则LiFePO4的产率约为 ___________。
| A.85% | B.80% | C.75% | D.70% |
您最近一年使用:0次
2 . 硼镁泥是可贵的镁资源。硼镁泥的主要成分为 、
、 ,还含少量的
,还含少量的 、
、 、
、 、CaO、MnO,利用硼镁泥制备
、CaO、MnO,利用硼镁泥制备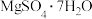 的工艺流程如图所示。
的工艺流程如图所示。

已知:①抽滤可以达到加速过滤的目的。
②常温下,部分金属阳离子以氢氧化物形式沉淀时溶液的pH范围如下表:
③两种盐的溶解度曲线如图:

请回答下列问题:
(1)“酸浸”时,加入的酸为_______ (填名称),“酸浸”时,一般煮沸10min,这样做的目的是_______ 。
(2)“滤渣1”的主要成分为_______ (写化学式)。
(3)“滤渣2”中含有 、
、 、
、 ,为了调节pH至6,物质Y可选用
,为了调节pH至6,物质Y可选用_______ ,检验铁离子是否完全沉淀的操作为_______ 。
(4)pH=6时,加入NaClO固体后,写出NaClO涉及反应的离子方程式:_______ 、_______ 。
(5)“操作Z”是为了除去硫酸钙,依据溶解度曲线,“操作Z”为蒸发浓缩、_______ ;“一系列操作”为_______ 、洗涤、干燥。
 、
、 ,还含少量的
,还含少量的 、
、 、
、 、CaO、MnO,利用硼镁泥制备
、CaO、MnO,利用硼镁泥制备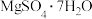 的工艺流程如图所示。
的工艺流程如图所示。
已知:①抽滤可以达到加速过滤的目的。
②常温下,部分金属阳离子以氢氧化物形式沉淀时溶液的pH范围如下表:
| 金属阳离子 | Fe3+ | Al3+ | Mn2+ | Fe2+ | Mg2+ |
| pH范围 | 1.5~2.8 | 3.4~4.7 | 8.1~10.1 | 6.3~8.3 | 9.9~11.9 |

请回答下列问题:
(1)“酸浸”时,加入的酸为
(2)“滤渣1”的主要成分为
(3)“滤渣2”中含有
 、
、 、
、 ,为了调节pH至6,物质Y可选用
,为了调节pH至6,物质Y可选用(4)pH=6时,加入NaClO固体后,写出NaClO涉及反应的离子方程式:
(5)“操作Z”是为了除去硫酸钙,依据溶解度曲线,“操作Z”为蒸发浓缩、
您最近一年使用:0次
2023-04-21更新
|
126次组卷
|
2卷引用:贵州省遵义市部分高中2022-2023学年高二下学期期中联考化学试题
名校
解题方法
3 . 已知X元素原子的L层比Y元素原子的L层少3个电子,Y元素原子核外电子数比X元素原子核外电子数多5,请回答下列问题:
(1)X、Y可形成_______ (填标号)。
A.离子化合物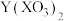 B.离子化合物
B.离子化合物 C.共价化合物
C.共价化合物 D.共价化合物
D.共价化合物
(2)已知Y元素的单质能在空气中燃烧,写出其中属于置换反应的化学方程式_______ ,分析所得化合物中所含化学键的类型:_______ 。
(3)X元素的氢化物能与它的最高价氧化物对应水化物反应,其产物属于_______ (填“离子”或“共价”)化合物。
(1)X、Y可形成
A.离子化合物
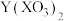 B.离子化合物
B.离子化合物 C.共价化合物
C.共价化合物 D.共价化合物
D.共价化合物
(2)已知Y元素的单质能在空气中燃烧,写出其中属于置换反应的化学方程式
(3)X元素的氢化物能与它的最高价氧化物对应水化物反应,其产物属于
您最近一年使用:0次
名校
解题方法
4 . 某实验小组用 溶液和
溶液和 硫酸溶液进行中和热的测定。
硫酸溶液进行中和热的测定。
Ⅰ.配制 溶液
溶液
(1)若实验中需要配制 溶液,则需要称量NaOH固体
溶液,则需要称量NaOH固体_______ g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):_______ 。
Ⅱ.中和热的测定:
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。_______ ,实验中还需要用到量取溶液体积的玻璃仪器是_______ 。
(4)取 溶液和30mL硫酸溶液进行实验,实验数据如表。
溶液和30mL硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
②近似认为 溶液和
溶液和 硫酸溶液的密度都是
硫酸溶液的密度都是 ,中和后生成溶液的比热容
,中和后生成溶液的比热容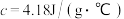 。则中和热
。则中和热
_______  (保留一位小数)。
(保留一位小数)。
③上述实验数值结果与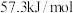 有偏差,产生偏差的原因可能是
有偏差,产生偏差的原因可能是_______ (填字母)。
a.实验装置保温、隔热效果差
b.配制 溶液时俯视刻度线读数
溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用量筒量取NaOH溶液的体积时仰视读数
 溶液和
溶液和 硫酸溶液进行中和热的测定。
硫酸溶液进行中和热的测定。Ⅰ.配制
 溶液
溶液(1)若实验中需要配制
 溶液,则需要称量NaOH固体
溶液,则需要称量NaOH固体(2)从图中选择称量NaOH固体所需要的仪器是(填字母):
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |
|
|
|
|
|
|
| 序号 | a | b | c | d | e | f |
Ⅱ.中和热的测定:
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(4)取
 溶液和30mL硫酸溶液进行实验,实验数据如表。
溶液和30mL硫酸溶液进行实验,实验数据如表。①请填写表中的空白:
温度 实验次数 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | 温度差平均值( )/℃ )/℃ | ||
 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
 溶液和
溶液和 硫酸溶液的密度都是
硫酸溶液的密度都是 ,中和后生成溶液的比热容
,中和后生成溶液的比热容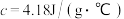 。则中和热
。则中和热
 (保留一位小数)。
(保留一位小数)。③上述实验数值结果与
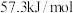 有偏差,产生偏差的原因可能是
有偏差,产生偏差的原因可能是a.实验装置保温、隔热效果差
b.配制
 溶液时俯视刻度线读数
溶液时俯视刻度线读数c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用量筒量取NaOH溶液的体积时仰视读数
您最近一年使用:0次
2023-02-01更新
|
239次组卷
|
2卷引用:贵州省凯里市第一中学2022-2023学年高二上学期期末考试化学试题
5 . 已知:钴金属元素常见化合价为+2和+3,CoCl2易溶于水。回答下列问题:
(1)甲同学用 与盐酸反应制备
与盐酸反应制备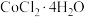 ,其实验装置如下:
,其实验装置如下:
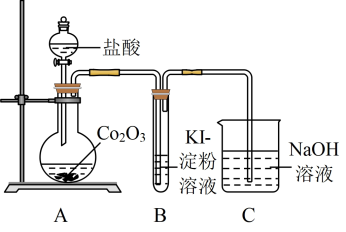
①A中发生反应的离子方程式为_______ 。盐酸体现出的性质有_______ 。
②C中氢氧化钠溶液的作用是_______ 。
(2)乙同学利用如图装置检验乙酸钴结晶水合物在氮气气氛中的分解产物,其中E、F、G中的试剂均足量。已知PdCl2溶液能被CO还原为Pd。
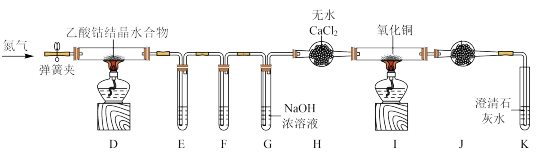
①装置E中试剂的作用是_______ 。
②经分析知分解产物还有C2H6,已知C2H6在较高温度下具有还原性,则上述实验中可确定有C2H6生成的现象是_______ 。
③反应完后持续通N2的作用是_______ 。
(1)甲同学用
 与盐酸反应制备
与盐酸反应制备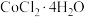 ,其实验装置如下:
,其实验装置如下:
①A中发生反应的离子方程式为
②C中氢氧化钠溶液的作用是
(2)乙同学利用如图装置检验乙酸钴结晶水合物在氮气气氛中的分解产物,其中E、F、G中的试剂均足量。已知PdCl2溶液能被CO还原为Pd。

①装置E中试剂的作用是
②经分析知分解产物还有C2H6,已知C2H6在较高温度下具有还原性,则上述实验中可确定有C2H6生成的现象是
③反应完后持续通N2的作用是
您最近一年使用:0次
6 . 某化学小组为测定某化学品[通式为aAl(OH)3·bMgCO3 cH2O,a、b、c均为正整数]的组成及镁元素的质量分数,设计以下两种实验方案,填写下列空白:
I.甲同学设计如下方案:
①称取一定质量的样品和足量的稀硫酸按如图所示装量置实验,测定CO2的体积(忽略水蒸气体积 );

②对步骤①所得装置I中混合物进行过滤;在滤液中加入过量氨水,过滤;
③灼烧步骤②所得滤渣,直至残留固体恒重。
(1)利用如图装置测定二氧化碳体积(装置II中盛装饱和碳酸氢钠溶液),“安全漏斗”的“安全”含义是_______ 。实验完毕后,装置I内残留有CO2 ,对测定结果是否有影响? 答:_____ (填“有”或“无”)。
(2)下列有关Al(OH)3的说法正确的是_______ (填字母)。
a. Al(OH)3既能与所有酸反应,又能与所有碱反应
b.氢氧化铝的酸性比H2CO3弱
c.Al(OH)3不稳定性,受热分解生成Al2O3和H2O
d.氢氧化铝胶体粒子可聚沉水中杂质
(3)灼烧滤渣除需要酒精灯、三脚架、泥三角、玻璃棒、坩埚钳外,还缺少的仪器是_______ (填名称)。
II.乙同学利用如图装置测定:

(4)A的作用是_________ ;C中试剂是______ (填名称)。
(5)若样品质量为29.4 g,装置C、D分别净增10.8g、4.4 g,则样品的主要成分化学式为_______ ;样品中镁元素的质量分数为_______ (保留小数点后1位小数)。
I.甲同学设计如下方案:
①称取一定质量的样品和足量的稀硫酸按如图所示装量置实验,测定CO2的体积(忽略水蒸气体积 );

②对步骤①所得装置I中混合物进行过滤;在滤液中加入过量氨水,过滤;
③灼烧步骤②所得滤渣,直至残留固体恒重。
(1)利用如图装置测定二氧化碳体积(装置II中盛装饱和碳酸氢钠溶液),“安全漏斗”的“安全”含义是
(2)下列有关Al(OH)3的说法正确的是
a. Al(OH)3既能与所有酸反应,又能与所有碱反应
b.氢氧化铝的酸性比H2CO3弱
c.Al(OH)3不稳定性,受热分解生成Al2O3和H2O
d.氢氧化铝胶体粒子可聚沉水中杂质
(3)灼烧滤渣除需要酒精灯、三脚架、泥三角、玻璃棒、坩埚钳外,还缺少的仪器是
II.乙同学利用如图装置测定:

(4)A的作用是
(5)若样品质量为29.4 g,装置C、D分别净增10.8g、4.4 g,则样品的主要成分化学式为
您最近一年使用:0次
7 . 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如图:
,实验流程如图:

回答下列问题:
(1)从海水中提取NaCl固体时,为先后除去 、
、 、
、 ,除杂试剂应依次加入
,除杂试剂应依次加入 、
、_______ 、_______ (填化学式);
(2)生成 的总反应的化学方程式为
的总反应的化学方程式为_______ 。
(3)向母液中加入NaCl粉末,存在 过程。为使
过程。为使 沉淀充分析出并分离,根据NaCl和
沉淀充分析出并分离,根据NaCl和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为_______ 、过滤、洗涤、干燥。

(4)对固体 充分加热,产生的气体先通过足量浓硫酸,再通过足量
充分加热,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重0.28g,则固体
增重0.28g,则固体 的质量为
的质量为_______ g。
 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如图:
,实验流程如图:
回答下列问题:
(1)从海水中提取NaCl固体时,为先后除去
 、
、 、
、 ,除杂试剂应依次加入
,除杂试剂应依次加入 、
、(2)生成
 的总反应的化学方程式为
的总反应的化学方程式为(3)向母液中加入NaCl粉末,存在
 过程。为使
过程。为使 沉淀充分析出并分离,根据NaCl和
沉淀充分析出并分离,根据NaCl和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为
(4)对固体
 充分加热,产生的气体先通过足量浓硫酸,再通过足量
充分加热,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重0.28g,则固体
增重0.28g,则固体 的质量为
的质量为
您最近一年使用:0次
解题方法
8 . 下图为短周期元素的部分信息(图象中数值代表最高正化合价或最低负化合价),其中e的原子半径是短周期元素中最大的,y元素所构成的化合物已超过1亿种。

回答问题:
(1)z元素在周期表中的位置是第二周期、第_______ 族。
(2)画出e元素原子结构示意图_______ 。
(3)g元素的最高正价为_______ 。
(4)d、e元素能形成淡黄色的固体,该固体与水反应的化学方程式为_______ 。
(5)某探究小组探究镁与铝金属性强弱的关系,进行如下实验设计:
[实验操作]分别向装有少量 溶液、
溶液、 溶液的试管中逐滴滴加
溶液的试管中逐滴滴加 NaOH溶液直至过量,如下图:
NaOH溶液直至过量,如下图:

[实验现象]①中产生白色沉淀且不溶解;②中先产生白色沉淀后沉淀溶解。
[实验结论] 不溶于NaOH溶液;
不溶于NaOH溶液; 溶于NaOH溶液,显示两性,故碱性:
溶于NaOH溶液,显示两性,故碱性: 大于
大于 。证明金属性:
。证明金属性:_______ 。

回答问题:
(1)z元素在周期表中的位置是第二周期、第
(2)画出e元素原子结构示意图
(3)g元素的最高正价为
(4)d、e元素能形成淡黄色的固体,该固体与水反应的化学方程式为
(5)某探究小组探究镁与铝金属性强弱的关系,进行如下实验设计:
[实验操作]分别向装有少量
 溶液、
溶液、 溶液的试管中逐滴滴加
溶液的试管中逐滴滴加 NaOH溶液直至过量,如下图:
NaOH溶液直至过量,如下图:
[实验现象]①中产生白色沉淀且不溶解;②中先产生白色沉淀后沉淀溶解。
[实验结论]
 不溶于NaOH溶液;
不溶于NaOH溶液; 溶于NaOH溶液,显示两性,故碱性:
溶于NaOH溶液,显示两性,故碱性: 大于
大于 。证明金属性:
。证明金属性:
您最近一年使用:0次
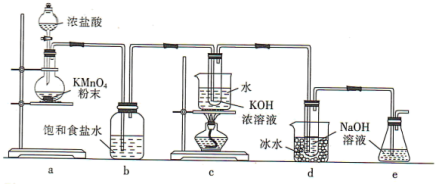
9 .  与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以
与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以 分别与KOH溶液和NaOH溶液反应为原理,制备
分别与KOH溶液和NaOH溶液反应为原理,制备 和NaClO,并探究
和NaClO,并探究 和NaClO的部分性质。
和NaClO的部分性质。
回答下列问题:
(1)a装置所用玻璃仪器的名称为______ (任意写一种);发生反应的离子方程式为____________ 。
(2)b装置的作用是____________ ;e装置的作用是____________ 。
(3)已知:c装置中得到的是 ,d装置中得到的是NaClO。
,d装置中得到的是NaClO。
①由此判断氯气与碱反应时,影响产物的因素有____________ 。
②NaClO溶液常温时稳定,受热时会生成两种盐,NaBrO溶液在0℃时稳定,常温时会生成两种盐,则常温时, 与KOH溶液反应的离子方程式为
与KOH溶液反应的离子方程式为____________ 。
(4)取少量c、d装置中生成的 和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入
和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入 ,振荡、静置后
,振荡、静置后 层显
层显_______ 色。由此可推知,在碱性条件下, 的氧化能力
的氧化能力______ (填“>”或“<”)NaClO的氧化能力。
(5)该兴趣小组在40℃条件下,将一定量的 通入600 mL
通入600 mL  NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和
NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和 ,则参加反应的
,则参加反应的 的物质的量为
的物质的量为______ mol。
 与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以
与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以 分别与KOH溶液和NaOH溶液反应为原理,制备
分别与KOH溶液和NaOH溶液反应为原理,制备 和NaClO,并探究
和NaClO,并探究 和NaClO的部分性质。
和NaClO的部分性质。
回答下列问题:
(1)a装置所用玻璃仪器的名称为
(2)b装置的作用是
(3)已知:c装置中得到的是
 ,d装置中得到的是NaClO。
,d装置中得到的是NaClO。①由此判断氯气与碱反应时,影响产物的因素有
②NaClO溶液常温时稳定,受热时会生成两种盐,NaBrO溶液在0℃时稳定,常温时会生成两种盐,则常温时,
 与KOH溶液反应的离子方程式为
与KOH溶液反应的离子方程式为(4)取少量c、d装置中生成的
 和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入
和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入 ,振荡、静置后
,振荡、静置后 层显
层显 的氧化能力
的氧化能力(5)该兴趣小组在40℃条件下,将一定量的
 通入600 mL
通入600 mL  NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和
NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和 ,则参加反应的
,则参加反应的 的物质的量为
的物质的量为
您最近一年使用:0次
2022-07-12更新
|
112次组卷
|
2卷引用:贵州省黔西南布依族苗族自治州2021-2022学年高二下学期期末质量检测化学试题
名校
解题方法
10 . 铁红( )常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为
)常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为 、
、 ,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:
,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:

回答下列问题:
(1)工业常将硫铁矿烧渣经过粉碎后再进行“酸浸”,其目的是_______ 。
(2)“酸浸”时加入的硫酸不宜过量太多的原因是_______ 。“酸浸”过程中主要反应的离子方程式为_______ 。
(3)“过滤1”所得滤液中含有的阳离子有_______ 。
(4)“过滤2”所得滤渣的主要成分为 和
和 ,所得滤液中的主要溶质是
,所得滤液中的主要溶质是_______ (填化学式)。
(5)写出 在空气中焙烧生成铁红的化学方程式:
在空气中焙烧生成铁红的化学方程式:_______ 。
(6)焙烧后的产物铁红中含有 ,欲验证其中存在
,欲验证其中存在 ,应选用的试剂是
,应选用的试剂是_______ 。
 )常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为
)常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为 、
、 ,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:
,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:
回答下列问题:
(1)工业常将硫铁矿烧渣经过粉碎后再进行“酸浸”,其目的是
(2)“酸浸”时加入的硫酸不宜过量太多的原因是
(3)“过滤1”所得滤液中含有的阳离子有
(4)“过滤2”所得滤渣的主要成分为
 和
和 ,所得滤液中的主要溶质是
,所得滤液中的主要溶质是(5)写出
 在空气中焙烧生成铁红的化学方程式:
在空气中焙烧生成铁红的化学方程式:(6)焙烧后的产物铁红中含有
 ,欲验证其中存在
,欲验证其中存在 ,应选用的试剂是
,应选用的试剂是
您最近一年使用:0次









