名校
解题方法
1 . 某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是________________ 。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是___________ ,有关的离子方程式为______________________ 。
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明液中肯定有_____________ , 有关的离子方程式为____________________ 。
(4)原溶液可能大量存在的阴离子是下列的____________ 。
A.C1- B.NO C.CO
C.CO D.OH-
D.OH-
(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明液中肯定有
(4)原溶液可能大量存在的阴离子是下列的
A.C1- B.NO
 C.CO
C.CO D.OH-
D.OH-
您最近一年使用:0次
2020-12-07更新
|
1382次组卷
|
28卷引用:河北省承德市第二中学2016-2017学年高二下学期第一次月考化学试题
河北省承德市第二中学2016-2017学年高二下学期第一次月考化学试题黑龙江省双鸭山市第一中学2016-2017学年高二下学期期末考试化学试题黑龙江省双鸭山市2016-2017学年高二化学下学期期末考试试题贵州省贵阳清镇北大培文学校2022-2023学年高二下学期3月月考(4班)化学试题2015-2016学年四川阆中中学校高一上第二次段考化学试卷安徽省六安市第一中学2017-2018学年高一上学期第二次阶段性考试化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【押题专练】(已下线)2018年9月29日《每日一题》人教必修1周末培优(已下线)2019年9月28日 《每日一题》必修1—— 周末培优黑龙江省大庆市东风中学2019-2020学年高一上学期期中考试化学试题内蒙古自治区呼和浩特市回民区2019-2020学年高一上学期期中考试化学试题河北省邢台市第七中学2018-2019学年高一下学期期中考试化学试题甘肃省庄浪县第一中学2020-2021学年高一上学期第一学段考试化学试题新疆生产建设兵团第十师北屯高级中学2020-2021学年高一上学期阶段性检测化学试题(已下线)【南昌新东方】14. 2020 高一上 进贤二中 期中 陈明模广西大学附属中学2020-2021学年度高一上学期期中段考化学试题(已下线)第14单元 物质的分离、提纯与检验(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷广东省揭阳市揭西县河婆中学2020-2021学年高一上学期第一次月考化学试题第2课时 离子反应的应用专题3 第二单元 第3课时 离子反应-高中化学苏教2019版必修第一册云南省玉溪第一中学2021-2022学年高一上学期第一次月考化学试题(已下线)易错专题06 离子共存判断-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)(已下线)1.2.3 离子方程式正误判断与离子共存-2022-2023学年高一化学上学期课后培优分级练 (人教版2019必修第一册)(已下线)2.2.4 离子反应-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)(已下线)【知识图鉴】单元讲练测必修第一册第一单元03巩固练(已下线)专题02 离子反应【考点清单】(讲+练)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)辽宁省沈阳市第十五中学2023-2024学年高一上学期10月月考化学试题安徽省合肥市第三中学2023-2024学年高一上学期10月份学情调研化学试题
解题方法
2 . 已知铝土矿的主要成分是A12O3,含有杂质SiO2(不溶于盐酸和水)、Fe2O3、MgO。工业上从铝土矿中提取铝可采用如下工艺流程:

请回答下列问题:
(1)溶液A转化为溶液D发生的离子方程式为___________ ;
(2)加热沉淀F分解出物质M的化学方程式为___________ ;
(3)由物质M制取铝的化学方程式__________ ;
(4)沉淀B的成分是_________ ,沉淀C的颜色为____________ 。

请回答下列问题:
(1)溶液A转化为溶液D发生的离子方程式为
(2)加热沉淀F分解出物质M的化学方程式为
(3)由物质M制取铝的化学方程式
(4)沉淀B的成分是
您最近一年使用:0次
3 . 某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O)晶体,设计了如图流程:

(1)溶解烧渣选用足量硫酸,写出Fe2O3与硫酸反应的离子方程式_______ ;检验溶液1中含有Fe3+的方法是_________ ;
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式________ ;
(3)试剂X是________ ;固体2是________ ;

(1)溶解烧渣选用足量硫酸,写出Fe2O3与硫酸反应的离子方程式
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式
(3)试剂X是
您最近一年使用:0次
解题方法
4 . 硼位于IIIA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
查阅资料:①BCl3的沸点为12.5℃,熔点为-107.3℃;②2B+6HCl 2BCl3↑+3H2↑。
2BCl3↑+3H2↑。
设计实验:某同学设计如图所示装置利用氯气和单质硼反应制备三氯化硼:

请回答下列问题:
(1)装置A盛装浓盐酸的仪器名称为_______ 。
(2)A中主要反应的化学方程式为:______ 。
(3)E装置的作用_____ ,装置F的作用是______ 、______ 。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:_____ 。
(5)装置B中若采用玻璃管,则制得的BCl3中常含有SiCl4(SiCl4)的熔点为-70℃,沸点为57.6℃)等杂质,可采用____ 的方法提纯BCl3。
查阅资料:①BCl3的沸点为12.5℃,熔点为-107.3℃;②2B+6HCl
 2BCl3↑+3H2↑。
2BCl3↑+3H2↑。设计实验:某同学设计如图所示装置利用氯气和单质硼反应制备三氯化硼:

请回答下列问题:
(1)装置A盛装浓盐酸的仪器名称为
(2)A中主要反应的化学方程式为:
(3)E装置的作用
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:
(5)装置B中若采用玻璃管,则制得的BCl3中常含有SiCl4(SiCl4)的熔点为-70℃,沸点为57.6℃)等杂质,可采用
您最近一年使用:0次
名校
解题方法
5 . 工业上用铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)提取氧化铝做冶炼铝的原料,其工艺流程如图所示:
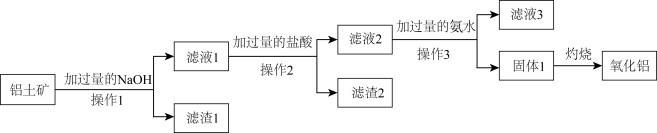
请回答下列问题。
(1)操作1、2、3的名称均为________ 。
(2)滤液1中所含的阴离子除OH-外,还有______ 、____ (填离子符号),滤渣2 的成分为_______ (填化学式)。
(3)滤液2中加入过量氨水生成固体1的离子反应方程式为_________ 。
(4)滤液3中溶质的主要成分属于盐类的物质是_______ 、________ (填化学式)。

请回答下列问题。
(1)操作1、2、3的名称均为
(2)滤液1中所含的阴离子除OH-外,还有
(3)滤液2中加入过量氨水生成固体1的离子反应方程式为
(4)滤液3中溶质的主要成分属于盐类的物质是
您最近一年使用:0次
6 . 草酸亚铁晶体( FeC2O4·2H2O)是一种淡黄色粉末,可用作照相显影剂。某课外小组利用如下实验装置对草酸亚铁晶体分解产物进行探究,并设计实验测定草酸亚铁晶体样品纯度。
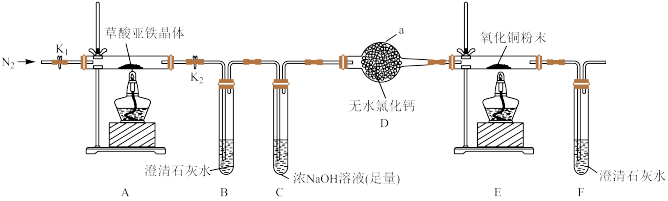
回答下列问题:
(1)仪器a的名称为_____ ;装置B中澄清石灰水变浑浊,说明气体分解产物中含有_____ ;
(2)实验前先通一段时间N2目的是________ ;装置C中浓NaOH溶液的作用是______ ;
(3)证明草酸亚铁晶体分解产物中含有CO的实验现象是______ ;
(4)充分反应后,将装置A硬质玻璃管中的残留固体溶于足量的稀硫酸中,无气泡产生,滴加几滴KSCN溶液,溶液不变红,说明固体分解产物是______ (填化学式);根据上述实验现象写出草酸亚铁晶体分解的化学方程式_______ ;
(5)所给实验装置存在明显的设计缺陷,该缺陷是______ ;
(6)草酸亚铁晶体样品纯度的测定:准确称取12. 000 g某草酸亚铁晶体样品,在一定条件下溶于稍过量的硫酸中,配成250 mL溶液。取25.00 mL上述溶液,用0.100 mol/L KMnO4标准溶液滴定,达到滴定终点时, 消耗35.00 mL KMnO4标准溶液,滴定反应为:FeC2O4·2H2O + KMnO4+ H2SO4→Fe2(SO4)3+CO2↑+ MnSO4 + K2SO4 + H2O(未配平)。则该草酸亚铁晶体样品的纯度为________ (已知该草酸亚铁晶体样品中不含其他与高锰酸钾反应的还原性杂质)。

回答下列问题:
(1)仪器a的名称为
(2)实验前先通一段时间N2目的是
(3)证明草酸亚铁晶体分解产物中含有CO的实验现象是
(4)充分反应后,将装置A硬质玻璃管中的残留固体溶于足量的稀硫酸中,无气泡产生,滴加几滴KSCN溶液,溶液不变红,说明固体分解产物是
(5)所给实验装置存在明显的设计缺陷,该缺陷是
(6)草酸亚铁晶体样品纯度的测定:准确称取12. 000 g某草酸亚铁晶体样品,在一定条件下溶于稍过量的硫酸中,配成250 mL溶液。取25.00 mL上述溶液,用0.100 mol/L KMnO4标准溶液滴定,达到滴定终点时, 消耗35.00 mL KMnO4标准溶液,滴定反应为:FeC2O4·2H2O + KMnO4+ H2SO4→Fe2(SO4)3+CO2↑+ MnSO4 + K2SO4 + H2O(未配平)。则该草酸亚铁晶体样品的纯度为
您最近一年使用:0次
解题方法
7 . 磷酸二氢钾(KH2PO4)是一种重要的化工产品,工业上常用作缓冲剂和培养剂;农业上常用作复合肥料。以氟磷灰石[主要成分为Ca5F(PO4)3还含有少量的Fe2O3、Al2O3等杂质]为原料制备KH2PO4晶体的一种流程如下:

回答下列问题:
(1)已知“酸浸”时的一个反应为Ca5F(PO4)3+ 5H2SO4(浓)= 5CaSO4+3H3PO4 + HF↑,该反应利用浓硫酸的_______ (填“氧化性”“还原性”“强酸性”或“难挥发性" );“酸浸"过程所用的仪器不能采用二氧化硅陶瓷材料,其主要原因是(用化学方程式表示)__ ;
(2)已知物质A为CaCO3,则“废渣I”的主要成分为______ ;
(3)“反应II”的化学方程式为_____ ;
(4)将经过一系列除杂后得到的KH2PO4滤液加热浓缩,边加热边搅拌,待____ 时停止加热,冷却结晶,____ 、洗涤、干燥 ,得到KH2PO4晶体。
(5)常温下,H3PO4的电离平衡常数:Ka1=7.1 x10-3,Ka2 =6.3 x10-8 , Ka3=4.5x10-13。常温下,KH2PO4水溶液显酸性,请通过计算说明其原因_______ ;
(6)用电解法制取KH2PO4的装置如图所示。该电解装置中,a区属于___ (填“阳极"或“阴极")区,阳极区的电极反应式为__ 。


回答下列问题:
(1)已知“酸浸”时的一个反应为Ca5F(PO4)3+ 5H2SO4(浓)= 5CaSO4+3H3PO4 + HF↑,该反应利用浓硫酸的
(2)已知物质A为CaCO3,则“废渣I”的主要成分为
(3)“反应II”的化学方程式为
(4)将经过一系列除杂后得到的KH2PO4滤液加热浓缩,边加热边搅拌,待
(5)常温下,H3PO4的电离平衡常数:Ka1=7.1 x10-3,Ka2 =6.3 x10-8 , Ka3=4.5x10-13。常温下,KH2PO4水溶液显酸性,请通过计算说明其原因
(6)用电解法制取KH2PO4的装置如图所示。该电解装置中,a区属于

您最近一年使用:0次
8 . Q、X、Y、Z、W五种元素的原子序数依次递增,W为第四周期元素,其余均为短周期主族元素。已知:
①Q原子的最外层电子数是次外层电子数的2倍;
②Y、Z同主族,Y原子价电子排布图为 ;
;
③W元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答下列问题:
(1)W的元素名称为________ ,其基态原子的电子排布式为_________ 。
(2)具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子原理”,五种元素中电负性最强的非金属元素形成的一种单质A与Y、Z形成的化合物B是等电子体物质,A、B分子式分别为____________ 、____________ 。
(3)Q、X、Y三种元素的第一电离能最大的是_______ (填元素符号)。
①Q原子的最外层电子数是次外层电子数的2倍;
②Y、Z同主族,Y原子价电子排布图为
 ;
;③W元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答下列问题:
(1)W的元素名称为
(2)具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子原理”,五种元素中电负性最强的非金属元素形成的一种单质A与Y、Z形成的化合物B是等电子体物质,A、B分子式分别为
(3)Q、X、Y三种元素的第一电离能最大的是
您最近一年使用:0次
名校
9 . 某研究性学习小组对某废旧合金(含有Cu、Fe、Si 三种成分)进行分离、回收。其工业流程如图:

已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是________
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是________ ,溶液a中发生的反应的离子方程式为________ ;
(3)将溶液c调节pH至2.9~3.2的目的是________ ;
(4)常温下,取2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至________ ;
(5)工业上由红棕色固体C制取相应单质常用的方法是________ 。
A.电解法 B.热还原法 C.热分解法
(6)用惰性电极电解溶液e制取固体B,阳极主要发生的电极反应为______________ 。

已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是
A.过滤 B.洗涤 C.干燥 D.蒸馏
(2)过量的还原剂应是
(3)将溶液c调节pH至2.9~3.2的目的是
(4)常温下,取2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至
(5)工业上由红棕色固体C制取相应单质常用的方法是
A.电解法 B.热还原法 C.热分解法
(6)用惰性电极电解溶液e制取固体B,阳极主要发生的电极反应为
您最近一年使用:0次
名校
解题方法
10 . 实验室中有一未知浓度的稀盐酸,某同学为测定该盐酸的浓度,在实验室中进行了如下实验。
(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→冷却→转移→洗涤(并将洗涤液移入容量瓶)→振荡→_________ →__________ →装瓶→贴标签。
②称量________ g氢氧化钠固体粉末,所需仪器有:托盘天平(带砝码和镊子)、___________ 、小烧瓶。
(2)取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
①滴定达到终点的标志是___________________________ 。
②根据上述数据,可计算出该盐酸的浓度约为_______ (保留两位有效数字)。
③排去碱式滴定管中气泡的方法应采用如图所示操作中的____________ (选择甲、乙、丙填空),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______ 。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.滴定过程中,有少量标准液溅出锥形瓶外
E.碱式滴定管尖嘴部分有气泡,滴定后消失
(1)配制100 mL 0.10 mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→冷却→转移→洗涤(并将洗涤液移入容量瓶)→振荡→
②称量
(2)取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准液NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
| 实验 编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) | |
| 1 | 0.10 | 29.80 | 20.00 | |
| 2 | 0.10 | 30.00 | 20.00 | |
| 3 | 0.10 | 30.20 | 20.00 |
②根据上述数据,可计算出该盐酸的浓度约为
③排去碱式滴定管中气泡的方法应采用如图所示操作中的

④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.滴定过程中,有少量标准液溅出锥形瓶外
E.碱式滴定管尖嘴部分有气泡,滴定后消失
您最近一年使用:0次



