名校
解题方法
1 . 某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是________________ 。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是___________ ,有关的离子方程式为______________________ 。
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明液中肯定有_____________ , 有关的离子方程式为____________________ 。
(4)原溶液可能大量存在的阴离子是下列的____________ 。
A.C1- B.NO C.CO
C.CO D.OH-
D.OH-
(1)不做任何实验就可以肯定原溶液中不存在的离子是
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明液中肯定有
(4)原溶液可能大量存在的阴离子是下列的
A.C1- B.NO
 C.CO
C.CO D.OH-
D.OH-
您最近一年使用:0次
2020-12-07更新
|
1382次组卷
|
28卷引用:贵州省贵阳清镇北大培文学校2022-2023学年高二下学期3月月考(4班)化学试题
贵州省贵阳清镇北大培文学校2022-2023学年高二下学期3月月考(4班)化学试题河北省承德市第二中学2016-2017学年高二下学期第一次月考化学试题黑龙江省双鸭山市第一中学2016-2017学年高二下学期期末考试化学试题黑龙江省双鸭山市2016-2017学年高二化学下学期期末考试试题第2课时 离子反应的应用2015-2016学年四川阆中中学校高一上第二次段考化学试卷安徽省六安市第一中学2017-2018学年高一上学期第二次阶段性考试化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化 第2讲 离子反应和离子方程式【押题专练】(已下线)2018年9月29日《每日一题》人教必修1周末培优(已下线)2019年9月28日 《每日一题》必修1—— 周末培优黑龙江省大庆市东风中学2019-2020学年高一上学期期中考试化学试题内蒙古自治区呼和浩特市回民区2019-2020学年高一上学期期中考试化学试题河北省邢台市第七中学2018-2019学年高一下学期期中考试化学试题甘肃省庄浪县第一中学2020-2021学年高一上学期第一学段考试化学试题新疆生产建设兵团第十师北屯高级中学2020-2021学年高一上学期阶段性检测化学试题(已下线)【南昌新东方】14. 2020 高一上 进贤二中 期中 陈明模广西大学附属中学2020-2021学年度高一上学期期中段考化学试题(已下线)第14单元 物质的分离、提纯与检验(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷专题3 第二单元 第3课时 离子反应-高中化学苏教2019版必修第一册云南省玉溪第一中学2021-2022学年高一上学期第一次月考化学试题(已下线)易错专题06 离子共存判断-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)(已下线)1.2.3 离子方程式正误判断与离子共存-2022-2023学年高一化学上学期课后培优分级练 (人教版2019必修第一册)(已下线)2.2.4 离子反应-【帮课堂】2022-2023学年高一化学同步精品讲义(沪科版2020必修第一册)(已下线)【知识图鉴】单元讲练测必修第一册第一单元03巩固练广东省揭阳市揭西县河婆中学2020-2021学年高一上学期第一次月考化学试题(已下线)专题02 离子反应【考点清单】(讲+练)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)辽宁省沈阳市第十五中学2023-2024学年高一上学期10月月考化学试题安徽省合肥市第三中学2023-2024学年高一上学期10月份学情调研化学试题
名校
解题方法
2 . 某实验小组用 溶液和
溶液和 硫酸溶液进行中和热的测定。
硫酸溶液进行中和热的测定。
Ⅰ.配制 溶液
溶液
(1)若实验中需要配制 溶液,则需要称量NaOH固体
溶液,则需要称量NaOH固体_______ g。
(2)从图中选择称量NaOH固体所需要的仪器是(填字母):_______ 。
Ⅱ.中和热的测定:
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。_______ ,实验中还需要用到量取溶液体积的玻璃仪器是_______ 。
(4)取 溶液和30mL硫酸溶液进行实验,实验数据如表。
溶液和30mL硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
②近似认为 溶液和
溶液和 硫酸溶液的密度都是
硫酸溶液的密度都是 ,中和后生成溶液的比热容
,中和后生成溶液的比热容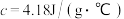 。则中和热
。则中和热
_______  (保留一位小数)。
(保留一位小数)。
③上述实验数值结果与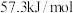 有偏差,产生偏差的原因可能是
有偏差,产生偏差的原因可能是_______ (填字母)。
a.实验装置保温、隔热效果差
b.配制 溶液时俯视刻度线读数
溶液时俯视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用量筒量取NaOH溶液的体积时仰视读数
 溶液和
溶液和 硫酸溶液进行中和热的测定。
硫酸溶液进行中和热的测定。Ⅰ.配制
 溶液
溶液(1)若实验中需要配制
 溶液,则需要称量NaOH固体
溶液,则需要称量NaOH固体(2)从图中选择称量NaOH固体所需要的仪器是(填字母):
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |
|
|
|
|
|
|
| 序号 | a | b | c | d | e | f |
Ⅱ.中和热的测定:
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(4)取
 溶液和30mL硫酸溶液进行实验,实验数据如表。
溶液和30mL硫酸溶液进行实验,实验数据如表。①请填写表中的空白:
温度 实验次数 | 起始温度 /℃ /℃ | 终止温度 /℃ /℃ | 温度差平均值( )/℃ )/℃ | ||
 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
 溶液和
溶液和 硫酸溶液的密度都是
硫酸溶液的密度都是 ,中和后生成溶液的比热容
,中和后生成溶液的比热容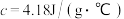 。则中和热
。则中和热
 (保留一位小数)。
(保留一位小数)。③上述实验数值结果与
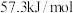 有偏差,产生偏差的原因可能是
有偏差,产生偏差的原因可能是a.实验装置保温、隔热效果差
b.配制
 溶液时俯视刻度线读数
溶液时俯视刻度线读数c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用量筒量取NaOH溶液的体积时仰视读数
您最近一年使用:0次
2023-02-01更新
|
240次组卷
|
2卷引用:贵州省凯里市第一中学2022-2023学年高二上学期期末考试化学试题
解题方法
3 . 锆产品的主要原料是锆英砂,全球90%的氧氯化锆(ZrOCl2)来源于中国。氧氯化锆可溶于水,微溶于盐酸,工业上以锆英砂(含91.5%ZrSiO4,杂质不与NaOH溶液反应)为原料生产ZrOCl2的一种工艺流程如图所示。
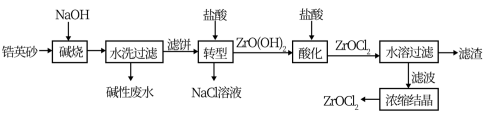
已知:碱金属的锆酸盐在水中溶解度很小,可在酸性条件下水解。
请回答下列问题:
(1)锆英砂在“碱烧”前粉碎的目的是____ ,“碱烧”时ZrSiO4生成了Na2ZrO3和另一种钠盐X,X的化学式为___ ,X的用途是___ (写一种)。
(2)“转型”时发生反应的化学方程式为___ 。
(3)“酸化”过程需加入过量盐酸,该操作中发生反应的化学方程式是___ 。
(4)“水溶过滤”操作后要对滤渣进行洗涤,洗涤液与滤液合并浓缩结晶,检查滤渣已经洗涤干净的实验是___ 。
(5)将锆英砂和焦炭混合,再与Cl2反应生成ZrCl4、SiCl4和一种可燃性气体,ZrCl4水解也可得到ZrOCl2。生成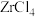 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为___ 。
(6)某工厂用2t锆英砂来制备ZrOCl2,若这个过程中Zr的损耗率为15%,则最终制得ZrOCl2的质量为___ t。

已知:碱金属的锆酸盐在水中溶解度很小,可在酸性条件下水解。
请回答下列问题:
(1)锆英砂在“碱烧”前粉碎的目的是
(2)“转型”时发生反应的化学方程式为
(3)“酸化”过程需加入过量盐酸,该操作中发生反应的化学方程式是
(4)“水溶过滤”操作后要对滤渣进行洗涤,洗涤液与滤液合并浓缩结晶,检查滤渣已经洗涤干净的实验是
(5)将锆英砂和焦炭混合,再与Cl2反应生成ZrCl4、SiCl4和一种可燃性气体,ZrCl4水解也可得到ZrOCl2。生成
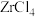 的反应中,氧化剂与还原剂的物质的量之比为
的反应中,氧化剂与还原剂的物质的量之比为(6)某工厂用2t锆英砂来制备ZrOCl2,若这个过程中Zr的损耗率为15%,则最终制得ZrOCl2的质量为
您最近一年使用:0次
2021-10-01更新
|
516次组卷
|
5卷引用:贵州省黔西南州2021~2022学年高二上学期期中考试化学试题
贵州省黔西南州2021~2022学年高二上学期期中考试化学试题重庆市2021-2022学年高二上学期期中考试化学试题河南省偃师市第一高级中学2022届高三阶段性测试化学试题福建省南平市2022届高三10月联考化学试卷(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-测试
4 . 化工专家侯德榜发明的侯氏制碱法为我国纯碱工业和国民经济发展做出了重要贡献,某化学兴趣小组在实验室中模拟并改进侯氏制碱法制备 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如图:
,实验流程如图:

回答下列问题:
(1)从海水中提取NaCl固体时,为先后除去 、
、 、
、 ,除杂试剂应依次加入
,除杂试剂应依次加入 、
、_______ 、_______ (填化学式);
(2)生成 的总反应的化学方程式为
的总反应的化学方程式为_______ 。
(3)向母液中加入NaCl粉末,存在 过程。为使
过程。为使 沉淀充分析出并分离,根据NaCl和
沉淀充分析出并分离,根据NaCl和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为_______ 、过滤、洗涤、干燥。

(4)对固体 充分加热,产生的气体先通过足量浓硫酸,再通过足量
充分加热,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重0.28g,则固体
增重0.28g,则固体 的质量为
的质量为_______ g。
 ,进一步处理得到产品
,进一步处理得到产品 和
和 ,实验流程如图:
,实验流程如图:
回答下列问题:
(1)从海水中提取NaCl固体时,为先后除去
 、
、 、
、 ,除杂试剂应依次加入
,除杂试剂应依次加入 、
、(2)生成
 的总反应的化学方程式为
的总反应的化学方程式为(3)向母液中加入NaCl粉末,存在
 过程。为使
过程。为使 沉淀充分析出并分离,根据NaCl和
沉淀充分析出并分离,根据NaCl和 溶解度曲线,需采用的操作为
溶解度曲线,需采用的操作为
(4)对固体
 充分加热,产生的气体先通过足量浓硫酸,再通过足量
充分加热,产生的气体先通过足量浓硫酸,再通过足量 ,
, 增重0.28g,则固体
增重0.28g,则固体 的质量为
的质量为
您最近一年使用:0次
名校
解题方法
5 . 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
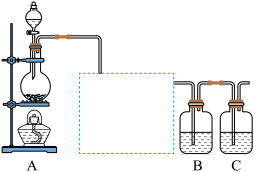
(1)装置A的分液漏斗中盛装的试剂是______ ,烧瓶中发生的反应的化学方程式是________ 。
(2)画出虚线框内的实验装置图,所加试剂为____________ ,该装置的作用是_______ 。
(3)装置B中盛放的试剂是____________ (填序号),实验现象为____________ ,该反应的离子方程式是_____________ ,该反应属于四种基本反应类型中的__________ 反应。
A Na2S溶液 B Na2SO3溶液 C Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸的酸性比硫酸强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气在加热条件下反应生成三氯化铁,铁与硫在加热条件下反应生成硫化亚铁;⑦硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子。能说明氯的非金属性比硫强的是________ (填序号)。
A 全部 B ②③④⑥⑦ C ①②④⑤⑥ D ②③④⑤⑥⑦
(5)装置C中盛放烧碱溶液,目地是吸收反应后剩余的气体,防止污染空气,写出该装置中所发生反应的离子方程式:_____________ 。

(1)装置A的分液漏斗中盛装的试剂是
(2)画出虚线框内的实验装置图,所加试剂为
(3)装置B中盛放的试剂是
A Na2S溶液 B Na2SO3溶液 C Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸的酸性比硫酸强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气在加热条件下反应生成三氯化铁,铁与硫在加热条件下反应生成硫化亚铁;⑦硫原子与氯原子的电子层数相同,氯的原子半径小于硫原子。能说明氯的非金属性比硫强的是
A 全部 B ②③④⑥⑦ C ①②④⑤⑥ D ②③④⑤⑥⑦
(5)装置C中盛放烧碱溶液,目地是吸收反应后剩余的气体,防止污染空气,写出该装置中所发生反应的离子方程式:
您最近一年使用:0次
2019-07-03更新
|
822次组卷
|
8卷引用:贵州省从江县第一民族中学2018-2019学年高二上学期期末考试化学试题
6 . 无水四氯化锡用途很广。某化学兴趣小组利用锡渣废料(主要成分为Sn和SnO)制备 。熔融的Sn与
。熔融的Sn与 反应生成
反应生成 ,同时会有少量
,同时会有少量 生成,部分反应装置如图所示。
生成,部分反应装置如图所示。
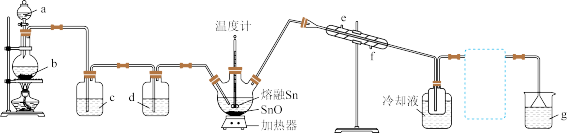
已知:
①Sn、SnO、 、
、 有关物理性质如下表所示。
有关物理性质如下表所示。
② 极易水解生成
极易水解生成 。
。
③当 时,Sn存在形式为
时,Sn存在形式为 沉淀;当
沉淀;当 时,Sn存在形式为
时,Sn存在形式为 。回答下列问题:
。回答下列问题:
(1)盛放试剂b的仪器名称是_____ ,该装置中发生反应的离子方程式为___________ 。
(2)制备 的相关试剂和操作正确的是
的相关试剂和操作正确的是_________ (填字母)。
A.试剂a为稀盐酸 B.试剂b为 固体
固体
C.试剂c为浓硫酸 D.试剂d为饱和食盐水
E.f口为出水口 F.试剂g可选用NaOH溶液
(3)温度计控制温度t的范围为__________________ 。
(4)根据实验要求,若要完成该实验,需在上图虚线框中画出装置所缺少的仪器和所需试剂(即冷却装置与尾气处理装置之间的仪器);若没有该装置,可能会发生的副反应的化学方程式为_______________________ 。
(5)因氯化亚锡( )用途广泛,在无机工业中用作还原剂(
)用途广泛,在无机工业中用作还原剂( 易被氧化为
易被氧化为 )。该兴趣小组又用三颈烧瓶内的剩余物质制备
)。该兴趣小组又用三颈烧瓶内的剩余物质制备 ,向三颈烧瓶中加入适量的浓盐酸并充分搅拌,加热到一定温度,一段时间后,冷却至室温,过滤,向滤液中加入少许单质锡,调节
,向三颈烧瓶中加入适量的浓盐酸并充分搅拌,加热到一定温度,一段时间后,冷却至室温,过滤,向滤液中加入少许单质锡,调节 ,在
,在 气流下进行蒸发浓缩,冷却结晶得氯化亚锡晶体。
气流下进行蒸发浓缩,冷却结晶得氯化亚锡晶体。
①在制备 时,向三颈烧瓶中通入
时,向三颈烧瓶中通入 的目的是
的目的是___________________ 。
②调节 的原因是
的原因是____________________________________ 。
 。熔融的Sn与
。熔融的Sn与 反应生成
反应生成 ,同时会有少量
,同时会有少量 生成,部分反应装置如图所示。
生成,部分反应装置如图所示。
已知:
①Sn、SnO、
 、
、 有关物理性质如下表所示。
有关物理性质如下表所示。物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
Sn | 银白色固体 | 232 | 2260 |
SnO | 蓝黑色粉末 | 1080分解 | 1080分解 |
| 无色晶体 | 246 | 652 |
| 无色液体 | -33 | 114 |
 极易水解生成
极易水解生成 。
。③当
 时,Sn存在形式为
时,Sn存在形式为 沉淀;当
沉淀;当 时,Sn存在形式为
时,Sn存在形式为 。回答下列问题:
。回答下列问题:(1)盛放试剂b的仪器名称是
(2)制备
 的相关试剂和操作正确的是
的相关试剂和操作正确的是A.试剂a为稀盐酸 B.试剂b为
 固体
固体C.试剂c为浓硫酸 D.试剂d为饱和食盐水
E.f口为出水口 F.试剂g可选用NaOH溶液
(3)温度计控制温度t的范围为
(4)根据实验要求,若要完成该实验,需在上图虚线框中画出装置所缺少的仪器和所需试剂(即冷却装置与尾气处理装置之间的仪器);若没有该装置,可能会发生的副反应的化学方程式为
(5)因氯化亚锡(
 )用途广泛,在无机工业中用作还原剂(
)用途广泛,在无机工业中用作还原剂( 易被氧化为
易被氧化为 )。该兴趣小组又用三颈烧瓶内的剩余物质制备
)。该兴趣小组又用三颈烧瓶内的剩余物质制备 ,向三颈烧瓶中加入适量的浓盐酸并充分搅拌,加热到一定温度,一段时间后,冷却至室温,过滤,向滤液中加入少许单质锡,调节
,向三颈烧瓶中加入适量的浓盐酸并充分搅拌,加热到一定温度,一段时间后,冷却至室温,过滤,向滤液中加入少许单质锡,调节 ,在
,在 气流下进行蒸发浓缩,冷却结晶得氯化亚锡晶体。
气流下进行蒸发浓缩,冷却结晶得氯化亚锡晶体。①在制备
 时,向三颈烧瓶中通入
时,向三颈烧瓶中通入 的目的是
的目的是②调节
 的原因是
的原因是
您最近一年使用:0次
2022-05-29更新
|
151次组卷
|
2卷引用:贵州省黔东南苗族侗族自治州)2021-2022学年高二下学期期末联考化学试题
名校
解题方法
7 . 铁红( )常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为
)常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为 、
、 ,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:
,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:

回答下列问题:
(1)工业常将硫铁矿烧渣经过粉碎后再进行“酸浸”,其目的是_______ 。
(2)“酸浸”时加入的硫酸不宜过量太多的原因是_______ 。“酸浸”过程中主要反应的离子方程式为_______ 。
(3)“过滤1”所得滤液中含有的阳离子有_______ 。
(4)“过滤2”所得滤渣的主要成分为 和
和 ,所得滤液中的主要溶质是
,所得滤液中的主要溶质是_______ (填化学式)。
(5)写出 在空气中焙烧生成铁红的化学方程式:
在空气中焙烧生成铁红的化学方程式:_______ 。
(6)焙烧后的产物铁红中含有 ,欲验证其中存在
,欲验证其中存在 ,应选用的试剂是
,应选用的试剂是_______ 。
 )常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为
)常用于油漆、油墨及橡胶工业。工业上以一定质量的硫铁矿烧渣(主要成分为 、
、 ,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:
,另含少量难溶杂质)为主要原料制备铁红的一种工艺流程如下:
回答下列问题:
(1)工业常将硫铁矿烧渣经过粉碎后再进行“酸浸”,其目的是
(2)“酸浸”时加入的硫酸不宜过量太多的原因是
(3)“过滤1”所得滤液中含有的阳离子有
(4)“过滤2”所得滤渣的主要成分为
 和
和 ,所得滤液中的主要溶质是
,所得滤液中的主要溶质是(5)写出
 在空气中焙烧生成铁红的化学方程式:
在空气中焙烧生成铁红的化学方程式:(6)焙烧后的产物铁红中含有
 ,欲验证其中存在
,欲验证其中存在 ,应选用的试剂是
,应选用的试剂是
您最近一年使用:0次
8 .  与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以
与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以 分别与KOH溶液和NaOH溶液反应为原理,制备
分别与KOH溶液和NaOH溶液反应为原理,制备 和NaClO,并探究
和NaClO,并探究 和NaClO的部分性质。
和NaClO的部分性质。
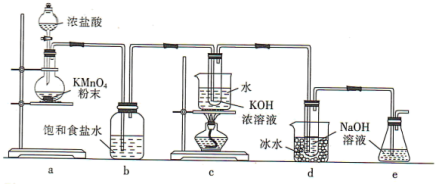
回答下列问题:
(1)a装置所用玻璃仪器的名称为______ (任意写一种);发生反应的离子方程式为____________ 。
(2)b装置的作用是____________ ;e装置的作用是____________ 。
(3)已知:c装置中得到的是 ,d装置中得到的是NaClO。
,d装置中得到的是NaClO。
①由此判断氯气与碱反应时,影响产物的因素有____________ 。
②NaClO溶液常温时稳定,受热时会生成两种盐,NaBrO溶液在0℃时稳定,常温时会生成两种盐,则常温时, 与KOH溶液反应的离子方程式为
与KOH溶液反应的离子方程式为____________ 。
(4)取少量c、d装置中生成的 和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入
和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入 ,振荡、静置后
,振荡、静置后 层显
层显_______ 色。由此可推知,在碱性条件下, 的氧化能力
的氧化能力______ (填“>”或“<”)NaClO的氧化能力。
(5)该兴趣小组在40℃条件下,将一定量的 通入600 mL
通入600 mL  NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和
NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和 ,则参加反应的
,则参加反应的 的物质的量为
的物质的量为______ mol。
 与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以
与碱的溶液反应生成的含氯的产物除氯化物外,还可能含有次氯酸盐或氯酸盐。某兴趣小组利用如图装置以 分别与KOH溶液和NaOH溶液反应为原理,制备
分别与KOH溶液和NaOH溶液反应为原理,制备 和NaClO,并探究
和NaClO,并探究 和NaClO的部分性质。
和NaClO的部分性质。
回答下列问题:
(1)a装置所用玻璃仪器的名称为
(2)b装置的作用是
(3)已知:c装置中得到的是
 ,d装置中得到的是NaClO。
,d装置中得到的是NaClO。①由此判断氯气与碱反应时,影响产物的因素有
②NaClO溶液常温时稳定,受热时会生成两种盐,NaBrO溶液在0℃时稳定,常温时会生成两种盐,则常温时,
 与KOH溶液反应的离子方程式为
与KOH溶液反应的离子方程式为(4)取少量c、d装置中生成的
 和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入
和NaClO溶液(两溶液均调至碱性),分别置于1号和2号试管中,向两试管中分别滴加等量且适量的KI溶液。1号试管溶液颜色不变;2号试管溶液颜色变为棕色,加入 ,振荡、静置后
,振荡、静置后 层显
层显 的氧化能力
的氧化能力(5)该兴趣小组在40℃条件下,将一定量的
 通入600 mL
通入600 mL  NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和
NaOH溶液中,NaOH恰好反应完全,得到的产物中含有NaCl、NaClO和 ,则参加反应的
,则参加反应的 的物质的量为
的物质的量为
您最近一年使用:0次
2022-07-12更新
|
113次组卷
|
2卷引用:贵州省黔西南布依族苗族自治州2021-2022学年高二下学期期末质量检测化学试题
名校
9 . 下表是元素周期表的一部分,回答下列问题:
(1)元素①~⑩中,金属性最强的元素的原子结构示意图为___________ 。
(2)写出元素②常见的一种同素异形体的名称:___________ 。
(3)元素⑦的单质与元素⑩氢化物的水溶液反应的离子方程式为___________ 。
(4)常温下,元素⑧的单质与元素⑥的最高价氧化物对应的水化物反应的离子方程式为___________ 。
(5)元素①的单质在高温下可与其同主族元素的单质发生化合反应,形成的化合物是工业上常用的还原剂,写出由元素①、⑨形成的化合物的电子式:___________ 。
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||
| ⑥ | ⑦ | ⑧ | |||||||||||||||
| ⑨ | ⑩ |
(2)写出元素②常见的一种同素异形体的名称:
(3)元素⑦的单质与元素⑩氢化物的水溶液反应的离子方程式为
(4)常温下,元素⑧的单质与元素⑥的最高价氧化物对应的水化物反应的离子方程式为
(5)元素①的单质在高温下可与其同主族元素的单质发生化合反应,形成的化合物是工业上常用的还原剂,写出由元素①、⑨形成的化合物的电子式:
您最近一年使用:0次
2022-03-01更新
|
125次组卷
|
3卷引用:贵州省毕节市赫章县2021-2022学年高二上学期期末考试化学试题
13-14高三·全国·课时练习
10 . 在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______________________________ :
(2)过程I加入铁屑的主要作用是___________ ,分离得到固体的主要成分是______ ,从固体中分离出铜需采用的方法是___________________ ;
(3)过程II中发生反应的化学方程式为_________________________ ;
(4)过程II中调节溶液的pH为5,金属离子浓度为__________________ 。(列式计算)
I:向废液中投入过量铁屑,充分反应后分离出固体和滤液;
II:向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]= 4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为
(2)过程I加入铁屑的主要作用是
(3)过程II中发生反应的化学方程式为
(4)过程II中调节溶液的pH为5,金属离子浓度为
您最近一年使用:0次
2016-12-08更新
|
1809次组卷
|
3卷引用:贵州省黔东南苗族侗族自治州天柱县第二中学2019-2020学年高二上学期期末考试化学试题
贵州省黔东南苗族侗族自治州天柱县第二中学2019-2020学年高二上学期期末考试化学试题(已下线)2014年高考化学苏教版总复习 3-2 铁、铜的获取和应用练习卷2012年普通高等学校招生全国统一考试化学(海南卷)









