名校
解题方法
1 . 下表中数据是第三周期的三种金属元素X、Y、Z逐渐失去电子的电离能。
试回答下列问题
(1)根据数据分析,X、Y、Z的最外层电子数,简述理由___________ 。
(2)X元素的原子核外最外层电子排布式为___________ 。
(3)X、Y、Z三种元素的原子半径由大到小顺序为___________ ;X、Y、Z三种元素的离子半径由大到小顺序为___________ 。
(4)第三周期中能与Y元素形成YD型化合物的元素D位于___________ 族,用电子式表示化合物YD的形成过程___________ 。
(5)写出金属Y与石墨电极、稀硫酸构成的原电池的电极反应式:负极:___________ ;正极:___________ 。
| 电离能/kJ•mol-1 | |||||||
| X | 578 | 1817 | 2745 | 11575 | 14830 | 18376 | 23293 |
| Y | 738 | 1451 | 7733 | 10540 | 13630 | 17995 | 21703 |
| Z | 496 | 4562 | 6912 | 9943 | 13353 | 16610 | 20114 |
(1)根据数据分析,X、Y、Z的最外层电子数,简述理由
(2)X元素的原子核外最外层电子排布式为
(3)X、Y、Z三种元素的原子半径由大到小顺序为
(4)第三周期中能与Y元素形成YD型化合物的元素D位于
(5)写出金属Y与石墨电极、稀硫酸构成的原电池的电极反应式:负极:
您最近一年使用:0次
名校
2 . 已知A、B、C、D、E分别为原子序数依次增大的五种元素短周期元素,A与D同主族,A原子与B原子的最外层电子数之和等于C原子的最外层电子数,E原子的质子数是B原子质子数的2倍,A与B可形成BA3型化合物,该化合物与C的单质在一定条件下反应,能生成化合物BC,请按要求填写下列空白:
(1)E元素的名称______ ,C元素在元素周期表中的位置 _______ 。
(2)写出BA3的电子式_______ ,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式______ 。
(3)写出D的最高价氧化物的水化物与E的最高价氧化物反应的离子方程式_________ 。
(4)写出实验室中制取B的氢化物的化学方程式_________ ,B的氢化物与B的最高价氧化物的水化物反应的离子方程式________ 。
(1)E元素的名称
(2)写出BA3的电子式
(3)写出D的最高价氧化物的水化物与E的最高价氧化物反应的离子方程式
(4)写出实验室中制取B的氢化物的化学方程式
您最近一年使用:0次
名校
解题方法
3 . 某科研小组设计出利用工业废酸(主要成分为稀硫酸)浸取某废弃的氧化铜锌矿(主要含CuO、ZnO和 )的方案,实现废物综合利用,如图所示。
)的方案,实现废物综合利用,如图所示。
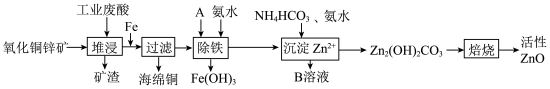
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
请回答下列问题:
(1)堆浸时,为了提高浸出效率可采取的措施有(任写1种):______ 。
(2)堆浸时产生的矿渣主要成分是______ 。
(3)物质A的作用是______ ,可使用下列物质中的______ 。
A. B.
B. C.
C. D.
D.
(4)除铁过程中加入氨水的目的是调节溶液的PH,PH应控制在______ 范围。
(5)物质B可直接用作氮肥,则B的化学式是______ 。
(6)除铁后得到的 可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂―
可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂― ,写出该反应的离子方程式
,写出该反应的离子方程式______ 。
 )的方案,实现废物综合利用,如图所示。
)的方案,实现废物综合利用,如图所示。
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 |
|
|
|
开始沉淀时的PH | 6.34 | 1.48 | 6.2 |
完全沉淀时的PH | 9.7 | 3.2 | 8.0 |
(1)堆浸时,为了提高浸出效率可采取的措施有(任写1种):
(2)堆浸时产生的矿渣主要成分是
(3)物质A的作用是
A.
 B.
B. C.
C. D.
D.
(4)除铁过程中加入氨水的目的是调节溶液的PH,PH应控制在
(5)物质B可直接用作氮肥,则B的化学式是
(6)除铁后得到的
 可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂―
可用KClO溶液在碱性环境下将其氧化得到一种高效的多功能水处理剂― ,写出该反应的离子方程式
,写出该反应的离子方程式
您最近一年使用:0次
名校
4 . 肼 是一种重要的工业产品,实验室用
是一种重要的工业产品,实验室用 与
与 合成肼
合成肼 并探究肼的性质。实验装置如图所示:
并探究肼的性质。实验装置如图所示:
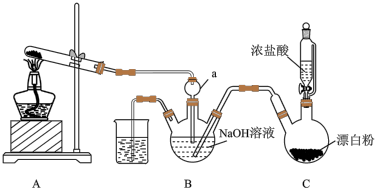
已知: 为无色液体,熔点1.4℃,沸点113℃,与水混溶、具有强还原性。
为无色液体,熔点1.4℃,沸点113℃,与水混溶、具有强还原性。
回答下列问题:
(1) 是
是___________ 分子(填“极性”或“非极性”),仪器a的作用是___________ 。
(2)装置B中制备肼的离子方程式为___________ ,该装置中通入 必须过量的原因是
必须过量的原因是___________ 。
(3)上述装置存在一处缺陷,会导致肼的产率降低,应在___________ (填“A与B”或“B与C”)之间,加入一个盛有___________ 的洗气瓶。
(4)测定肼的质量分数。取装置B中的溶液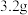 ,调节溶液pH为6.5左右,加水配成
,调节溶液pH为6.5左右,加水配成 溶液,移取
溶液,移取 置于锥形瓶中,并滴加2~3滴淀粉溶液,用
置于锥形瓶中,并滴加2~3滴淀粉溶液,用 的碘溶液滴定(杂质不参与反应),滴定过程中有无色、无味、无毒气体产生(
的碘溶液滴定(杂质不参与反应),滴定过程中有无色、无味、无毒气体产生( 未配平)。滴定终点平均消耗标准溶液
未配平)。滴定终点平均消耗标准溶液 ,产品中肼的质量分数为
,产品中肼的质量分数为___________ %。
 是一种重要的工业产品,实验室用
是一种重要的工业产品,实验室用 与
与 合成肼
合成肼 并探究肼的性质。实验装置如图所示:
并探究肼的性质。实验装置如图所示:
已知:
 为无色液体,熔点1.4℃,沸点113℃,与水混溶、具有强还原性。
为无色液体,熔点1.4℃,沸点113℃,与水混溶、具有强还原性。回答下列问题:
(1)
 是
是(2)装置B中制备肼的离子方程式为
 必须过量的原因是
必须过量的原因是(3)上述装置存在一处缺陷,会导致肼的产率降低,应在
(4)测定肼的质量分数。取装置B中的溶液
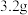 ,调节溶液pH为6.5左右,加水配成
,调节溶液pH为6.5左右,加水配成 溶液,移取
溶液,移取 置于锥形瓶中,并滴加2~3滴淀粉溶液,用
置于锥形瓶中,并滴加2~3滴淀粉溶液,用 的碘溶液滴定(杂质不参与反应),滴定过程中有无色、无味、无毒气体产生(
的碘溶液滴定(杂质不参与反应),滴定过程中有无色、无味、无毒气体产生( 未配平)。滴定终点平均消耗标准溶液
未配平)。滴定终点平均消耗标准溶液 ,产品中肼的质量分数为
,产品中肼的质量分数为
您最近一年使用:0次
解题方法
5 . “消洗灵”是具有消毒、杀菌、漂白和洗涤等综合功效的固体粉末,消毒原理与“84消毒液”相似,化学组成可以表示为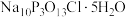 (磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
(磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
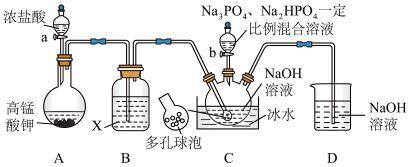
回答下列问题:
(1)①写出X试剂的名称______________ 。
②写出C中采用多孔球泡的目的______________ 。
③写出D装置的作用______________ 。
(2)打开仪器a的活塞及弹簧夹K,制备 碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
① “一系列操作”包括___________ 、___________ 、过滤、洗涤、低温干燥。
②若C中的 与
与 按物质的量之比
按物质的量之比 混合,写出C中制备“消洗灵”的总反应的化学方程式
混合,写出C中制备“消洗灵”的总反应的化学方程式______________ 。
③若生成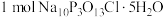 ,写出理论上至少消耗
,写出理论上至少消耗 的物质的量
的物质的量______________ 。
(3)“消洗灵”消毒时对金属腐蚀性小,原因是成分中的磷酸钠与空气共同作用,在金属表面形成不溶性磷酸盐膜,对金属具有良好的保护作用。写出用“消洗灵”对镁合金消毒,形成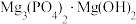 保护层的反应的化学方程式
保护层的反应的化学方程式______________ 。
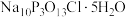 (磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
(磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
回答下列问题:
(1)①写出X试剂的名称
②写出C中采用多孔球泡的目的
③写出D装置的作用
(2)打开仪器a的活塞及弹簧夹K,制备
 碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。① “一系列操作”包括
②若C中的
 与
与 按物质的量之比
按物质的量之比 混合,写出C中制备“消洗灵”的总反应的化学方程式
混合,写出C中制备“消洗灵”的总反应的化学方程式③若生成
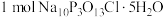 ,写出理论上至少消耗
,写出理论上至少消耗 的物质的量
的物质的量(3)“消洗灵”消毒时对金属腐蚀性小,原因是成分中的磷酸钠与空气共同作用,在金属表面形成不溶性磷酸盐膜,对金属具有良好的保护作用。写出用“消洗灵”对镁合金消毒,形成
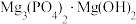 保护层的反应的化学方程式
保护层的反应的化学方程式
您最近一年使用:0次
名校
解题方法
6 . 碘及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)I2的一种制备方法如下图所示:
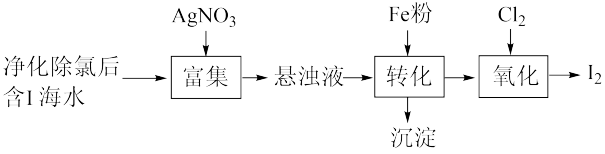
①加入Fe粉进行转化反应的离子方程式_______ 。
②过滤后收集沉淀。过滤所需的玻璃仪器有_______ 。生成的沉淀与硝酸反应,生成的_______ 可循环使用。
③通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为_______ ;若反应物用量比n(Cl2)/n(FeI2)>1.5,单质碘的收率会_______ (填“升高”“降低”或“不变”)。
(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总反应的离子方程式为_______ 。
(3)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1molI2,消耗的KI至少为_______ mol。I2在KI溶液中可发生反应I2+I-⇌ 。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是_______ 。
(1)I2的一种制备方法如下图所示:

①加入Fe粉进行转化反应的离子方程式
②过滤后收集沉淀。过滤所需的玻璃仪器有
③通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为
(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总反应的离子方程式为
(3)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1molI2,消耗的KI至少为
 。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
您最近一年使用:0次
名校
解题方法
7 . 氧钒(IV)碱式碳酸铵为紫色晶体,是制备热敏材料 的原料,其化学式为
的原料,其化学式为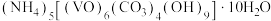 。实验室以
。实验室以 为原料制备氧钒(IV)碱式碳酸铵晶体,过程如下,并对所制备的晶体中钒元素的质量分数进行测定。
为原料制备氧钒(IV)碱式碳酸铵晶体,过程如下,并对所制备的晶体中钒元素的质量分数进行测定。

已知:① 具有还原性,易被
具有还原性,易被 氧化
氧化
② 与
与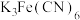 溶液产生蓝色沉淀
溶液产生蓝色沉淀
I、制备氧钒(IV)碱式碳酸铵晶体
(1)步骤1中生成 的同时生成一种无色无污染的气体,该反应的化学方程式为
的同时生成一种无色无污染的气体,该反应的化学方程式为___________ 。
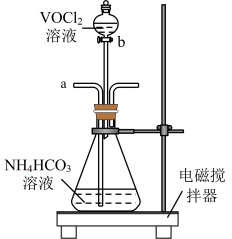
(2)步骤2可在下图装置中进行。滴加 溶液之前,需由a口向锥形瓶中通入一段时间
溶液之前,需由a口向锥形瓶中通入一段时间 ,作用是
,作用是___________ ,所得紫色晶体残留的杂质阴离子主要为___________ 。
II、欲测定上述流程中所得氧钒(IV)碱式碳酸铵晶体钒元素的质量分数,现进行如下操作:
①称量wg晶体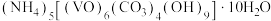 溶于水,配成500mL溶液;
溶于水,配成500mL溶液;
②取100mL上述溶液于锥形瓶中,滴加酸性溶液氧化,再除去多余的(方法略);
③用 标准溶液滴定至终点(滴定过程只发生反应
标准溶液滴定至终点(滴定过程只发生反应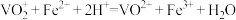 ),消耗标准溶液的体积为ymL。
),消耗标准溶液的体积为ymL。
(3)操作②时,酸性 溶液氧化
溶液氧化 的离子方程式为
的离子方程式为___________ 。
(4)操作③滴定时,选用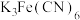 溶液作指示剂,滴定终点的现象为
溶液作指示剂,滴定终点的现象为___________ 。
(5)该晶体中钒元素的质量分数为___________ %(用含有w、x、y的式子表示)。
(6)若实验测得钒的质量分数偏大,则可能的原因是___________ 。
A. 标准溶液部分被氧化
标准溶液部分被氧化
B.滴定前平视读数,滴定终点时俯视读数
C.滴定管水洗后未用标准溶液润洗
 的原料,其化学式为
的原料,其化学式为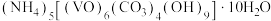 。实验室以
。实验室以 为原料制备氧钒(IV)碱式碳酸铵晶体,过程如下,并对所制备的晶体中钒元素的质量分数进行测定。
为原料制备氧钒(IV)碱式碳酸铵晶体,过程如下,并对所制备的晶体中钒元素的质量分数进行测定。
已知:①
 具有还原性,易被
具有还原性,易被 氧化
氧化②
 与
与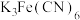 溶液产生蓝色沉淀
溶液产生蓝色沉淀I、制备氧钒(IV)碱式碳酸铵晶体
(1)步骤1中生成
 的同时生成一种无色无污染的气体,该反应的化学方程式为
的同时生成一种无色无污染的气体,该反应的化学方程式为(2)步骤2可在下图装置中进行。滴加
 溶液之前,需由a口向锥形瓶中通入一段时间
溶液之前,需由a口向锥形瓶中通入一段时间 ,作用是
,作用是
II、欲测定上述流程中所得氧钒(IV)碱式碳酸铵晶体钒元素的质量分数,现进行如下操作:
①称量wg晶体
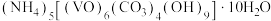 溶于水,配成500mL溶液;
溶于水,配成500mL溶液;②取100mL上述溶液于锥形瓶中,滴加酸性溶液氧化,再除去多余的(方法略);
③用
 标准溶液滴定至终点(滴定过程只发生反应
标准溶液滴定至终点(滴定过程只发生反应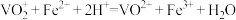 ),消耗标准溶液的体积为ymL。
),消耗标准溶液的体积为ymL。(3)操作②时,酸性
 溶液氧化
溶液氧化 的离子方程式为
的离子方程式为(4)操作③滴定时,选用
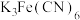 溶液作指示剂,滴定终点的现象为
溶液作指示剂,滴定终点的现象为(5)该晶体中钒元素的质量分数为
(6)若实验测得钒的质量分数偏大,则可能的原因是
A.
 标准溶液部分被氧化
标准溶液部分被氧化B.滴定前平视读数,滴定终点时俯视读数
C.滴定管水洗后未用标准溶液润洗
您最近一年使用:0次
2022-11-12更新
|
420次组卷
|
2卷引用:重庆第八中学2022-2023学年高二上学期期中考试化学试题
名校
8 . 有A、B、C、D四种盐,在水中电离时产生下列离子(每种物质只含一种阳离子且不重复)
已知:①A溶液呈酸性,且焰色试验时火焰呈黄色;②B溶液呈黄色:③C是草木灰的主要成分;④D溶液呈碱性。
(1)D是____ 。
(2)A溶液中离子浓度从大到小的顺序为____ 。
(3)实验室配制B溶液时需要加入_____ ,将B溶液蒸干并灼烧最终得到产物为____ 。
(4)B和C溶液混合时反应的离子方程式_____ 。
(5)若用等体积、等物质的量浓度的下列物质的溶液分别吸收SO2,则理论上吸收量最大的是____ (填字母)。
| 阳离子 | K+、Na+、NH 、Fe3+ 、Fe3+ |
| 阴离子 | CO 、HSO 、HSO 、Cl- 、Cl- |
(1)D是
(2)A溶液中离子浓度从大到小的顺序为
(3)实验室配制B溶液时需要加入
(4)B和C溶液混合时反应的离子方程式
(5)若用等体积、等物质的量浓度的下列物质的溶液分别吸收SO2,则理论上吸收量最大的是
| A.NH3•H2O | B.FeCl3 | C.Na2CO3 | D.Na2S |
您最近一年使用:0次
2022-10-26更新
|
174次组卷
|
2卷引用:重庆市巴蜀中学校2022-2023学年高二上学期第一次月考化学试题
名校
9 . 现有六种原子序数依次增大的短周期主族元素A、B、C、D、E、F。已知信息如下:
①A是原子半径最小的元素,B是空气中含量最多的元素;
②D是短周期元素中金属性最强的元素;
③部分元素在周期表中的相对位置如表所示:
请回答下列问题:
(1)A与F形成的常见化合物的结构式为_______ ;
(2)B、C、D、E的原子半径由大到小的顺序为_______ (填元素符号),简单离子半径由大到小的顺序为_______ (填离子符号)。
(3)上述元素对应的最高价含氧酸中酸性最强的是_______ (填化学式,下同),形成的最简单氢化物中沸点最高的为_______ 。
(4)C、D的单质在加热条件下反应的产物可用作_______ (写出一种用途),该产物中含有的化学键的类型为_______ 。该氧化物与水反应产生标况下2.24L气体转移的电子数为_______ 。
①A是原子半径最小的元素,B是空气中含量最多的元素;
②D是短周期元素中金属性最强的元素;
③部分元素在周期表中的相对位置如表所示:
| B | C |
| E |
(1)A与F形成的常见化合物的结构式为
(2)B、C、D、E的原子半径由大到小的顺序为
(3)上述元素对应的最高价含氧酸中酸性最强的是
(4)C、D的单质在加热条件下反应的产物可用作
您最近一年使用:0次
2022-09-21更新
|
69次组卷
|
2卷引用:重庆市璧山来凤中学校2022-2023学年高二上学期9月月考化学试题
名校
解题方法
10 . 某化学研究性学习小组拟用下列装置和药品制备无水氯化铁晶体,该物质极易水解,100℃左右时升华。请回答下列问题:
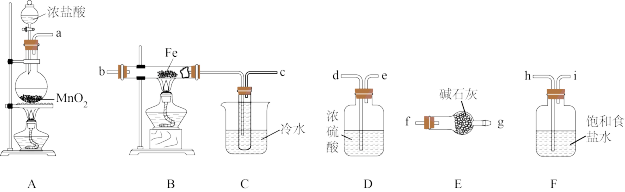
(1)不加热条件下检查A装置气密性的操作方法为_______ 。
(2)制备开始时A装置烧瓶中产生的现象为_______ 。发生反应的离子方程式为_______ 。
(3)按气流方向连接完整装置:a→_______ 。(填仪器接口字母编号)。
(4)装置F的作用是_______ 。B装置硬质玻璃管内导管口处棉花的作用是_______ 。若无E装置可能产生的后果是_______ 。
(5)本实验合理的操作步骤为_______ 。(按操作顺序选择序号)。
①添加药品
②连接仪器
③检查装置气密性
④点燃A处酒精灯
⑤点燃B处酒精灯
⑥使B中硬质玻璃管内充满黄绿色气体
(6)已知:亚铁离子与K3[Fe(SCN)6]溶液反应生成蓝色沉淀。设计实验证明装置 的硬质玻璃管中有少量的铁未能与Cl2发生反应。可选择的试剂有:KSCN溶液、酸性KMnO4溶液、K3[Fe(SCN)6]溶液、蒸馏水。其它仪器自选。
的硬质玻璃管中有少量的铁未能与Cl2发生反应。可选择的试剂有:KSCN溶液、酸性KMnO4溶液、K3[Fe(SCN)6]溶液、蒸馏水。其它仪器自选。_______ 。
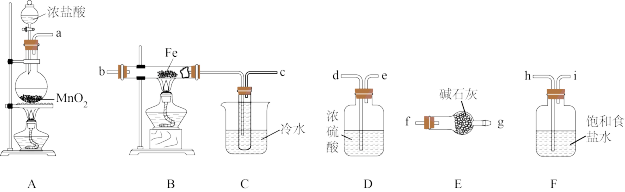
(1)不加热条件下检查A装置气密性的操作方法为
(2)制备开始时A装置烧瓶中产生的现象为
(3)按气流方向连接完整装置:a→
(4)装置F的作用是
(5)本实验合理的操作步骤为
①添加药品
②连接仪器
③检查装置气密性
④点燃A处酒精灯
⑤点燃B处酒精灯
⑥使B中硬质玻璃管内充满黄绿色气体
(6)已知:亚铁离子与K3[Fe(SCN)6]溶液反应生成蓝色沉淀。设计实验证明装置
 的硬质玻璃管中有少量的铁未能与Cl2发生反应。可选择的试剂有:KSCN溶液、酸性KMnO4溶液、K3[Fe(SCN)6]溶液、蒸馏水。其它仪器自选。
的硬质玻璃管中有少量的铁未能与Cl2发生反应。可选择的试剂有:KSCN溶液、酸性KMnO4溶液、K3[Fe(SCN)6]溶液、蒸馏水。其它仪器自选。
您最近一年使用:0次
2022-09-01更新
|
189次组卷
|
2卷引用:重庆市南开中学校2022-2023学年高二上学期培优班开学练习化学试题





