1 . 部分中学化学常见元素原子的结构及性质如表所示:
(1)A元素在周期表中的位置为___________ ,离子半径:B2+___________ (填“>”“<”或“=”,下同)C3-。
(2)简单气态氢化物的热稳定性:D___________ E。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X和Y的实验方法是___________ 。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M为___________ ,N为___________ 。
(4)用化学方程式表示C和E两种元素的非金属性强弱:___________ 。
| 元素 | 结构及性质 |
| A | A是一种常见的金属元素,它的一种氧化物是具有磁性的黑色晶体 |
| B | B是一种常见的金属元素,原子核外有三个电子层且最外层电子数为偶数 |
| C | C的气态氢化物易液化,常用作制冷剂 |
| D | D的单质为灰黑色具有金属光泽的固体,是太阳能电池板的常用材料 |
| E | E的原子最外层电子数是内层电子总数的3倍 |
| F | F在周期表中排在第IA族,也有人提出可以排在第ⅦA族 |
(2)简单气态氢化物的热稳定性:D
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X和Y的实验方法是
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M为
(4)用化学方程式表示C和E两种元素的非金属性强弱:
您最近一年使用:0次
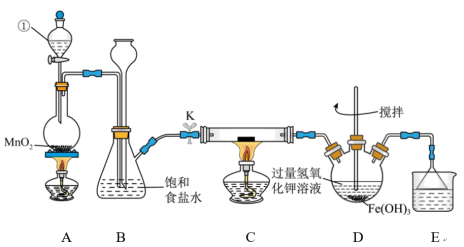
2 . 氯气是一种重要的化工原料,可用于生产塑料、合成纤维和染料等。实验室某实验小组现用下图装置来制取氯气并对氯气的某些性质和用途进行探究(K为开关,夹持装置已省略)。请回答下列问题:__________ 。
(2)检验装置A、B的气密性:将仪器①的活塞和开关K关闭,从长颈漏斗处加水至液面高于锥形瓶中的液面,若________ ,则说明装置气密性良好。
(3)装置A中发生反应的化学方程式为__________ 。
(4)装置E中的试剂是___________ ,作用是___________ 。
(5)装置C中为湿润的KI-淀粉试纸,通入 后试纸变蓝,则该反应的离子方程式为
后试纸变蓝,则该反应的离子方程式为_________ ;该小组为了研究干燥的氯气与金属钠之间的反应,欲在装置C中直接放置一块纯净的金属钠进行实验,该方案存在不妥之处,请你指出不妥之处并改正:__________ 。
(2)检验装置A、B的气密性:将仪器①的活塞和开关K关闭,从长颈漏斗处加水至液面高于锥形瓶中的液面,若
(3)装置A中发生反应的化学方程式为
(4)装置E中的试剂是
(5)装置C中为湿润的KI-淀粉试纸,通入
 后试纸变蓝,则该反应的离子方程式为
后试纸变蓝,则该反应的离子方程式为
您最近一年使用:0次
2024-03-19更新
|
51次组卷
|
2卷引用:湖南省雅礼教育集团2023-2024学年高二下学期期中考试化学试题
名校
解题方法
3 . 根据下图所示各装置和实验室制取氧气的原理,回答下列问题:

(1)仪器A的名称为___________ 。
(2)用mgMnO2和ngKC1O3组成的固体混合物加热制取氧气时,可选用的实验装置是___________ (填装置序号)。
(3)将MnO2和KC1O3的混合物充分加热至不再产生氧气时,若要将其中的催化剂MnO2回收再利用,应进行的实验操作是将固体冷却、加水溶解、___________ 、洗涤、干燥;洗涤MnO2固体的操作方法是___________ 。证明MnO2固体已洗涤干净的操作方法是___________ 。
(4)用双氧水和MnO2制取氧气时,不能选用装置c,其原因是___________ 。
(5)用装置d制取氨气时,所需的化学药品是___________ ,氨气的电子式是___________ 。

(1)仪器A的名称为
(2)用mgMnO2和ngKC1O3组成的固体混合物加热制取氧气时,可选用的实验装置是
(3)将MnO2和KC1O3的混合物充分加热至不再产生氧气时,若要将其中的催化剂MnO2回收再利用,应进行的实验操作是将固体冷却、加水溶解、
(4)用双氧水和MnO2制取氧气时,不能选用装置c,其原因是
(5)用装置d制取氨气时,所需的化学药品是
您最近一年使用:0次
名校
解题方法
4 . 煤的气化可获得清洁燃料,是实现煤的综合利用的一种重要途径,主要反应是水蒸气与灼热的木炭在高温的条件下能反应生成水煤气(两种气体),G为自然界中常见的一种气体,E与D反应生成F,各物质之间能发生下列反应,请按照要求回答问题。
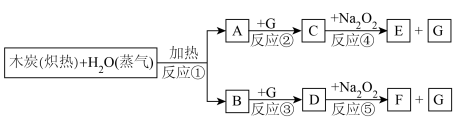
(1)写出下列物质的化学式A:_______ :B:_______ ;
(2)写出C→E的化学方程式:_______ :此反应每生成标准状况下G 11.2L转移电子数为_______ 。
(3)金属钠的两种固态氧化物 与
与 不仅颜色不同,化学性质也不同;
不仅颜色不同,化学性质也不同;
① 中阳离子与阴离子的个数之比为:
中阳离子与阴离子的个数之比为:_______ ;
②如果A和B混合气体6.0g(平均摩尔质量15g/mol)在与足量G充分反应后,通过足量Na2O2层,可使Na2O2增重_______ g;并得到O2_______ mol。

(1)写出下列物质的化学式A:
(2)写出C→E的化学方程式:
(3)金属钠的两种固态氧化物
 与
与 不仅颜色不同,化学性质也不同;
不仅颜色不同,化学性质也不同;①
 中阳离子与阴离子的个数之比为:
中阳离子与阴离子的个数之比为:②如果A和B混合气体6.0g(平均摩尔质量15g/mol)在与足量G充分反应后,通过足量Na2O2层,可使Na2O2增重
您最近一年使用:0次
解题方法
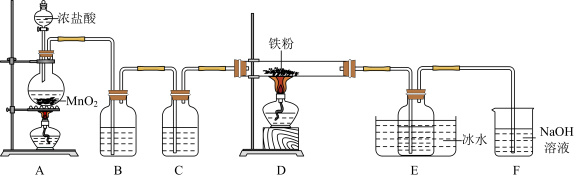
5 .  是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
已知:① 易升华、遇水蒸气易潮解。
易升华、遇水蒸气易潮解。
②实验室用铁氰化钾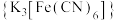 溶液检验
溶液检验 ,产生蓝色沉淀。
,产生蓝色沉淀。
回答下列问题:
(1)盛装浓盐酸的仪器是___________ (填名称),装置B中的试剂是___________ ,装置C的作用是___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置E中冰水浴的作用是___________ 。
(4)上述实验装置存在两处缺陷:一是制备产品的导气管太细,易堵塞;二是___________ 。
(5)对实验装置进行改进后,继续完成实验。实验完毕后,取产品探究其性质:
根据上述实验现象,不能确定产品中是否含有铁单质,理由是___________ (用离子方程式表示)。为了确认产品中是否含有铁单质,取上述实验②所得溶液于试管中,___________ (补充步骤和现象),则证明产品中含有铁单质。
 是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
是重要的化工产品,某小组设计如下实验装置制备氯化铁并探究其性质。
已知:①
 易升华、遇水蒸气易潮解。
易升华、遇水蒸气易潮解。②实验室用铁氰化钾
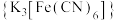 溶液检验
溶液检验 ,产生蓝色沉淀。
,产生蓝色沉淀。回答下列问题:
(1)盛装浓盐酸的仪器是
(2)装置A中发生反应的离子方程式为
(3)装置E中冰水浴的作用是
(4)上述实验装置存在两处缺陷:一是制备产品的导气管太细,易堵塞;二是
(5)对实验装置进行改进后,继续完成实验。实验完毕后,取产品探究其性质:
| 实验 | 操作 | 现象 |
| ① | 取少量固体溶于蒸缩水,滴加KSCN溶液 | 溶液变红色 |
| ② | 取少量固体溶于稀硫酸 | 固体溶解,无气泡产生 |
您最近一年使用:0次
2023-10-12更新
|
303次组卷
|
2卷引用:湖南省部分学校2023-2024学年高二上学期10月联考化学试题
名校
解题方法
6 . 周南中学化学研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并回答下列问题:
探究一:设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。

(1)硬质玻璃管B中发生反应的化学方程式为___________ 。
(2)反应前A中投放碎瓷片的目的是___________ 。
(3)装置E中的现象是___________ 。
探究二:设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分。
(4)待硬质玻管B冷却后,取少许其中的固体物质溶于___________ 后(写物质名称),将所得溶液分成两份。一份滴加几滴 溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分为
溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分为___________ (填序号)。
①一定有 ②一定有
②一定有 ③只有
③只有 ④只有
④只有
另一份用胶头滴管加入___________ (填试剂和现象),可以证明溶液中存在 。
。
探究三:设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。

(5)计算反应后B装置中铁元素的质量分数为___________ 。
探究一:设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。

(1)硬质玻璃管B中发生反应的化学方程式为
(2)反应前A中投放碎瓷片的目的是
(3)装置E中的现象是
探究二:设计如下实验方案确定反应后硬质玻璃管B中黑色固体的成分。
(4)待硬质玻管B冷却后,取少许其中的固体物质溶于
 溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分为
溶液。若溶液变红色,推断硬质玻璃管B中固体物质的成分为①一定有
 ②一定有
②一定有 ③只有
③只有 ④只有
④只有
另一份用胶头滴管加入
 。
。探究三:设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数。

(5)计算反应后B装置中铁元素的质量分数为
您最近一年使用:0次
名校
7 . 磷酸亚铁[Fe3(PO4)2·8H2O](M=502g/mol)为黄白色至米色粉末,难溶于水和醋酸,溶于无机酸,可作为营养增补剂(铁质强化剂)。 合成磷酸亚铁时的主要离子反应为 :
实验步骤:(装置如图所示)
①在三颈烧瓶中先加入维生素 C 稀溶液(具有还原性)作底液;
②再向三颈烧瓶中滴入足量的 Na2HPO4与 CH3COONa 的混合溶液至 pH=4;
③滴入含 15.2g FeSO4的溶液,水浴加热、保持 pH=6 左右不断搅拌,充分反应后静置。
④进行过滤和操作 a,低温烘干得到磷酸亚铁晶体 12.6g。

请回答下列问题:
(1)仪器 A 的名称是___________ 。
(2)配制合成所需的 FeSO4溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是___________ 。
(3)用维生素 C 作底液而不用铁粉,其主要原因是___________ 。
(4)合成时需保持 pH=6 左右,控制 pH 不能太大也不能太小的原因是___________ 。
(5)操作 a 的名称是___________ 。
(6)本实验的磷酸亚铁晶体的产率是___________ 。(保留三位有效数字)

实验步骤:(装置如图所示)
①在三颈烧瓶中先加入维生素 C 稀溶液(具有还原性)作底液;
②再向三颈烧瓶中滴入足量的 Na2HPO4与 CH3COONa 的混合溶液至 pH=4;
③滴入含 15.2g FeSO4的溶液,水浴加热、保持 pH=6 左右不断搅拌,充分反应后静置。
④进行过滤和操作 a,低温烘干得到磷酸亚铁晶体 12.6g。

请回答下列问题:
(1)仪器 A 的名称是
(2)配制合成所需的 FeSO4溶液时,蒸馏水事先要煮沸、冷却,煮沸的目的是
(3)用维生素 C 作底液而不用铁粉,其主要原因是
(4)合成时需保持 pH=6 左右,控制 pH 不能太大也不能太小的原因是
(5)操作 a 的名称是
(6)本实验的磷酸亚铁晶体的产率是
您最近一年使用:0次
名校
8 . 以冶炼铝的废弃物铝灰为原料制取超细α-氧化铝的工艺流程如下(已知铝灰的主要成分为 Al2O3,另含少量 SiO2、Fe3O4、Fe2O3)。

(1)为提高“浸取”效率,常采取的措施有___________ (任写一条)。
(2)“滤渣”的主要成分为___________ 。
(3)“沉铁”对应的离子反应方程式为___________ 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为 (未配平),将产生的气体通过下图所示装置。
(未配平),将产生的气体通过下图所示装置。

①饱和 NaHSO3溶液的作用是___________ ;最后收集到的气体为___________ 。
②若洗气时酸性 KMnO4溶液褪色( MnO 被还原为 Mn2+),则反应的离子反应方程式为
被还原为 Mn2+),则反应的离子反应方程式为___________ 。

(1)为提高“浸取”效率,常采取的措施有
(2)“滤渣”的主要成分为
(3)“沉铁”对应的离子反应方程式为
(4)煅烧硫酸铝铵晶体,发生的主要反应为
 (未配平),将产生的气体通过下图所示装置。
(未配平),将产生的气体通过下图所示装置。
①饱和 NaHSO3溶液的作用是
②若洗气时酸性 KMnO4溶液褪色( MnO
 被还原为 Mn2+),则反应的离子反应方程式为
被还原为 Mn2+),则反应的离子反应方程式为
您最近一年使用:0次
2023-09-04更新
|
123次组卷
|
2卷引用:湖南省长沙市雅礼中学2023-2024学年高二上学期入学考试化学试题
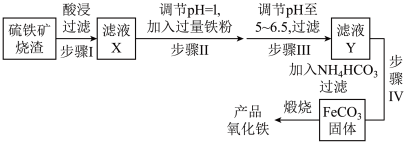
9 . 工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下
试回答下列问题:
(1)滤液X中含有的金属阳离子是_____ (填离子符号)。
(2)①步骤Ⅱ加入过量铁粉的目的是将_____ 。
②步骤Ⅲ中最好选用_____ (填字母)调节溶液的pH。
a.次氯酸钙 b.氨水 c.氢氧化钠溶液 d.高锰酸钾溶液
(3)①步骤Ⅳ加入NH4HCO3时的离子方程式:_____ 。
②步骤Ⅳ中FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是_____ 。
(4)在空气中煅烧agFeCO3得到bg产品氧化铁,则FeCO3的纯度为_____ 。

试回答下列问题:
(1)滤液X中含有的金属阳离子是
(2)①步骤Ⅱ加入过量铁粉的目的是将
②步骤Ⅲ中最好选用
a.次氯酸钙 b.氨水 c.氢氧化钠溶液 d.高锰酸钾溶液
(3)①步骤Ⅳ加入NH4HCO3时的离子方程式:
②步骤Ⅳ中FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是
(4)在空气中煅烧agFeCO3得到bg产品氧化铁,则FeCO3的纯度为
您最近一年使用:0次
名校
解题方法
10 .  可用于制备补铁剂。以磁铁矿(主要成分为
可用于制备补铁剂。以磁铁矿(主要成分为 ,含
,含 和
和 等杂质)为原料制取
等杂质)为原料制取 的工艺流程如下图:
的工艺流程如下图:

回答下列问题:
(1)将磁铁矿制成粉的目的是___________ 。
(2)滤渣1的成分是___________ (填化学式)。
(3)“转化”工序加入Fe的作用是___________ 。
(4)“调pH”时发生反应的离子方程式为___________ 。
(5)“沉铁”过程得到的“X溶液”中的主要溶质为___________ (填化学式)。
(6)①产品 在空气中煅烧可制备铁红,写出反应的化学方程式:
在空气中煅烧可制备铁红,写出反应的化学方程式:___________ 。
②在实验室中完成本操作需使用到的实验仪器(除泥三角外)有___________ (填标号)。
A.蒸发皿 B.试管 C.坩埚 D.三脚架 E.坩埚钳 F.酒精灯
③若起始时 的质量为ag,最终制得bg
的质量为ag,最终制得bg ,则
,则 产率为
产率为___________ (用含a和b的代数式表示)。
 可用于制备补铁剂。以磁铁矿(主要成分为
可用于制备补铁剂。以磁铁矿(主要成分为 ,含
,含 和
和 等杂质)为原料制取
等杂质)为原料制取 的工艺流程如下图:
的工艺流程如下图:
回答下列问题:
(1)将磁铁矿制成粉的目的是
(2)滤渣1的成分是
(3)“转化”工序加入Fe的作用是
(4)“调pH”时发生反应的离子方程式为
(5)“沉铁”过程得到的“X溶液”中的主要溶质为
(6)①产品
 在空气中煅烧可制备铁红,写出反应的化学方程式:
在空气中煅烧可制备铁红,写出反应的化学方程式:②在实验室中完成本操作需使用到的实验仪器(除泥三角外)有
A.蒸发皿 B.试管 C.坩埚 D.三脚架 E.坩埚钳 F.酒精灯
③若起始时
 的质量为ag,最终制得bg
的质量为ag,最终制得bg ,则
,则 产率为
产率为
您最近一年使用:0次
2023-08-18更新
|
153次组卷
|
2卷引用:湖南省长沙市长郡中学2023-2024学年高二上学期入学考试化学试题



