名校
1 . 电子工业中,人们常用FeCl3溶液腐蚀附在绝缘板上的铜箔,制造印刷电路板。
(1)请用化学方程式表示制造印刷电路板的反应原理_________________ 。
为了从腐蚀废液中回收铜并重新获得FeCl3溶液,可采用以下步骤:
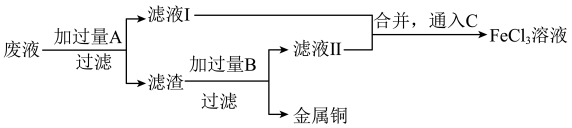
(2)写出回收铜并重新获得FeCl3溶液的过程中加入的有关物质的化学式:
A________ ,B________ ,C________ 。
(3)滤液Ⅰ中的阳离子既有氧化性又有还原性,判断的依据是_________________ 。为检验该金属阳离子,可设计的实验操作及实验现象为_________________ (可选择的试剂为“锌片”、KSCN溶液、“酸性H2O2”、“酸性KMnO4溶液”或“NaOH溶液”),且该过程发生的氧化还原反应离子方程式为_______________ 。
(4)上述步骤中,通入C发生反应的离子方程式为___________________ 。
(1)请用化学方程式表示制造印刷电路板的反应原理
为了从腐蚀废液中回收铜并重新获得FeCl3溶液,可采用以下步骤:

(2)写出回收铜并重新获得FeCl3溶液的过程中加入的有关物质的化学式:
A
(3)滤液Ⅰ中的阳离子既有氧化性又有还原性,判断的依据是
(4)上述步骤中,通入C发生反应的离子方程式为
您最近一年使用:0次
2024-01-09更新
|
67次组卷
|
2卷引用:新疆乌鲁木齐市实验学校2023-2024学年高一上学期1月期末化学试题
名校
解题方法
2 . 磷酸亚铁[ ]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以
]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以 、
、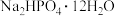 及
及 为原料制备磷酸亚铁,主要反应为
为原料制备磷酸亚铁,主要反应为
 。合成磷酸亚铁的装置如图。
。合成磷酸亚铁的装置如图。

回答下列问题:
(1)仪器A的名称为___________ 。
(2)实验中需要210 0.1
0.1
 溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有
溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有___________ ,需要称量的绿矾( )的质量为
)的质量为___________ g。
(3)实验中应使用煮沸并冷却的蒸馏水配制酸性 溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为
溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为___________ 。
(4)实验时,在仪器A中先加入抗坏血酸(维生素C)稀溶液作底液,然后向烧瓶中滴入 与
与 混合溶液至
混合溶液至 ,再滴入
,再滴入 溶液,最终维持
溶液,最终维持 。用抗坏血酸稀溶液作底液的作用是
。用抗坏血酸稀溶液作底液的作用是___________ 。
(5)生成的 沉淀需充分洗涤,检验洗涤是否完全的方法是
沉淀需充分洗涤,检验洗涤是否完全的方法是___________ 。
(6)某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠(含 、重金属盐及有色杂质等)提纯得到
、重金属盐及有色杂质等)提纯得到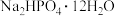 晶体。已知:
晶体。已知: 溶液的
溶液的 在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;
在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;___________ ,冷却结晶,过滤、洗涤及干燥。[实验中可选用的试剂: 溶液、0.1
溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、活性炭]
溶液、活性炭]
 ]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以
]是生产锂电池的原料,能溶于强酸,不溶于水。实验室可以 、
、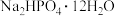 及
及 为原料制备磷酸亚铁,主要反应为
为原料制备磷酸亚铁,主要反应为
 。合成磷酸亚铁的装置如图。
。合成磷酸亚铁的装置如图。
回答下列问题:
(1)仪器A的名称为
(2)实验中需要210
 0.1
0.1
 溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有
溶液,配制该浓度的溶液需要的玻璃仪器除了烧杯、玻璃棒、量筒外,还有 )的质量为
)的质量为(3)实验中应使用煮沸并冷却的蒸馏水配制酸性
 溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为
溶液,若蒸馏水未经煮沸直接配制,则可能发生反应的离子方程式为(4)实验时,在仪器A中先加入抗坏血酸(维生素C)稀溶液作底液,然后向烧瓶中滴入
 与
与 混合溶液至
混合溶液至 ,再滴入
,再滴入 溶液,最终维持
溶液,最终维持 。用抗坏血酸稀溶液作底液的作用是
。用抗坏血酸稀溶液作底液的作用是(5)生成的
 沉淀需充分洗涤,检验洗涤是否完全的方法是
沉淀需充分洗涤,检验洗涤是否完全的方法是(6)某研究性学习小组的同学拟用工业品十二水合磷酸氢二钠(含
 、重金属盐及有色杂质等)提纯得到
、重金属盐及有色杂质等)提纯得到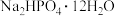 晶体。已知:
晶体。已知: 溶液的
溶液的 在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水;
在8.2~8.4之间,重金属硫化物不溶于水。请补充实验步骤:将工业品溶于热水; 溶液、0.1
溶液、0.1
 溶液、0.1
溶液、0.1
 溶液、活性炭]
溶液、活性炭]
您最近一年使用:0次
2023-10-22更新
|
321次组卷
|
3卷引用:新疆生产建设兵团第二中学(新疆兵团地州学校)2023-2024学年高三上学期期中联考化学试题
名校
解题方法
3 . 由硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、Al2O3和SiO2)得到绿矾(FeSO4•7H2O),然后制取透明氧化铁颜料的流程如图:
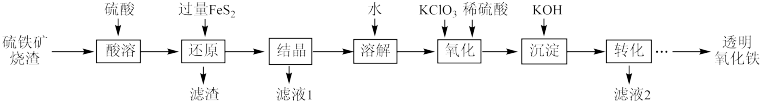
已知:
I.透明氧化铁又称纳米氧化铁,粒子直径很微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
II.Fe3+能将FeS2中的硫元素氧化为+6价。
(1)FeS2的电子式是_____ 。
(2)“滤渣”中的主要成分是_____ (填名称)。
(3)流程中“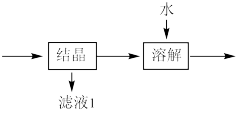 ”环节的目的是
”环节的目的是_____ 。
(4)“还原”过程中涉及的离子方程式为_____ 。
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以_____ 。
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示。
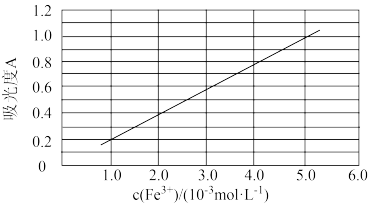
称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL,测得溶液吸光度A=0.8,则透明氧化铁中氧化铁黄的质量分数为_____ 。

已知:
I.透明氧化铁又称纳米氧化铁,粒子直径很微小(10~90nm),包括氧化铁黄(FeOOH)和氧化铁红(Fe2O3),难溶于水,在碱性条件下非常稳定;
II.Fe3+能将FeS2中的硫元素氧化为+6价。
(1)FeS2的电子式是
(2)“滤渣”中的主要成分是
(3)流程中“
 ”环节的目的是
”环节的目的是(4)“还原”过程中涉及的离子方程式为
(5)“沉淀”采用分批加入KOH溶液,并不断搅拌,这样操作不但可以得到均匀、色泽纯正的氢氧化铁,而且还可以
(6)可用分光光度法测定制得的透明氧化铁中氧化铁黄和氧化铁红的含量。已知Fe(SCN)3的吸光度A(对特定波长光的吸收程度)与Fe3+标准溶液浓度的关系如图所示。

称取3.47g透明氧化铁,用稀硫酸溶解并定容至1L,准确移取该溶液10.00mL,加入足量KSCN溶液,再用蒸馏水定容至100mL,测得溶液吸光度A=0.8,则透明氧化铁中氧化铁黄的质量分数为
您最近一年使用:0次
名校
解题方法
4 . 硫酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物。一片药片所含铁元素60mg,一盒硫酸亚铁片含药100片。
(1)每盒硫酸亚铁中含铁元素的物质的量为_______ mol(结果保留小数点后一位);
(2)甲同学为检验药片中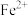 ,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如图所示),预测观察到的现象是:
,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如图所示),预测观察到的现象是:_______ ;
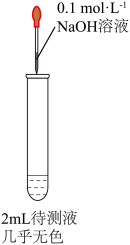
(3)乙同学认为药品有部分被氧化,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如下图所示)
ⅱ中的现象是:_______ ;是由于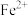 被氯水氧化,反应的离子方程式为
被氯水氧化,反应的离子方程式为_______ ;
(4)丙同学认为上述实验不能充分证明药品被部分氧化,应补充的实验是:_______ 。
(1)每盒硫酸亚铁中含铁元素的物质的量为
(2)甲同学为检验药片中
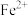 ,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如图所示),预测观察到的现象是:
,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如图所示),预测观察到的现象是:
(3)乙同学认为药品有部分被氧化,将硫酸亚铁片碾碎溶解后取上层清液进行实验(如下图所示)

ⅱ中的现象是:
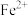 被氯水氧化,反应的离子方程式为
被氯水氧化,反应的离子方程式为(4)丙同学认为上述实验不能充分证明药品被部分氧化,应补充的实验是:
您最近一年使用:0次
2022-12-29更新
|
104次组卷
|
2卷引用:新疆巴音郭楞蒙古自治州第二中学2022-2023学年高一上学期期末考试化学试题
解题方法
5 . 已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
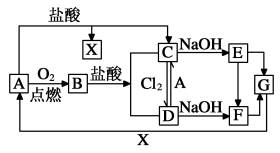
(1)写出A、C、F、G的化学式:A_____ ,C_____ ,F____ ,G_____ 。
(2)写出B与盐酸反应的离子方程式_____ 。
(3)检验D中阳离子的试剂常用_____ 。
(4)①写出下列转化的离子方程式C→D:_____ 。
②写出的化学方程式E→F:____ ,由E转化为F的现象是____ 。

(1)写出A、C、F、G的化学式:A
(2)写出B与盐酸反应的离子方程式
(3)检验D中阳离子的试剂常用
(4)①写出下列转化的离子方程式C→D:
②写出的化学方程式E→F:
您最近一年使用:0次
6 . 金属材料广泛应用于生产生活中。
(1)下列实验中,对应的现象以及结论都正确且两者具有因果关系的是_______。
(2)在 溶液蚀刻铜箔制造电路板的工艺中,是将30%的
溶液蚀刻铜箔制造电路板的工艺中,是将30%的 溶液敷在绝缘板的铜片上进行腐蚀,写出
溶液敷在绝缘板的铜片上进行腐蚀,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:_______ ;某学生对 腐蚀铜后所得溶液的成分进行测定,取少量待测溶液,滴入KSCN溶液后显红色,则该反应的离子方程式
腐蚀铜后所得溶液的成分进行测定,取少量待测溶液,滴入KSCN溶液后显红色,则该反应的离子方程式_______ 。
(3)为了从含有 、
、 的工业废水中回收Cu和硫酸亚铁晶体,某小组设计并完成了以下实验。请根据以下流程图,回答下列问题。
的工业废水中回收Cu和硫酸亚铁晶体,某小组设计并完成了以下实验。请根据以下流程图,回答下列问题。
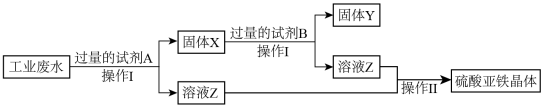
①固体X的成分_______ ,试剂B是________
②检验Z溶液中阳离子可用酸性 溶液,该反应的离子方程式
溶液,该反应的离子方程式_______ 。
(1)下列实验中,对应的现象以及结论都正确且两者具有因果关系的是_______。
| 选项 | 实验 | 现象 | 结论 |
| A | 取少量 于试管中,加入过量盐酸充分反应 于试管中,加入过量盐酸充分反应 | 黑色固体溶解,生成绿色溶液 |  为碱性氧化物 为碱性氧化物 |
| B | 将铜粉加 溶液中 溶液中 | 溶液变蓝、有黑色固体出现 | 金属铁比铜活泼 |
| C | 取少量 溶液于试管中,滴加几滴新制氯水,再滴2滴KSCN溶液 溶液于试管中,滴加几滴新制氯水,再滴2滴KSCN溶液 | 溶液变红 |  溶液没有变质 溶液没有变质 |
| D | 往红热的铁中通入水蒸气,将生成的气体通入肥皂液中,将燃着的火柴靠近气泡 | 气泡被点燃 | 铁在高温下能与水蒸气反应 |
 溶液蚀刻铜箔制造电路板的工艺中,是将30%的
溶液蚀刻铜箔制造电路板的工艺中,是将30%的 溶液敷在绝缘板的铜片上进行腐蚀,写出
溶液敷在绝缘板的铜片上进行腐蚀,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式: 腐蚀铜后所得溶液的成分进行测定,取少量待测溶液,滴入KSCN溶液后显红色,则该反应的离子方程式
腐蚀铜后所得溶液的成分进行测定,取少量待测溶液,滴入KSCN溶液后显红色,则该反应的离子方程式(3)为了从含有
 、
、 的工业废水中回收Cu和硫酸亚铁晶体,某小组设计并完成了以下实验。请根据以下流程图,回答下列问题。
的工业废水中回收Cu和硫酸亚铁晶体,某小组设计并完成了以下实验。请根据以下流程图,回答下列问题。
①固体X的成分
②检验Z溶液中阳离子可用酸性
 溶液,该反应的离子方程式
溶液,该反应的离子方程式
您最近一年使用:0次
7 . 铜及其化合物在生产、生活中有广泛的应用。印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路铜板制备CuCl2•2H2O,实验室模拟回收过程如图:

(1)证明步骤1所加FeCl3溶液过量的方法是____ 。
(2)步骤2中所加的氧化剂较适宜的有____ 。
(3)步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的试剂1是___ 。
A.NH3•H2O B.NaOH C.Cu(OH)2
(4)蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是____ (写出离子反应方程式并结合简要的文字说明),再经____ (某实验操作方法)、过滤得到CuCl2•2H2O。
方法一:用FeCl3溶液浸泡印刷电路铜板制备CuCl2•2H2O,实验室模拟回收过程如图:

(1)证明步骤1所加FeCl3溶液过量的方法是
(2)步骤2中所加的氧化剂较适宜的有
| A.HNO3 | B.H2O2 | C.KMnO4 | D.氯水 |
A.NH3•H2O B.NaOH C.Cu(OH)2
(4)蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是
您最近一年使用:0次
解题方法
8 . 从制造印刷电路板的腐蚀废液(主要含 、
、 、
、 )中回收铜,并重新获得
)中回收铜,并重新获得 溶液,处理流程如下。
溶液,处理流程如下。

请回答下列问题。
(1)试剂①、③分别为_______ 、_______ 。
(2)滤渣B中含有_______ 、_______ 。
(3)步骤I的方程式为_______ ;步骤II的化学方程式为_______ 。
(4)某 溶液可能含有
溶液可能含有 ,下列试剂中,检验
,下列试剂中,检验 存在的最佳试剂是
存在的最佳试剂是_______ (填标号)。若存在 ,则上述检验的实验现象为
,则上述检验的实验现象为_______ 。
A.氢氧化钠溶液 B.酸性 溶液 C.氯水 D.
溶液 C.氯水 D. 溶液
溶液
 、
、 、
、 )中回收铜,并重新获得
)中回收铜,并重新获得 溶液,处理流程如下。
溶液,处理流程如下。
请回答下列问题。
(1)试剂①、③分别为
(2)滤渣B中含有
(3)步骤I的方程式为
(4)某
 溶液可能含有
溶液可能含有 ,下列试剂中,检验
,下列试剂中,检验 存在的最佳试剂是
存在的最佳试剂是 ,则上述检验的实验现象为
,则上述检验的实验现象为A.氢氧化钠溶液 B.酸性
 溶液 C.氯水 D.
溶液 C.氯水 D. 溶液
溶液
您最近一年使用:0次
9 . 金属A能够被磁铁所吸引,A及其A的化合物之间有如图的转化关系:
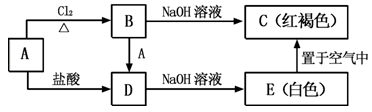
(1)写出A、C的化学式:A_______ ;C_______ 。
(2)在A→B过程中,Cl2做_______ 剂(填氧化剂或还原剂)。
(3)实验室检验B溶液中的阳离子时,通常可滴加_______ ,若溶液变为红色,则含该离子。
(4)写出B→D的离子方程式_______ 。
(5)实验室检验D溶液中的阳离子时,可加入氢氧化钠溶液,若先产生_______ 色沉淀,该沉淀在空气中迅速变为灰绿色,最终变为_______ 色,则含该离子。
(6)写出下列反应的化学方程式或离子方程式:A→D的离子方程式_______ 。E→C的化学方程式_______ 。

(1)写出A、C的化学式:A
(2)在A→B过程中,Cl2做
(3)实验室检验B溶液中的阳离子时,通常可滴加
(4)写出B→D的离子方程式
(5)实验室检验D溶液中的阳离子时,可加入氢氧化钠溶液,若先产生
(6)写出下列反应的化学方程式或离子方程式:A→D的离子方程式
您最近一年使用:0次
名校
解题方法
10 . 以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取复合氧化钴(CoxOy)的流程如下:
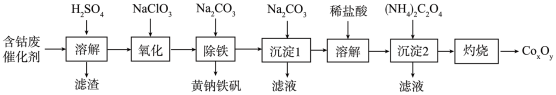
(1)用H2SO4溶解后过滤,得到的滤渣是_______ (填化学式)。将滤渣洗涤2~3次,再将洗液与滤液合并的目的是_______ 。
(2)在加热搅拌条件下加入NaClO3将Fe2+氧化成Fe3+,反应的离子方程式是_______ 。
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2 (蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3 (蓝色沉淀)
确定Fe2+是否氧化完全的方法是_______ 。
(仅供选择的试剂:铁氯化钾溶液、亚铁氯化钾溶液、铁粉、KSCN溶液)
(4)“除铁”工艺中加入适量的Na2CO3,调节pH约为2,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:_______ 。

(1)用H2SO4溶解后过滤,得到的滤渣是
(2)在加热搅拌条件下加入NaClO3将Fe2+氧化成Fe3+,反应的离子方程式是
(3)已知:铁氰化钾的化学式为K3[Fe(CN)6];亚铁氰化钾的化学式为K4[Fe(CN)6]
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2 (蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3 (蓝色沉淀)
确定Fe2+是否氧化完全的方法是
(仅供选择的试剂:铁氯化钾溶液、亚铁氯化钾溶液、铁粉、KSCN溶液)
(4)“除铁”工艺中加入适量的Na2CO3,调节pH约为2,使之生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式:
您最近一年使用:0次
2022-06-24更新
|
284次组卷
|
3卷引用:新疆石河子第一中学2022-2023学年高三10月月考化学试题



