1 . 亚硝酸钠俗称“工业盐”,其外观、口感与食盐相似,人若误服会中毒。现将适量某样品(成分为亚硝酸钠或氯化钠)溶于水配成溶液,分别取少量该溶液于试管中进行实验。下列方案设计、现象和结论都正确的是
| 方案设计 | 现象和结论 | |
| A | 先加入少量 溶液,再加 溶液,再加 溶液和足量稀硝酸,振荡 溶液和足量稀硝酸,振荡 | 若产生白色沉淀,则样品为亚硝酸钠 |
| B | 加到少量 溶液中,再加硫酸酸化,振荡 溶液中,再加硫酸酸化,振荡 | 若溶液褪色,则样品为亚硝酸钠 |
| C | 先加到少量 溶液中,再加入稀盐酸酸化,振荡 溶液中,再加入稀盐酸酸化,振荡 | 若溶液变黄色,则样品为亚硝酸钠 |
| D | 先加入少量 溶液,再加入 溶液,再加入 溶液和稀硝酸,振荡 溶液和稀硝酸,振荡 | 若产生白色沉淀,则样品为亚硝酸钠 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-06-14更新
|
10714次组卷
|
30卷引用:2022年6月浙江省普通高校招生选考化学试题
2022年6月浙江省普通高校招生选考化学试题(已下线)2022年浙江省6月高考真题变式题21-25(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第14讲 氮及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)河南省南阳一中2022-2023学年高三上学期第一次阶段性考试化学试题内蒙古包头市2022-2023学年高三上学期开学调研考试化学试题吉林省延边第二中学2022-2023学年高三上学期开学调研考试化学试题山东省枣庄市第三中学2022-2023学年高三上学期开学考试化学试题(已下线)第27讲 物质的制备与性质实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)微专题43 常见物质的分离、提纯和鉴别-备战2023年高考化学考点微专题(全国版)黑龙江省哈尔滨市尚志中学2022-2023学年高三上学期第二次月考化学试题天津市第一中学2022-2023学年高三上学期第一次月考化学试题(已下线)易错点10 硫元素及其化合物-备战2023年高考化学考试易错题北京清华附中2022-2023学年高三上学期10月统练(三)化学试题(已下线)易错点11 氮元素及其化合物-备战2023年高考化学考试易错题天津市河东区2022-2023学年高三上学期期中检测化学试题(已下线)热点情景汇编-专题四 元素及其化合物突破超重点 牢固掌握实验重点 超重点4 物质检验与鉴别的方法(已下线)专题10 常见非金属元素的性质及应用-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题23 化学实验基础性选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专题14 化学实验方案的设计与评价(已下线)专题14 化学实验方案的设计与评价(已下线)考点03 离子共存、离子的检验与推断(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点巩固卷12 化学实验基础(一)(3大考点67题)-2024年高考化学一轮复习考点通关卷(新高考通用)(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)江苏省华罗庚中学2023-2024学年高三夏令营学习能力测试化学试题(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)宁夏银川市第二中学2023-2024学年高三上学期统练四 化学试题(已下线)第3讲 物质制备实验的设计与评价
真题
名校
2 . 工业上以SO2和纯碱为原料制备无水NaHSO3的主要流程如图,下列说法错误的是


| A.吸收过程中有气体生成 | B.结晶后母液中含有NaHCO3 |
| C.气流干燥湿料时温度不宜过高 | D.中和后溶液中含Na2SO3和NaHCO3 |
您最近半年使用:0次
2021-06-29更新
|
12989次组卷
|
39卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题(已下线)课时22 硫及其化合物-2022年高考化学一轮复习小题多维练(全国通用)(已下线)专题12 硫及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练江西省赣县第三中学2021-2022学年高二上学期入学考试化学试题(已下线)专题12 工艺流程选择题-备战2022年高考化学真题及地市好题专项集训【山东专用】(已下线)第四单元 非金属及其化合物(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)安徽省合肥市第一中学2021-2022学年高三上学期10月月考化学试题内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题2021年山东高考化学试题变式题1-10(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)卷09 物质的分离、提纯-【小题小卷】冲刺2022年高考化学小题限时集训(全国卷专用)(已下线)卷05 工艺流程型选择题-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)卷05 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)(已下线)押新高考卷03题 元素化合物的性质-备战2022年高考化学临考题号押题(新高考通版)上海市奉贤区2022届高三下学期等级考二模化学试题(已下线)微专题21 二氧化硫性质四重性探究-备战2023年高考化学一轮复习考点微专题(已下线)第13讲 硫及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第12练 硫及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)微专题30 非金属及其化合物制备流程与实验探究(S、Se、Te、Cl、Br、I)-备战2023年高考化学一轮复习考点微专题新疆乌鲁木齐市第八中学2022-2023学年高三上学期第一次月考化学试题(已下线)易错点34 化学实验方案的设计与评价-备战2023年高考化学考试易错题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题江苏省扬州市广陵区名校2022-2023学年高一上学期12月月考化学试题(已下线)专题14 工艺流程选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)第四章 非金属及其化合物 第20讲 硫及其氧化物(已下线)上海市静安区2022-2023学年高三下学期二模变式题(选择题11-15)(已下线)专题10 物质的反应及转化(已下线)专题10 物质的反应及转化(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第3讲 硫及其重要化合物(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)四川省宜宾市叙州区第一中学校2022-2023学年高一下学期6月期末考试化学试题新疆石河子第一中学2023-2024学年高三上学期第三次月考化学试题山东省潍坊市昌乐二中2023-2024学年高三上学期第一次月考化学试题北京市中国人民大学附属中学2023-2024学年高三上学期11月统练三 化学试题天津市第一中学2023-2024学年高二上学期11月期中考试化学试题河南省信阳高级中学2023-2024学年高三上学期1月月考理综试题-高中化学江苏省常州市田家炳2高级中学023-2024学年高一上学期12月阶段性调研化学学科试卷
3 . 下列由实验现象所得结论错误的是
A.向NaHSO3溶液中滴加氢硫酸,产生淡黄色沉淀,证明HSO 具有氧化性 具有氧化性 |
| B.向酸性KMnO4溶液中加入Fe3O4粉末,紫色褪去,证明Fe3O4中含Fe(Ⅱ) |
| C.向浓HNO3中插入红热的炭,产生红棕色气体,证明炭可与浓HNO3反应生成NO2 |
| D.向NaClO溶液中滴加酚酞试剂,先变红后褪色,证明NaClO在溶液中发生了水解反应 |
您最近半年使用:0次
2021-06-29更新
|
9432次组卷
|
21卷引用:2021年新高考山东化学高考真题
2021年新高考山东化学高考真题山东省临沂市兰山区2020-2021学年高一下学期期末考试化学试题(已下线)课时23 氮及其化合物-2022年高考化学一轮复习小题多维练(全国通用)吉林省松原市实验高级中学2020-2021学年高一下学期期末考试化学试题(已下线)专题05 元素及其化合物-备战2022年高考化学真题及地市好题专项集训【山东专用】内蒙古北京八中乌兰察布分校2021-2022学年高三上学期学科素养评估一化学试题2021年山东高考化学试题变式题1-10(已下线)专题07 非金属及其化合物-2022年高考化学二轮复习重点专题常考点突破练(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密07 非金属及其化合物(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)秘籍05 微型实验方案设计与评价-备战2022年高考化学抢分秘籍(全国通用)(已下线)押新高考卷05题 化学实验基础-备战2022年高考化学临考题号押题(新高考通版)天津市第一中学2021-2022学年高三下学期4月月考化学试题山东省威海乳山市银滩高级中学2022-2023学年高三9月月考化学试题新疆乌鲁木齐市第八中学2022-2023学年高三上学期第一次月考化学试题河北省石家庄市第十五中学2022-2023学年高三上学期阶段性考试化学试题山东省济宁市邹城市孟子湖中学2021-2022学年高三下学期开学考试化学试题(已下线)专题24 实验分析设计型选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)题型182 综合实验突破(已下线)专题07 无机物的转化 微型工艺流程-2023年高考化学真题题源解密(全国通用)河北省唐山市第一中学2022-2023学年高三上学期11月期中考试化学试题
4 . 为探究Na2SO3的性质,实验小组同学进行了如下实验:

| A.③和④中产生的气体成分完全相同 | B.②和⑥中沉淀的主要成分不同 |
| C.①→②和④→⑥均只发生了复分解反应 | D. 的还原性在酸性条件下增强 的还原性在酸性条件下增强 |
您最近半年使用:0次
2023-04-06更新
|
2429次组卷
|
9卷引用:北京市海淀区2022-2023学年高三下学期期中练习化学试题
北京市海淀区2022-2023学年高三下学期期中练习化学试题山东省东营市第一中学2023届高三下学期二模化学试题浙江省杭州第四中学2022-2023学年高一下学期期中考试化学试题(已下线)【2023】【高一下】【期中考】【杭四下沙】【高中化学】【罗梦宇收集】(已下线)题型35 微型成套装置实验流程(已下线)题型45 物质性质探究型综合实验山西省晋城一中2022-2023学年高一下学期第三次调研考试化学试题天津市滨海新区2023-2024学年塘沽第一中学高三上学期第二次月考化学试题(已下线)热点19 化学微型实验
2023·上海·模拟预测
5 . 向饱和氯水中加入少量 亚硫酸钠固体,下列说法正确的是
亚硫酸钠固体,下列说法正确的是
 亚硫酸钠固体,下列说法正确的是
亚硫酸钠固体,下列说法正确的是| A.溶液pH减小 | B.溶液颜色变深 | C.漂白性增强 | D.导电性减弱 |
您最近半年使用:0次
6 . 某小组进行如下实验:向0.1mol·L-1 FeCl3溶液中通入SO2或加入Na2SO3溶液,均得到红色溶液。
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。
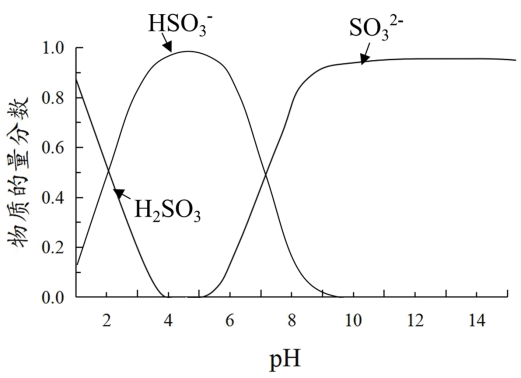
I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
(1)将上述实验补充完整________ 。
(2)配离子的配体为 的实验证据是
的实验证据是_______ 。
II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
(3)探究实验b中溶液褪色更快的原因:
i.甲认为pH降低,有利于Fe3+氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:_______ 。
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对 还原性的影响是
还原性的影响是_______ (填“增强”或“减弱”)。
③通过理论分析,甲认为其猜测_______ (填“成立”或“不成立”),并进一步实验,获得了证据。实验方案为:反应相同时间,分别取实验a和b中的溶液,检测_______ 浓度(填离子符号),比较其大小关系。
ii.乙猜测pH降低,有利于_______氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
④将乙的假设补充完整_______ (填化学式)。
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是_______ 。
(4)综合上述分析,pH降低,有利于_______ 反应的发生,导致实验b中溶液褪色更快。
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。

I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
| 实验 | 溶液1(1mL) | 溶液2(10mL) | 现象 |
| A | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液 | 溶液1与溶液2混合后,实验A、B、C所得溶液红色依次加深 |
| B | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液,用NaOH固体调 pH=5.0 | |
| C | 0.1mol·L-1 FeCl3溶液 | _______ |
(2)配离子的配体为
 的实验证据是
的实验证据是II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
| 序号 | 实验a | 实验b |
| 方案 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,测得pH=1.7 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,加几滴浓盐酸,调pH=1.3 |
| 现象 | 放置10分钟后,溶液红色均褪去,实验b中溶液褪色更快。经检验,褪色后的溶液中均存在Fe2+。 | |
i.甲认为pH降低,有利于Fe3+氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对
 还原性的影响是
还原性的影响是③通过理论分析,甲认为其猜测
ii.乙猜测pH降低,有利于_______氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。④将乙的假设补充完整
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是
(4)综合上述分析,pH降低,有利于
您最近半年使用:0次
2022-04-29更新
|
1747次组卷
|
6卷引用:北京市丰台区2022届高三二模化学试题
北京市丰台区2022届高三二模化学试题(已下线)化学-2022年高考押题预测卷03(北京卷)(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)北京市顺义区第一中学2022届高三下学期三模化学试题湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题天天练6-10
解题方法
7 . 能正确表示下列反应的离子方程式的是
A.将少量氯气通入NaHSO3溶液中:HSO +H2O+Cl2=2Cl-+3H++SO +H2O+Cl2=2Cl-+3H++SO |
B.将少量NaAlO2溶液滴入Ca(HCO3)2溶液中:AlO +HCO +HCO +H2O=Al(OH)3↓+CO +H2O=Al(OH)3↓+CO |
C.将Ba(OH)2溶液滴入明矾[KAl(SO4)2•12H2O]溶液中至沉淀质量最大:Al3++2SO +2Ba2++4OH-=2BaSO4↓+AlO +2Ba2++4OH-=2BaSO4↓+AlO +2H2O +2H2O |
D.同物质的量浓度同体积的NH4H2PO4溶液与NaOH溶液混合:NH +OH-=NH3•H2O +OH-=NH3•H2O |
您最近半年使用:0次
2023-05-15更新
|
1189次组卷
|
3卷引用:河北省部分示范性高中2023届高三三模化学试题
河北省部分示范性高中2023届高三三模化学试题浙江省名校协作体2023-2024学年高三上学期开学适应性考试化学试题(已下线)专题01 基本概念(5大题型)-【好题汇编】2024年高考化学一模试题分类汇编(浙江专用)
名校
解题方法
8 . 已知:2Fe3++2I-=2Fe2++I2;SO +I2+H2O=SO
+I2+H2O=SO +2I-+2H+,碘水呈褐色。某溶液中可能含有Na+、NH
+2I-+2H+,碘水呈褐色。某溶液中可能含有Na+、NH 、Fe2+、K+、I-、SO
、Fe2+、K+、I-、SO 、SO
、SO ,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是
,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是
 +I2+H2O=SO
+I2+H2O=SO +2I-+2H+,碘水呈褐色。某溶液中可能含有Na+、NH
+2I-+2H+,碘水呈褐色。某溶液中可能含有Na+、NH 、Fe2+、K+、I-、SO
、Fe2+、K+、I-、SO 、SO
、SO ,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是
,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是| A.肯定不含I- | B.可能只含有一种阳离子 | C.肯定含有SO | D.肯定含有NH |
您最近半年使用:0次
2023-01-10更新
|
1096次组卷
|
2卷引用:湖北省襄阳市第五中学2021-2022学年高一下学期6月考试化学试题
解题方法
9 . 科研人员提出了雾霾微粒中硫酸盐生成的三个阶段的转化机理,其主要过程示意图如图。下列说法错误的是
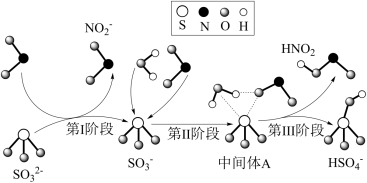

A.氧化性:NO2>SO ,还原性:SO ,还原性:SO >HNO2 >HNO2 |
B.第II、III阶段总的化学方程式为:SO +H2O+NO2=HNO2+HSO +H2O+NO2=HNO2+HSO |
| C.NO2在所有过程中都是被还原 |
| D.上述反应过程中,S的成键数目保持不变 |
您最近半年使用:0次
2022-11-20更新
|
1271次组卷
|
3卷引用:山西省吕梁市2022-2023学年高三上学期阶段性测试化学试题
山西省吕梁市2022-2023学年高三上学期阶段性测试化学试题(已下线)专题04 氧化还原反应及其应用 (测)-2023年高考化学二轮复习讲练测(新高考专用)山东日照市莒县一中2022-2023学年高一下学期3月月考化学试题
10 . 向2mL0.2mol/LCuSO4溶液中滴加0.2mol/LNa2SO3溶液时溶液变绿,继续滴加产生棕黄色沉淀,经检验棕黄色沉淀中不含 。通过实验探究棕黄色沉淀的成分。
。通过实验探究棕黄色沉淀的成分。
实验1:向棕黄色沉淀中加入稀硫酸,观察到溶液变蓝,产生红色固体
实验2: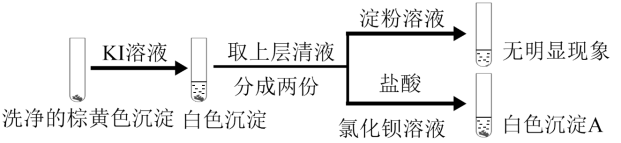
已知: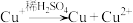 ,
,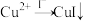 (白色)
(白色)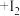 。
。
下列同学对实验现象的分析正确的是
 。通过实验探究棕黄色沉淀的成分。
。通过实验探究棕黄色沉淀的成分。实验1:向棕黄色沉淀中加入稀硫酸,观察到溶液变蓝,产生红色固体
实验2:

已知:
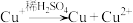 ,
,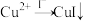 (白色)
(白色)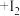 。
。下列同学对实验现象的分析正确的是
A.实验1中加入稀 后溶液变蓝可证实棕黄色沉淀中含有 后溶液变蓝可证实棕黄色沉淀中含有 |
B.实验2中加入KI溶液后产生白色沉淀,可证实棕黄色沉淀中含有 |
C.实验2中加入淀粉溶液后无明显现象,说明不存在 |
D.在 的存在下, 的存在下, 与 与 发生了氧化还原反应,产生CuI沉淀和 发生了氧化还原反应,产生CuI沉淀和 ,说明棕黄色沉淀中含有 ,说明棕黄色沉淀中含有 和 和 |
您最近半年使用:0次
2022-05-28更新
|
1254次组卷
|
11卷引用:北京市中国人民大学附属中学2022届高三下学期第三次适应性练习化学试题
北京市中国人民大学附属中学2022届高三下学期第三次适应性练习化学试题(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第13讲 硫及其化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题三 金属及其化合物 能力提升检测卷(测)-2023年高考化学一轮复习讲练测(新教材新高考)浙江省舟山市舟山中学2021-2022学年高三上学期开学考试化学试题北京首都师范大学附属中学2023届高三3月月考化学试题(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点16 铜及其金属材料(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)四川省泸州市合江县马街中学校2022-2023学年高一下学期4月期中考试化学试题辽宁省实验中学2023-2024学年高三上学期阶段测试化学试题



