20-21高三·广东广州·阶段练习
名校
1 . 某研究小组同学为探究锌与硫酸反应生成 SO2、H2的临界浓度(浓硫酸能与锌反应生成 SO2的最低浓度)设计了如图实验 (加热和夹持装置已省略)。
已知:锌与浓硫酸开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
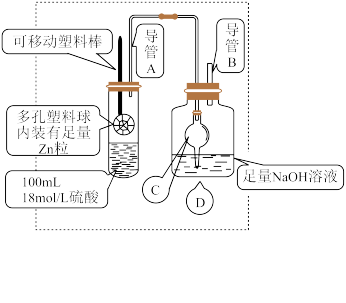
(1)请写出锌与硫酸反应产生 SO2的化学方程式_______ 。
(2)在组装仪器之后,加入试剂之前必须进行的操作是_______ 。
(3)装置中干燥管C的作用是_______ 。
(4)移动塑料棒,使锌浸没到硫酸中充分反应,反应结束后向D 装置中加入足量的 H2O2溶液,再加入足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克。
①加入 H2O2溶液发生反应的离子方程式是_______ 。
②浓硫酸与锌反应的临界浓度为:_______ mol/L。(用含a的计算式表示,忽略溶液体积变化)
(5)导管A竖直部分较长,其作用是_______ 。
(6)另甲同学提出测定方案:将D中的溶液酸化后,利用标准酸性KMnO4溶液测定原溶液中的SO ,从而计算临界浓度。乙同学认为相对于(4)中的测定方法,此方案会使测定结果偏高,你认为乙同学的理由是
,从而计算临界浓度。乙同学认为相对于(4)中的测定方法,此方案会使测定结果偏高,你认为乙同学的理由是_______ 。
已知:锌与浓硫酸开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。

(1)请写出锌与硫酸反应产生 SO2的化学方程式
(2)在组装仪器之后,加入试剂之前必须进行的操作是
(3)装置中干燥管C的作用是
(4)移动塑料棒,使锌浸没到硫酸中充分反应,反应结束后向D 装置中加入足量的 H2O2溶液,再加入足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克。
①加入 H2O2溶液发生反应的离子方程式是
②浓硫酸与锌反应的临界浓度为:
(5)导管A竖直部分较长,其作用是
(6)另甲同学提出测定方案:将D中的溶液酸化后,利用标准酸性KMnO4溶液测定原溶液中的SO
 ,从而计算临界浓度。乙同学认为相对于(4)中的测定方法,此方案会使测定结果偏高,你认为乙同学的理由是
,从而计算临界浓度。乙同学认为相对于(4)中的测定方法,此方案会使测定结果偏高,你认为乙同学的理由是
您最近一年使用:0次
2 . 为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、________________ 、________ 。
(2)写出Na2SO3固体氧化变质的化学方程式_____________ 。
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是__________________________ ,
在过滤前,需要检验是否沉淀完全,其操作是______________ 。
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果________ (填“偏高”或“偏低”)。
(5)若操作正确,则m1________ m2(填“>”、“<”或“=”),原因是_______________ 。
(6)取25.00 mL上述溶液,用酸性KMnO4溶液滴定的方法测定Na2SO3的纯度。已知酸性条件下,KMnO4通常被还原为Mn2+,则Na2SO3固体的纯度可表示为_____________ (注明表达式中所用的有关符号的含义和单位)。
方案Ⅰ:取25.00 mL上述溶液,加入足量的用过量盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙、
(2)写出Na2SO3固体氧化变质的化学方程式
(3)方案Ⅰ加入过量的盐酸酸化的BaCl2溶液,目的是
在过滤前,需要检验是否沉淀完全,其操作是
(4)方案Ⅰ中,若滤液浑浊,将导致测定结果
(5)若操作正确,则m1
(6)取25.00 mL上述溶液,用酸性KMnO4溶液滴定的方法测定Na2SO3的纯度。已知酸性条件下,KMnO4通常被还原为Mn2+,则Na2SO3固体的纯度可表示为
您最近一年使用:0次
2017-06-26更新
|
262次组卷
|
3卷引用:苏教版2017届高三单元精练检测一化学试题
20-21高二下·黑龙江哈尔滨·阶段练习
名校
解题方法
3 . 下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
| 选项 | 实验 | 现象 | 结论 |
| A | 将过量铁粉加入稀硝酸中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 将铜粉加入1.0mol/LFe2(SO4)3溶液中 | 溶液由黄色变为蓝绿(青)色 | 金属铁比铜活泼 |
| C | 向久置的FeCl2溶液中加入酸性KMnO4溶液 | KMnO4溶液紫色褪去 | FeCl2溶液没有完全被氧化 |
| D | 将少量Na2SO3样品溶于足量稀盐酸中,静置,取上层溶液于试管中,滴加BaCl2溶液 | 产生白色沉淀 | 该Na2SO3样品已经变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-19更新
|
361次组卷
|
4卷引用:考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)
(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)黑龙江省哈尔滨市第九中学2020-2021学年高二下学期6月月考化学试题湖南省衡阳师范学院祁东附属中学2021-2022学年高三上学期12月月考化学试题



