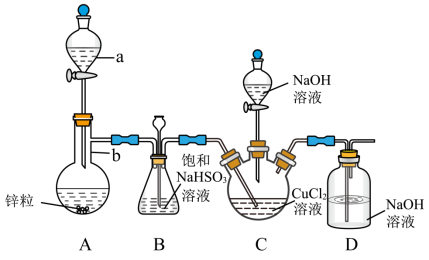
1 . CuCl是一种难溶于水和乙醇的白色固体,可溶于浓盐酸或者浓氨水(形成络合物),易被氧化为高价绿色铜盐,见光受热易分解。在催化领域广泛应用,纺织工业中常作脱色剂,可利用如图装置(夹持装置略去)将SO2通入新制氢氧化铜悬浊液中制备CuCl。
①向C中先加入10.00mL0.5mol•L-1CuCl2溶液,再加入30mL0.6mol•L-1NaOH溶液;
②取下A中分液漏斗上的玻璃塞,然后打开分液漏斗的活塞,产生SO2气体至过量,直至C中出现较多的白色沉淀,上层是淡绿色的溶液;
③将C中混合物过滤,依次用水和乙醇洗涤低温晾干,精确称量所得固体质量为0.398g。
回答下列问题:
(1)针对步骤2中的现象查阅资料得知:
i.白色沉淀为CuCl;
ii.上层淡绿色溶液中的主要溶质为NaCl和少量Cu(HSO3)2。
结论:本实验中较多量的新制氢氧化铜与二氧化硫发生了氧化还原反应,少量与之发生了复分解反应,二者为竞争关系。检验淡绿色溶液中含有 的操作方法是
的操作方法是_______ 。
①向C中先加入10.00mL0.5mol•L-1CuCl2溶液,再加入30mL0.6mol•L-1NaOH溶液;
②取下A中分液漏斗上的玻璃塞,然后打开分液漏斗的活塞,产生SO2气体至过量,直至C中出现较多的白色沉淀,上层是淡绿色的溶液;
③将C中混合物过滤,依次用水和乙醇洗涤低温晾干,精确称量所得固体质量为0.398g。
回答下列问题:
(1)针对步骤2中的现象查阅资料得知:
i.白色沉淀为CuCl;
ii.上层淡绿色溶液中的主要溶质为NaCl和少量Cu(HSO3)2。
结论:本实验中较多量的新制氢氧化铜与二氧化硫发生了氧化还原反应,少量与之发生了复分解反应,二者为竞争关系。检验淡绿色溶液中含有
 的操作方法是
的操作方法是
您最近一年使用:0次
2 . 下列物质的性质与用途具有对应关系的是
| A.Al 的金属活泼性强,可用于制作铝金属制品 |
| B.S有氧化性,可用于生产SO2 |
| C.Na2SO3具有还原性,可用于废水脱氯(Cl2) |
| D.NaHCO3受热易分解,可用于制抗酸药物 |
您最近一年使用:0次
2022-01-14更新
|
527次组卷
|
6卷引用:2023年高考浙江卷化学真题(6月)变式题(选择题1-5)
20-21高三上·黑龙江哈尔滨·开学考试
名校
解题方法
3 . 从宏观现象探究微观本质是重要的化学学科素养。
I.以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:
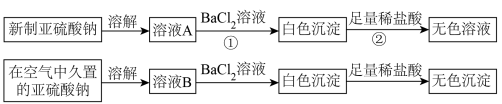
(1)写出上述实验中②的离子方程式:_________ 。
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有________ (填化学式)。
(3)亚硫酸钠晶体样品若变质,下列说法错误的是___________ 。
A.晶体表面变黄 B.其水溶液pH将减小 C.其样品质量将增加
II.以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
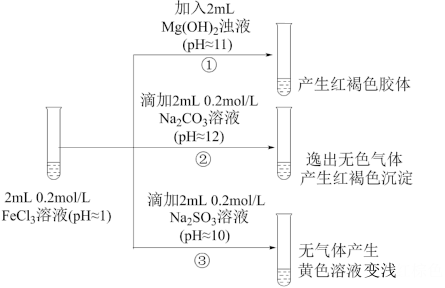
(1)①中反应的离子方程式是___________ 。
(2)②中逸出的无色气体是_____________ (写化学式)。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是_________ 。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是______________ 。
I.以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:

(1)写出上述实验中②的离子方程式:
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有
(3)亚硫酸钠晶体样品若变质,下列说法错误的是
A.晶体表面变黄 B.其水溶液pH将减小 C.其样品质量将增加
II.以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:

(1)①中反应的离子方程式是
(2)②中逸出的无色气体是
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是
您最近一年使用:0次
4 . 为探究Na2SO3的性质,实验小组同学进行了如下实验:

| A.③和④中产生的气体成分完全相同 | B.②和⑥中沉淀的主要成分不同 |
| C.①→②和④→⑥均只发生了复分解反应 | D. 的还原性在酸性条件下增强 的还原性在酸性条件下增强 |
您最近一年使用:0次
2023-04-06更新
|
2531次组卷
|
11卷引用:题型35 微型成套装置实验流程
(已下线)题型35 微型成套装置实验流程(已下线)题型45 物质性质探究型综合实验(已下线)热点19 化学微型实验北京市海淀区2022-2023学年高三下学期期中练习化学试题山东省东营市第一中学2023届高三下学期二模化学试题浙江省杭州第四中学2022-2023学年高一下学期期中考试化学试题(已下线)【2023】【高一下】【期中考】【杭四下沙】【高中化学】【罗梦宇收集】山西省晋城一中2022-2023学年高一下学期第三次调研考试化学试题天津市滨海新区2023-2024学年塘沽第一中学高三上学期第二次月考化学试题北京一零一中2023-2024学年高三上学期第一次月考(开学考)化学试卷 北京市顺义区第二中学2023-2024学年高三下学期开学测化学试题
2024高三下·全国·专题练习
解题方法
5 . 钒酸钇(YVO4)广泛应用于光纤通信领域,一种用废钒催化剂(含 V2O5、K2O、SiO2少量Fe2O3制取YVO4的工艺流程如下:
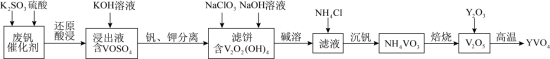
已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。 回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中还含有的金属离子是___________ 。V2O5被还原的离子方程式为___________ 。
(2)结合“碱溶”和“沉钒”可知,ClO 、VO
、VO 氧化性更强的是
氧化性更强的是___________ ,“沉钒”时发生反应的化学方程式为___________ 。
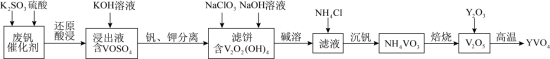
已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。 回答下列问题:
(1)“还原酸浸”时,钒以VO2+浸出,“浸出液”中还含有的金属离子是
(2)结合“碱溶”和“沉钒”可知,ClO
 、VO
、VO 氧化性更强的是
氧化性更强的是
您最近一年使用:0次
2024高三·全国·专题练习
6 . 由下列实验操作和现象得出的结论错误的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀硝酸中加入少量铁粉,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 向Co2O3中滴加浓盐酸 | 产生黄绿色气体 | 氧化性:Cl2<Co2O3 |
| C | 蘸有浓氨水的玻璃棒靠近溶液X | 有白烟 | X可能是浓盐酸 |
| D | 取少量久置的Na2SO3样品于试管中加水溶解,再加足量盐酸酸化,然后加Ba(NO3)2溶液 | 有白色沉淀产生 | Na2SO3样品被氧化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
21-22高三上·山西运城·开学考试
名校
解题方法
7 . 已知还原性: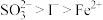 。某无色溶液中只可能含有
。某无色溶液中只可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的部分离子,取该溶液进行下列实验:
中的部分离子,取该溶液进行下列实验:
通过实验得出的结论正确的是
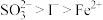 。某无色溶液中只可能含有
。某无色溶液中只可能含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的部分离子,取该溶液进行下列实验:
中的部分离子,取该溶液进行下列实验:| 实验编号 | 操作 | 现象 |
| ① | 取 溶液,先加入稍过量的氯水,后加入苯并充分振荡、静置 溶液,先加入稍过量的氯水,后加入苯并充分振荡、静置 | 生成无色气体、上层为紫色 |
| ② | 向实验①的水溶液中加入足量 和 和 溶液 溶液 | 可得到白色沉淀 |
| ③ | 取 原溶液,加入过量的 原溶液,加入过量的 溶液并加热 溶液并加热 | 产生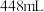 气体(标准状况) 气体(标准状况) |
A.实验①中若通入过量的 ,则可能先后氧化了 ,则可能先后氧化了 、 、 |
B.上述3个实验不能确定是否一定含有 ,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有 ,判断方法:在溶液中加硝酸银,再加硝酸,若有沉淀生成,则证明有 |
| C.判断溶液中是否含有钾离子,需要通过焰色反应来检验 |
D.实验②能够确定溶液中不含有 |
您最近一年使用:0次
2021-09-10更新
|
483次组卷
|
4卷引用:第二单元 化学物质及其变化(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)
(已下线)第二单元 化学物质及其变化(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)山西省运城市2022届高三上学期入学摸底测试化学试题天津市滨海新区塘沽第一中学2022届高三第一次月考化学试卷江西省新余市第一中学2021-2022学年高三上学期第二次模拟考试化学试题
2022·浙江·模拟预测
名校
解题方法
8 . 下列方案设计、现象和结论有正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 鉴定 与溴蒸气 与溴蒸气 | 两气体分别通入淀粉KI溶液中 | 变蓝色的是通入溴蒸气 |
| B | 检验固体混合物是否存在铵盐 | 将固体溶于水,加入足量浓NaOH溶液,加热,用红色湿润石蕊试纸检验产生的气体 | 若试纸不变蓝,说明固体中不存在铵盐 |
| C | 检验 的氧化性 的氧化性 | 在 溶液中加入 溶液中加入 溶液 溶液 | 若溶液出现淡黄色沉淀,则说明 具有氧化性 具有氧化性 |
| D | 检验火柴头中的氯元素 | 取用火柴头浸泡过的溶液,加 溶液、稀硝酸和 溶液、稀硝酸和 溶液 溶液 | 若出现白色沉淀,说明有氯元素 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-05-21更新
|
529次组卷
|
4卷引用:第28讲 物质的分离、提纯和检验(练)-2023年高考化学一轮复习讲练测(全国通用)
(已下线)第28讲 物质的分离、提纯和检验(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)专题05 突破化学实验基础(选择题)-2023年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)浙江省精诚联盟2022届高三下学期适应性考试化学试题天津市第二十一中学2023-2024学年高三上学期期中质量检测化学试题
2022·江苏连云港·二模
9 . 含SO2的工业烟气脱硫往往使用较为廉价的碱性物质如生石灰、浓氨水等吸收。近年来一些近海的煤电厂,利用海水的微碱性(8.0≤pH≤8.3)开发海水脱硫新工艺。主要原理是:SO2与海水生成H2SO3,H2SO3电离得到HSO 和SO
和SO 进一步氧化得到SO
进一步氧化得到SO 。脱硫后海水酸性增强,与新鲜海水中的碳酸盐(HCO
。脱硫后海水酸性增强,与新鲜海水中的碳酸盐(HCO 和CO
和CO )发生中和反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。在指定条件下,下列选项所示的物质间转化能实现的是
)发生中和反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。在指定条件下,下列选项所示的物质间转化能实现的是
 和SO
和SO 进一步氧化得到SO
进一步氧化得到SO 。脱硫后海水酸性增强,与新鲜海水中的碳酸盐(HCO
。脱硫后海水酸性增强,与新鲜海水中的碳酸盐(HCO 和CO
和CO )发生中和反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。在指定条件下,下列选项所示的物质间转化能实现的是
)发生中和反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。在指定条件下,下列选项所示的物质间转化能实现的是A.FeS2(s) 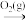 SO3(g) SO3(g) |
B.HSO (aq) (aq) 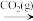 SO2 (g) SO2 (g) |
C.SO2(g)  CaSO3(s) CaSO3(s) |
D.SO2(g)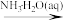 NH4HSO4(aq) NH4HSO4(aq) |
您最近一年使用:0次
10 . 实验室以浓硫酸、铜与NaOH溶液为原料制取少量NaHSO3并探究其性质,已知CuCl为白色难溶于水的化合物。
I.制备NaHSO3(装置如图所示)。

(1)仪器a的名称是____ 。
(2)装置丙的作用是____ 。
II.探究:NaHSO3与Cu2+的反应,设计实验:向2mL1mol·L-1NaHSO3溶液中加入2mL1mol·L-1CuSO4溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份。
①第一份加入适量Na2SO4固体,瞬间无明显变化,30s时也无明显变化。
②另一份加入适量NaCl固体,瞬间无明显变化,30s时有无色气体和白色沉淀生成,上层溶液颜色变浅。
(3)推测实验②产生的无色气体为SO2,用新制的氯水检验该无色气体,可观察到淡黄绿色消失,滴加BaCl2溶液有白色沉淀生成。写出SO2与氯气反应的离子方程式:____ 。
(4)对实验II产生SO2的原因进行分析,提出两种假设:
假设1:Cu2+水解使溶液中c(H+)增大。
假设2:Cl-存在时,Cu2+与HSO 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。
①假设1不合理,实验证据是____ 。
②实验证实假设2合理,实验II中发生反应的离子方程式有____ 和H++HSO =SO2↑+H2O。
=SO2↑+H2O。
III.与碘酸盐的反应:向用H2SO4酸化的KIO3溶液中滴加NaHSO3溶液(以及少量淀粉溶液)。实验现象为“无色→蓝色→无色→蓝色→……”的周期性变化,此反应过程分为三步:①IO +3HSO
+3HSO =3SO
=3SO +3H++I-(慢);②IO
+3H++I-(慢);②IO +5I-+6H+=3I2+3H2O(慢);③I2+HSO
+5I-+6H+=3I2+3H2O(慢);③I2+HSO +H2O=2I-+SO
+H2O=2I-+SO +3H+(快)。
+3H+(快)。
(5)请解释出现该实验现象可能的原因:____ 。
IV.NaHSO3固体的纯度测定:称取wgNaHSO3固体溶于水配成100mL溶液,取25.00mL已配好的溶液置于锥形瓶中,用0.1000mol·L-1的酸性KMnO4溶液进行滴定,消耗KMnO4溶液VmL。(已知:2MnO +5HSO
+5HSO +H+=2Mn2++5SO
+H+=2Mn2++5SO +3H2O)
+3H2O)
(6)滴定终点的颜色变化为____ ,NaHSO3固体的纯度为____ (用含V和w的代数式表示)。
I.制备NaHSO3(装置如图所示)。

(1)仪器a的名称是
(2)装置丙的作用是
II.探究:NaHSO3与Cu2+的反应,设计实验:向2mL1mol·L-1NaHSO3溶液中加入2mL1mol·L-1CuSO4溶液,得到绿色溶液,3min内无明显变化。将所得混合液分为两等份。
①第一份加入适量Na2SO4固体,瞬间无明显变化,30s时也无明显变化。
②另一份加入适量NaCl固体,瞬间无明显变化,30s时有无色气体和白色沉淀生成,上层溶液颜色变浅。
(3)推测实验②产生的无色气体为SO2,用新制的氯水检验该无色气体,可观察到淡黄绿色消失,滴加BaCl2溶液有白色沉淀生成。写出SO2与氯气反应的离子方程式:
(4)对实验II产生SO2的原因进行分析,提出两种假设:
假设1:Cu2+水解使溶液中c(H+)增大。
假设2:Cl-存在时,Cu2+与HSO
 反应生成CuCl白色沉淀,溶液中c(H+)增大。
反应生成CuCl白色沉淀,溶液中c(H+)增大。①假设1不合理,实验证据是
②实验证实假设2合理,实验II中发生反应的离子方程式有
 =SO2↑+H2O。
=SO2↑+H2O。III.与碘酸盐的反应:向用H2SO4酸化的KIO3溶液中滴加NaHSO3溶液(以及少量淀粉溶液)。实验现象为“无色→蓝色→无色→蓝色→……”的周期性变化,此反应过程分为三步:①IO
 +3HSO
+3HSO =3SO
=3SO +3H++I-(慢);②IO
+3H++I-(慢);②IO +5I-+6H+=3I2+3H2O(慢);③I2+HSO
+5I-+6H+=3I2+3H2O(慢);③I2+HSO +H2O=2I-+SO
+H2O=2I-+SO +3H+(快)。
+3H+(快)。(5)请解释出现该实验现象可能的原因:
IV.NaHSO3固体的纯度测定:称取wgNaHSO3固体溶于水配成100mL溶液,取25.00mL已配好的溶液置于锥形瓶中,用0.1000mol·L-1的酸性KMnO4溶液进行滴定,消耗KMnO4溶液VmL。(已知:2MnO
 +5HSO
+5HSO +H+=2Mn2++5SO
+H+=2Mn2++5SO +3H2O)
+3H2O)(6)滴定终点的颜色变化为
您最近一年使用:0次



