名校
1 . 某活动小组用碳素钢进行了如下活动:
(1)常温下,可以用铁质容器盛放冷的浓硫酸,其原因是_______ 。
(2)称取碳素钢6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用_______ (选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,溴水褪色,由此推知混合气体Y中含有_______ ,其化学方程式为:_______ ,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g,由此推知气体Y中该气体的体积分数为_______ 。
(1)常温下,可以用铁质容器盛放冷的浓硫酸,其原因是
(2)称取碳素钢6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用
A.KSCN溶液和氯水 B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,溴水褪色,由此推知混合气体Y中含有
您最近一年使用:0次
2 . 金属腐蚀原理的应用
(1)将铝片浸入浓硫酸或浓硝酸时,铝片表面产生___________ ,从而阻止铝进一步被氧化。可以用___________ 运输冷的浓硝酸或浓硫酸。
(2)铁在___________ 的混合液中发蓝、发黑,使铁表面形成一层___________ ,可防止铁被腐蚀。
(3)生活中常用的“暖宝宝”是利用___________ 原理制造的。
(1)将铝片浸入浓硫酸或浓硝酸时,铝片表面产生
(2)铁在
(3)生活中常用的“暖宝宝”是利用
您最近一年使用:0次
3 . 请列举铁与硝酸反应的各种情况,写出相关的离子方程式_______ 。
您最近一年使用:0次
4 . 2021年是国际化学年十周年纪念,中国的宣传口号是“化学一我们的生活,我们的未来”。
(1)高纯度单晶硅是典型的无机非金属材料,它的发现和使用曾引起计算机的一场“革命”。下列有关硅材料的说法正确的是_______(填字母)。
(2)工业上常用金属钠冶炼钛,是利用金属钠的强_______ 性。
(3)常温下,可用铁或铝制器皿盛放浓硝酸,是因为_______ 。
(4)纯碱和小苏打均为常见的厨房用品。兴趣小组同学用如图装置比较纯碱(Na2CO3)和小苏打(NaHCO3)的热稳定性。实验过程中可以观察到烧杯_______ (填“I”或“II”)中澄清石灰水变浑浊。加热后试管中发生反应的化学方程式为_______ 。

(5)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘:NaIO3+NaHSO3→NaHSO4+Na2SO4+I2+H2O(未配平)。配平该方程式_______ 。
(1)高纯度单晶硅是典型的无机非金属材料,它的发现和使用曾引起计算机的一场“革命”。下列有关硅材料的说法正确的是_______(填字母)。
| A.晶体硅用于制作半导体材料 | B.硅在常温下化学性比较活泼 |
| C.玻璃属于硅酸盐材料 | D.玛瑙的主要成分是硅单质 |
(3)常温下,可用铁或铝制器皿盛放浓硝酸,是因为
(4)纯碱和小苏打均为常见的厨房用品。兴趣小组同学用如图装置比较纯碱(Na2CO3)和小苏打(NaHCO3)的热稳定性。实验过程中可以观察到烧杯

(5)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘:NaIO3+NaHSO3→NaHSO4+Na2SO4+I2+H2O(未配平)。配平该方程式
您最近一年使用:0次
名校
5 . Ⅰ.图象具有直观、线索清晰、引导性强等特点,有利于提高统筹思维和概括能力。图是氮元素的化合价与部分常见含氮物质的关系。

请回答下列问题:
(1)丙的化学式为_______
(2)写出实验室制备甲的化学方程式:_______ ;收集甲物质的常用方法是_______
(3)若己物质的水溶液呈浅绿色,向该溶液中加入稀硫酸,溶液变黄色,同时生成丙,写出该过程中发生反应的离子方程式:_______
(4)丁是一种有颜色的气体,写出丁与水反应生成丙和戊的化学方程式,并用双线桥表示电子转移的情况:_______
(5)常温下,戊的浓溶液可以用干燥的铁罐车运输,原因是_______
Ⅱ.将等物质的量的 、
、 混合于2L的固定体积的密闭容器中,在一定条件下反应合成氨,经5min后达到平衡,其中
混合于2L的固定体积的密闭容器中,在一定条件下反应合成氨,经5min后达到平衡,其中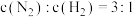 ;若将混合气体中氨气分离,恰好能与250mL2mol/L的稀硫酸溶液反应生成正盐;
;若将混合气体中氨气分离,恰好能与250mL2mol/L的稀硫酸溶液反应生成正盐;
(6)原容器中 的物质的量是
的物质的量是_______
(7)5min后容器中 的物质的量浓度
的物质的量浓度_______
(8) 的转化率是
的转化率是_______

请回答下列问题:
(1)丙的化学式为
(2)写出实验室制备甲的化学方程式:
(3)若己物质的水溶液呈浅绿色,向该溶液中加入稀硫酸,溶液变黄色,同时生成丙,写出该过程中发生反应的离子方程式:
(4)丁是一种有颜色的气体,写出丁与水反应生成丙和戊的化学方程式,并用双线桥表示电子转移的情况:
(5)常温下,戊的浓溶液可以用干燥的铁罐车运输,原因是
Ⅱ.将等物质的量的
 、
、 混合于2L的固定体积的密闭容器中,在一定条件下反应合成氨,经5min后达到平衡,其中
混合于2L的固定体积的密闭容器中,在一定条件下反应合成氨,经5min后达到平衡,其中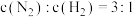 ;若将混合气体中氨气分离,恰好能与250mL2mol/L的稀硫酸溶液反应生成正盐;
;若将混合气体中氨气分离,恰好能与250mL2mol/L的稀硫酸溶液反应生成正盐;(6)原容器中
 的物质的量是
的物质的量是(7)5min后容器中
 的物质的量浓度
的物质的量浓度(8)
 的转化率是
的转化率是
您最近一年使用:0次
6 . 铁及其化合物在工农业生产、环境保护等领域中有着重要的作用。
(1)酸性条件下,硫酸亚铁可将MnO2还原为MnSO4,该反应的离子方程式为:_____________ 。
(2)分析表明,铁在浓硫酸中发生钝化时,生成的氧化物中Fe、O两种元素的质量比为28∶11,则其化学式为______________ 。
(3)铁及其化合物可用于消除环境污染。常温下,硫酸亚铁能将SO2转化为 ,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为
,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为____________________ 。
常温下,用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2反应可生成0.5 mol N2,则y=____________ 。
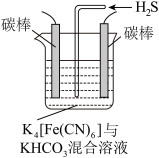
(4)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。通电电解,然后通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2 +H2S=2[Fe(CN)6]4-+2H
+H2S=2[Fe(CN)6]4-+2H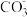 +S↓。电解时,阳极的电极反应式为
+S↓。电解时,阳极的电极反应式为___________ ;电解过程中阴极区溶液的pH______________ (填“变大”、“变小”或“不变”)。
(1)酸性条件下,硫酸亚铁可将MnO2还原为MnSO4,该反应的离子方程式为:
(2)分析表明,铁在浓硫酸中发生钝化时,生成的氧化物中Fe、O两种元素的质量比为28∶11,则其化学式为
(3)铁及其化合物可用于消除环境污染。常温下,硫酸亚铁能将SO2转化为
 ,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为
,总反应为2SO2+O2+2H2O=2H2SO4,其中一个反应为4Fe2++O2+4H+=4Fe3++2H2O,则另一个反应的离子方程式为常温下,用氧缺位铁酸锌ZnFe2Oy可以消除NOx污染,使NOx转变为N2,同时ZnFe2Oy转变为ZnFe2O4。若2 mol ZnFe2Oy与足量NO2反应可生成0.5 mol N2,则y=

(4)工业上常采用如图所示电解装置,利用铁的化合物将气态废弃物中的硫化氢转化为可利用的硫。通电电解,然后通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2
 +H2S=2[Fe(CN)6]4-+2H
+H2S=2[Fe(CN)6]4-+2H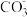 +S↓。电解时,阳极的电极反应式为
+S↓。电解时,阳极的电极反应式为
您最近一年使用:0次



