名校
解题方法
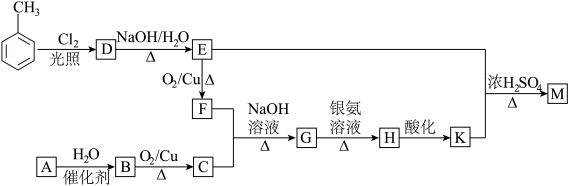
1 . 化合物M (C16H14O2)是一种香料,工业上利用烃A和甲苯为主要原料,按下列路线合成:
已知:①气态烃A在标准状况下的密度是1.25g/L,能作为果实催熟剂;②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:RCH2CHO+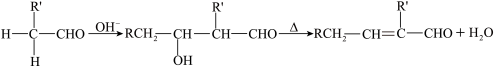 。请回答下列问题:
。请回答下列问题:
(1)K的名称是___________ ;G中含有的官能团名称是______________ 。
(2)写出D→E的化学方程式____________________________________ 。
(3)A→B的反应类型是_______ ;
(4)同时满足下列三个条件的K的同分异构体有_____ 种(不考虑立体异构)。①遇FeCl3溶液发生显色反应;②能发生银镜反应;③除苯环以外不再含有其他环状结构。其中核磁共振氢谱为五组峰的结构简式为____ 。
(5)以乙醇为起始原料,选用必要的无机试剂设计合成1-丁烯的路线。(用结构简式表示有机物,箭头上注明试剂和反应条件)____________ 。
已知:①气态烃A在标准状况下的密度是1.25g/L,能作为果实催熟剂;②醛在碱性溶液中能发生羟醛缩合反应,再脱水生成不饱和醛:RCH2CHO+
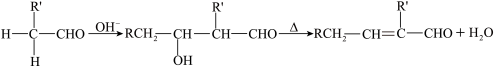 。请回答下列问题:
。请回答下列问题:(1)K的名称是
(2)写出D→E的化学方程式
(3)A→B的反应类型是
(4)同时满足下列三个条件的K的同分异构体有
(5)以乙醇为起始原料,选用必要的无机试剂设计合成1-丁烯的路线。(用结构简式表示有机物,箭头上注明试剂和反应条件)
您最近一年使用:0次
2019-09-08更新
|
297次组卷
|
3卷引用:吉林省四平市双辽市第二中学2019-2020学年高三上学期期末考试化学试题
名校
2 . 扁桃酸D在有机合成和药物生产中有着广泛应用。用常见化工原料制备D,再由此制备有机物I的合成路线如下:
回答下列问题:
(l)C的名称是____ ,I的分子式为____ 。
(2)E→F的反应类型为____ ,G中官能团的名称为____ 。
(3) A→B的化学方程式为________ 。
(4)反应G→H的试剂及条件是________ 。
(5)写出符合下列条件的D的同分异构体:________ 。
①能发生银镜反应 ②与FeC13溶液显紫色 ③核磁共振氢谱峰面积之比1:2:2:3
(6)写出以溴乙烷为原料制备H的合成路线(其他试剂任选)_____ 。

回答下列问题:
(l)C的名称是
(2)E→F的反应类型为
(3) A→B的化学方程式为
(4)反应G→H的试剂及条件是
(5)写出符合下列条件的D的同分异构体:
①能发生银镜反应 ②与FeC13溶液显紫色 ③核磁共振氢谱峰面积之比1:2:2:3
(6)写出以溴乙烷为原料制备H的合成路线(其他试剂任选)
您最近一年使用:0次
2019-11-04更新
|
469次组卷
|
4卷引用:吉林省四平市2021-2022学年高三下学期最后冲刺化学试题
2014高三·四川·专题练习
解题方法
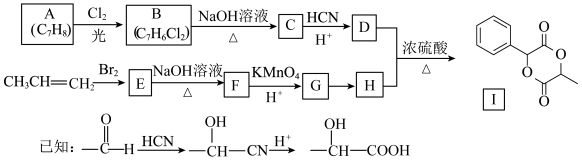
3 . 某芳香烃A可以从煤干馏得到的煤焦油中分离出来,以A为原料可以合成聚邻氨基苯甲酸、扁桃酸等物质,其合成流程如下(部分产物、合成路线、反应条件已略去):
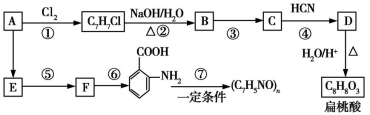
已知:
Ⅰ.R—CHO+HCN
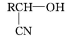
Ⅱ.R—CN R—COOH
R—COOH
Ⅲ.
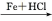
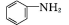 (苯胺易被氧化)
(苯胺易被氧化)
请回答下列问题:
(1)C的分子式为__________ 。
(2)下列对相关反应类型的判断合理的是__________ (填序号)。
(3)写出反应③的化学方程式:______________________________ 。
(4)扁桃酸有多种同分异构体,其中既能与氯化铁溶液发生显色反应,又能与碳酸氢钠溶液反应产生气泡的同分异构体有__________ 种,写出其中一种的结构简式:__________________ 。
(5)以芳香烃A为主要原料,还可以通过下列合成路线合成阿司匹林和冬青油:
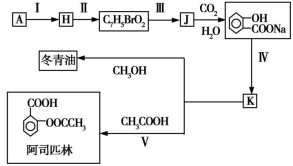
①冬青油的结构简式为____________________ 。
②写出反应Ⅴ的化学方程式:______________________________ 。

已知:
Ⅰ.R—CHO+HCN

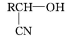
Ⅱ.R—CN
 R—COOH
R—COOHⅢ.

 (苯胺易被氧化)
(苯胺易被氧化)请回答下列问题:
(1)C的分子式为
(2)下列对相关反应类型的判断合理的是
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
| Ⅰ | 加成 | 水解 | 还原 | 取代 | 还原 | 氧化 | 加聚 |
| Ⅱ | 加成 | 消去 | 还原 | 加成 | 氧化 | 还原 | 缩聚 |
| Ⅲ | 取代 | 水解 | 氧化 | 加成 | 氧化 | 还原 | 缩聚 |
| Ⅳ | 取代 | 消去 | 氧化 | 取代 | 还原 | 氧化 | 加聚 |
(4)扁桃酸有多种同分异构体,其中既能与氯化铁溶液发生显色反应,又能与碳酸氢钠溶液反应产生气泡的同分异构体有
(5)以芳香烃A为主要原料,还可以通过下列合成路线合成阿司匹林和冬青油:

①冬青油的结构简式为
②写出反应Ⅴ的化学方程式:
您最近一年使用:0次
4 . 氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如图:
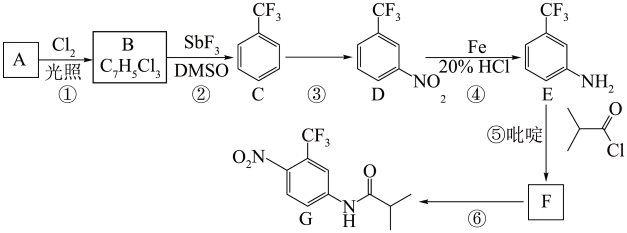
回答下列问题:
(1)A的结构简式为__ 。C的化学名称是__ 。
(2)③的反应试剂和反应条件分别是__ ,该反应的类型是__ 。
(3)⑤的反应方程式为__ 。吡啶是一种有机碱,其作用是__ 。
(4)G的分子式为__ 。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有__ 种。
(6)4-甲氧基乙酰苯胺( )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(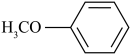 )制备4-甲氧基乙酰苯胺的合成路线
)制备4-甲氧基乙酰苯胺的合成路线__ (其他试剂任选)。

回答下列问题:
(1)A的结构简式为
(2)③的反应试剂和反应条件分别是
(3)⑤的反应方程式为
(4)G的分子式为
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有
(6)4-甲氧基乙酰苯胺(
 )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚( )制备4-甲氧基乙酰苯胺的合成路线
)制备4-甲氧基乙酰苯胺的合成路线
您最近一年使用:0次
2020-02-21更新
|
5105次组卷
|
39卷引用:吉林省(双辽市一中、长岭县一中、大安市一中、通榆县一中)2022届高三上学期摸底联考理综化学试题
吉林省(双辽市一中、长岭县一中、大安市一中、通榆县一中)2022届高三上学期摸底联考理综化学试题河北省唐山市开滦第二中学2016-2017学年高二下学期期末考试化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)黑龙江省大庆中学2016-2017学年高二下学期期末考试化学试题宁夏银川一中2018届高三上学期第二次月考理综化学试题广西桂林市第十八中学2017-2018学年高二上学期期中考试化学(理)试题广东省揭阳市第一中学2018届高三上学期第二次阶段考试化学试题(已下线)【艺体生百日捷进提升系列-技能方法】专题3.17 有机物的结构推断的解题方法与技巧(已下线)2018年5月20日 每周一测——《每日一题》2017-2018学年高二化学人教选修5(已下线)解密22 有机化学基础(教师版)——备战2018年高考化学之高频考点解密云南省玉溪市通海县第二中学2019届高三9月月考化学试题辽宁省大连市普兰店区第二中学2018届高三上学期期末考试化学试题四川省遂宁市2018届高三第一次诊断考试理综化学试题高二人教版选修5 第三章 烃的含氧衍生物 第四节 有机合成(B)云南省新平一中2019届高三上学期12月考试化学试题(已下线)2019年5月5日 《每日一题》选修5-每周一测(已下线)2019年6月21日 《每日一题》选修5-有机推断综合题贵州省独山县高级中学2020届高三上学期开学考试理综化学试题云南省西畴县第二中学2020届高三上学期开学考试化学试题云南省文山壮族苗族自治州砚山县第二中学2020届高三上学期开学考试化学试题江西省吉安市2018-2019学年高二下学期期末教学质量检测化学试题云南省文山州广南一中2019-2020学年高二上学期期中考试化学试题备考突破2020高三化学专题强化集训——化学有机推断题2020届高考化学二轮复习大题精准训练——《有机化学基础》选做题贵州省施秉县一中2019-2020学年高三上学期期末考试化学试题甘肃省高台县第一中学2020届高三上学期期中考试化学试题河北衡水中学2020届高三下学期三月份教学质量监测理科综合化学试题陕西省西安中学2020届高三第二次模拟考试化学试题西藏山南第二高级中学2021届高三上学期第三次月考理综化学试题安徽省示范高中培优联盟2020-2021学年高二上学期冬季联赛化学试题云南省保山第九中学2021届高三上学期开学考试化学试题云南省普洱市景东县第一中学2021届高三上学期期末考试化学试题山东省临沂市第一中学2020-2021学年高二下学期6月月考化学试题云南省玉溪师范学院附属中学2021-2022学年高三 上学期期末考试化学试题云南省景东彝族自治县第一中学2021-2022学年高三下学期3月份考试化学试题云南省瑞丽市第一民族中学2021-2022学年高三下学期3月月考化学试题陕西省西安市西航一中2021~2022学年高二下学期期末考试化学试题(已下线)题型161 以烃为基的有机推断云南省蒙自市第一高级中学2022-2023学年高一下学期6月月考化学试题
5 . 含氮化合物对工业生产有多种影响,化学工作者设计了如下再利用的方案:
(1)以 和
和 为原料合成化肥-尿素[CO(NH2)2],两步反应的能量变化如图:
为原料合成化肥-尿素[CO(NH2)2],两步反应的能量变化如图:
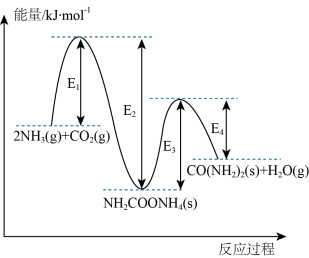
①该反应在_______ (填“高温”、“低温”或“任何温度”)下能自发进行。
②已知第二步反应决定了生产尿素的快慢,可推测
_______  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
③该反应达到化学平衡后,下列措施能提高 转化率的是
转化率的是_______ 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)氨的催化氧化过程可发生以下两种反应,该过程易受催化剂选择性影响。
Ⅰ: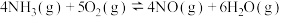
 ;
;
Ⅱ:
 ;
;
在容积固定的密闭容器中充入1.5mol 和1.55mol
和1.55mol ,一定时间段内,在催化剂作用下发生上述反应。生成物
,一定时间段内,在催化剂作用下发生上述反应。生成物 和
和 的物质的量随温度的变化曲线如图。
的物质的量随温度的变化曲线如图。
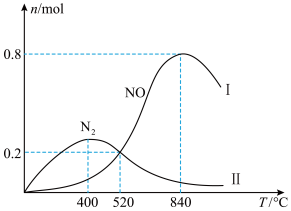
①当温度处于400℃~840℃时, 的物质的量减少,
的物质的量减少, 的物质的量增加,其原因是
的物质的量增加,其原因是_______ 。
②840℃时,反应以反应Ⅰ为主,则 的转化率为
的转化率为_______ 。(保留小数点后2位,下同);若520℃时起始压强为 ,恒温下反应Ⅱ的平衡常数
,恒温下反应Ⅱ的平衡常数
_______ ( 为以分压表示的平衡常数)
为以分压表示的平衡常数)
(3)肼( )-空气燃料电池是一种新型环保型碱性燃料电池,电解质溶液是20%~30%的
)-空气燃料电池是一种新型环保型碱性燃料电池,电解质溶液是20%~30%的 溶液。肼-空气燃料电池放电时,负极的电极反应式:
溶液。肼-空气燃料电池放电时,负极的电极反应式:_______ 。假设使用肼-空气燃枓电池电解精炼铜(已知铜的摩尔质量为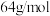 ),阴极质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气
),阴极质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气_______ L(假设空气中氧气体积分数为20%)。
(1)以
 和
和 为原料合成化肥-尿素[CO(NH2)2],两步反应的能量变化如图:
为原料合成化肥-尿素[CO(NH2)2],两步反应的能量变化如图:
①该反应在
②已知第二步反应决定了生产尿素的快慢,可推测

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。③该反应达到化学平衡后,下列措施能提高
 转化率的是
转化率的是A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(2)氨的催化氧化过程可发生以下两种反应,该过程易受催化剂选择性影响。
Ⅰ:
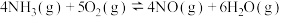
 ;
;Ⅱ:

 ;
;在容积固定的密闭容器中充入1.5mol
 和1.55mol
和1.55mol ,一定时间段内,在催化剂作用下发生上述反应。生成物
,一定时间段内,在催化剂作用下发生上述反应。生成物 和
和 的物质的量随温度的变化曲线如图。
的物质的量随温度的变化曲线如图。
①当温度处于400℃~840℃时,
 的物质的量减少,
的物质的量减少, 的物质的量增加,其原因是
的物质的量增加,其原因是②840℃时,反应以反应Ⅰ为主,则
 的转化率为
的转化率为 ,恒温下反应Ⅱ的平衡常数
,恒温下反应Ⅱ的平衡常数
 为以分压表示的平衡常数)
为以分压表示的平衡常数)(3)肼(
 )-空气燃料电池是一种新型环保型碱性燃料电池,电解质溶液是20%~30%的
)-空气燃料电池是一种新型环保型碱性燃料电池,电解质溶液是20%~30%的 溶液。肼-空气燃料电池放电时,负极的电极反应式:
溶液。肼-空气燃料电池放电时,负极的电极反应式: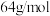 ),阴极质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气
),阴极质量变化为128g,则肼-空气燃料电池理论上消耗标准状况下的空气
您最近一年使用:0次
2022-12-07更新
|
192次组卷
|
3卷引用:吉林省四平市第一高级中学2022-2023学年高三上学期第三次月考化学试题
6 . 以下是由甲苯合成乙酰水杨酸和酚酞的合成路线。
(1)写出“甲苯→A”的化学方程式____________________ 。
(2)写出C的结构简式___________ ,E分子中的含氧官能团名称为__________________ ;
(3)上述涉及反应中,“E→酚酞”发生的反应类型是______________ 。
(4)写出符合下列条件的乙酰水杨酸的一种同分异构体的结构简式_________________ 。
①遇FeCl3溶液显紫色, ②能与碳酸氢钠反应,
③苯环上只有2个取代基的, ④能使溴的CCl4溶液褪色。
(5)写出乙酰水杨酸和NaOH溶液完全反应的化学方程式:___________________ 。
(6)由D合成E有多步,请设计出D→E的合成路线_________________ 。(有机物均用结构简式表示)。
(合成路线常用的表示方式为:D ……
…… E)
E)

(1)写出“甲苯→A”的化学方程式
(2)写出C的结构简式
(3)上述涉及反应中,“E→酚酞”发生的反应类型是
(4)写出符合下列条件的乙酰水杨酸的一种同分异构体的结构简式
①遇FeCl3溶液显紫色, ②能与碳酸氢钠反应,
③苯环上只有2个取代基的, ④能使溴的CCl4溶液褪色。
(5)写出乙酰水杨酸和NaOH溶液完全反应的化学方程式:
(6)由D合成E有多步,请设计出D→E的合成路线
(合成路线常用的表示方式为:D
 ……
…… E)
E)
您最近一年使用:0次
2017-04-04更新
|
306次组卷
|
5卷引用:吉林省四平市2021-2022学年高三下学期最后冲刺化学试题
吉林省四平市2021-2022学年高三下学期最后冲刺化学试题2015届上海市闵行区高三下学期质量调研考试(二模)化学试卷2016届上海市同济中学高三3月月考化学试卷(已下线)上海市同济中学2017届高三3月月考化学试题上海市闵行区2015年高考二模化学试题
名校
7 . 化合物G是合成某种哮喘药的中间体,G的合成路线如图,请回答下列问题:
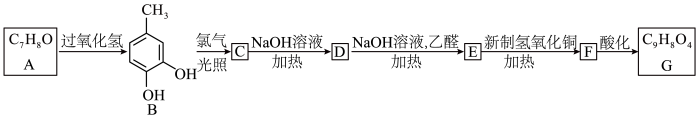
已知:I.化合物A的核磁共振氢谱有4组吸收峰。
Ⅱ.通常情况下,在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
Ⅲ.醛能发生羟醛缩合反应,再脱水生成不饱和醛:

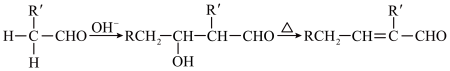
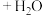
Ⅳ.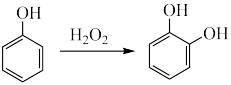
(1)A的结构简式是________ ,名称是________ ,1mol A完全燃烧消耗氧气的物质的量为________ mol。
(2)B生成C的化学方程式是________________________________ 。
(3)C的分子式为________ 。
(4)E生成F的反应类型是________________ 。
(5)G中含氧官能团的名称是________________ 。
(6)符合下列条件的B的同分异构体共有________ 种。
①能与氯化铁溶液发生显色反应
②1H—NMR谱显示分子中苯环上有2种不同化学环境的氢原子

已知:I.化合物A的核磁共振氢谱有4组吸收峰。
Ⅱ.通常情况下,在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
Ⅲ.醛能发生羟醛缩合反应,再脱水生成不饱和醛:

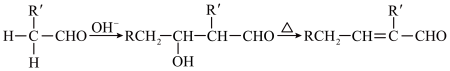
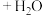
Ⅳ.
(1)A的结构简式是
(2)B生成C的化学方程式是
(3)C的分子式为
(4)E生成F的反应类型是
(5)G中含氧官能团的名称是
(6)符合下列条件的B的同分异构体共有
①能与氯化铁溶液发生显色反应
②1H—NMR谱显示分子中苯环上有2种不同化学环境的氢原子
您最近一年使用:0次
名校
8 . 氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2kJ热量。
①工业合成氨的热化学方程式是___________ 。
②若起始时向容器内放入2 mol N2和6 mol H2,达平衡时放出的热量为Q,则Q(填“>”“<”或“=”)___________ 184.4kJ。
③已知:

1 mol N-H键断裂吸收的能量等于___________ kJ。
④理论上,为了增大平衡时H2的转化率,可采取的措施是___________ (填序号)。
a. 增大压强 b. 使用合适的催化剂
c. 升高温度 d. 及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g) CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的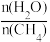 恒定时,温度、压强对平衡混合气中CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气中CH4含量的影响如下图所示:
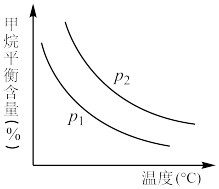
上图中两条曲线表示的压强的关系是:p1___________ p2(填“>”“=”或“<”)。
(3)原料气H2还可通过反应CO(g)+H2O(g) CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则该温度下反应的平衡常数K为___________ 。
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是___________ (填序号)。
a. 混合气体的平均相对分子质量不随时间改变
b. 混合气体的密度不随时间改变
c. 单位时间内生成a mol CO2的同时消耗a mol H2
d. 混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g) CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
①焓变△H(填“>”“<”或“=”)___________ 0。
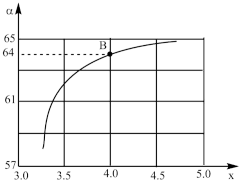
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) =x,下图是氨碳比(x)与CO2平衡转化率(
=x,下图是氨碳比(x)与CO2平衡转化率( :%)的关系。下图中的B点处,NH3的平衡转化率为
:%)的关系。下图中的B点处,NH3的平衡转化率为___________ 。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2kJ热量。
①工业合成氨的热化学方程式是
②若起始时向容器内放入2 mol N2和6 mol H2,达平衡时放出的热量为Q,则Q(填“>”“<”或“=”)
③已知:

1 mol N-H键断裂吸收的能量等于
④理论上,为了增大平衡时H2的转化率,可采取的措施是
a. 增大压强 b. 使用合适的催化剂
c. 升高温度 d. 及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)
 CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的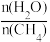 恒定时,温度、压强对平衡混合气中CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气中CH4含量的影响如下图所示:
上图中两条曲线表示的压强的关系是:p1
(3)原料气H2还可通过反应CO(g)+H2O(g)
 CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。①T℃时,向容积固定为5L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,则该温度下反应的平衡常数K为
②保持温度仍为T℃,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是
a. 混合气体的平均相对分子质量不随时间改变
b. 混合气体的密度不随时间改变
c. 单位时间内生成a mol CO2的同时消耗a mol H2
d. 混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
(4)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3(g)+CO2(g)
 CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:
CO(NH2)2(1)+H2O(1),该反应的平衡常数和温度关系如下:| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
 =x,下图是氨碳比(x)与CO2平衡转化率(
=x,下图是氨碳比(x)与CO2平衡转化率( :%)的关系。下图中的B点处,NH3的平衡转化率为
:%)的关系。下图中的B点处,NH3的平衡转化率为
您最近一年使用:0次
2022-01-02更新
|
270次组卷
|
3卷引用:吉林省四平市第一高级中学2023-2024学年高二上学期第二次月考化学试卷
2010·四川绵阳·一模
9 . 2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为 。
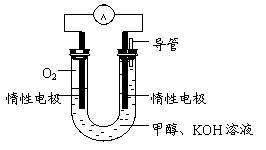
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)
 CH3OH(g) ΔH1
CH3OH(g) ΔH1反应Ⅱ: CO2(g) + 3H2(g)
 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2①上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为 。

②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
您最近一年使用:0次
2019-01-30更新
|
744次组卷
|
4卷引用:吉林省四平市双辽市第二中学2019-2020学年高三上学期期末考试化学试题
吉林省四平市双辽市第二中学2019-2020学年高三上学期期末考试化学试题(已下线)2010年四川绵阳高考预测(综合题)化学卷(已下线)2010-2011学年广东省陆丰市龙山中学高二下学期5月月考(理综)化学试题辽宁省大连市2020届高三上学期第三次模拟考试理综化学试题
真题
名校
10 . 硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式_____________ 。为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有_________ (写出两条)。
(2)利用______ 的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是______ (写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是_______ 。然后再调节溶液的pH约为5,目的是________ 。
(4)“粗硼酸”中的主要杂质是___________________________ (填名称)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_______ 。
(6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程___________ 。

回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式
(2)利用
(3)“净化除杂”需先加H2O2溶液,作用是
(4)“粗硼酸”中的主要杂质是
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为
(6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程
您最近一年使用:0次
2019-01-30更新
|
5119次组卷
|
7卷引用:吉林省公主岭市范家屯镇第一中学2020届高三上学期第二次月考化学试题
吉林省公主岭市范家屯镇第一中学2020届高三上学期第二次月考化学试题2015年全国普通高等学校招生统一考试化学(新课标I卷)2016届山东省淄博市第七中学高三上学期第一次月考化学试卷广西桂林市桂林中学2017届高三6月考前适应性模拟理科综合化学试题广东省阳东广雅学校2018届高三10月月考化学试题(已下线)专题七 工艺流程题(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训2020届高考化学二轮复习大题精准训练 ——制备类无机工艺流程题



