2016高一·全国·课时练习
名校
解题方法
1 . 下表是周期表中的一部分,根据元素A~I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)上述元素中性质最不活泼的是____ ,只有负价而无正价的是____ ,单质氧化性最强的是____ ,单质还原性最强的是____ 。
(2)上述元素的最高价氧化物对应的水化物中,碱性最强的是____ ,酸性最强的是____ ,呈两性的是____ 。
(3)A分别与D、E、F、G、H形成的化合物的化学式分别为_________________ ,这些化合物中最稳定的是____ 。
(4)在B、C、D、E、F、G、H中,原子半径最大的是____ 。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
一 | A | |||||||
二 | D | E | G | I | ||||
三 | B | C | F | H |
(2)上述元素的最高价氧化物对应的水化物中,碱性最强的是
(3)A分别与D、E、F、G、H形成的化合物的化学式分别为
(4)在B、C、D、E、F、G、H中,原子半径最大的是
您最近一年使用:0次
2020-02-24更新
|
198次组卷
|
6卷引用:吉林省四平市公主岭范家屯镇第一中学2019-2020学年高一期中考试化学试题
吉林省四平市公主岭范家屯镇第一中学2019-2020学年高一期中考试化学试题(已下线)同步君 必修2 第1章 第2节 元素周期律高中化学人教版 必修2 第一章 物质结构 元素周期律 第二节 元素周期律 元素周期律山西省忻州市第一中学人教版高一化学必修二同步检测:1.2.2元素周期律第2课时元素周期表和元素周期律的应用(已下线)4.2.1 元素性质的周期性变化规律(精练)-2020-2021学年上学期高一化学同步精品课堂(人教版必修第一册)湖北省黄冈市麻城第二中学2021-2022学年高一下学期4月月考化学试题
名校
解题方法
2 . 某补铁剂的主要成分是硫酸亚铁( ),说明书中建议“本品与维生素C同服”。为探究其原理,用放置7天的
),说明书中建议“本品与维生素C同服”。为探究其原理,用放置7天的 溶液(pH略大于3)进行下列实验。
溶液(pH略大于3)进行下列实验。
资料:维生素C( )又称抗坏血酸,将溶于水,其溶液呈酸性
)又称抗坏血酸,将溶于水,其溶液呈酸性
Ⅰ.检验铁元素的价态
(1)ⅰ中观察到_____________ ,说明溶液中存在 。由ⅱ中溶液近乎无色可以推测维生素C与
。由ⅱ中溶液近乎无色可以推测维生素C与 发生了反应:
发生了反应: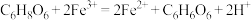 ,该反应的还原剂是
,该反应的还原剂是_____________ 。
(2)ⅰ中与 溶液滴加KSCN溶液后变浅红色相关的2个离子反应方程式为
溶液滴加KSCN溶液后变浅红色相关的2个离子反应方程式为__________ 。
(3)经分析ⅱ中检验方案不严谨,应考虑pH对反应的影响,依据是_______________ 。
Ⅱ.探究pH对ⅱ中反应的影响
补充实验如下,继续探究pH对ⅱ中反应的影响。
(4)试剂a为_____________ ,由实验现象可得结论:pH对 与SCN的显色反应有影响。
与SCN的显色反应有影响。
(5)分析实验ⅰ~ⅲ,下列说法合理的是_____________ (填序号)。
a.维生素C具有氧化性和酸性
b.同服维生素C可减缓补铁剂中 被氧化
被氧化
c.使用KSCN检验 时,宜先将溶液酸化
时,宜先将溶液酸化
 ),说明书中建议“本品与维生素C同服”。为探究其原理,用放置7天的
),说明书中建议“本品与维生素C同服”。为探究其原理,用放置7天的 溶液(pH略大于3)进行下列实验。
溶液(pH略大于3)进行下列实验。资料:维生素C(
 )又称抗坏血酸,将溶于水,其溶液呈酸性
)又称抗坏血酸,将溶于水,其溶液呈酸性Ⅰ.检验铁元素的价态
| 实验序号 | 试管中的试剂 | 实验操作及现象 |
ⅰ | 2mL放置后的 | 滴加5滴KSCN溶液后,溶液变为浅红色 | |
ⅱ | 2mL放置后的 溶液,0.1g维生素C 溶液,0.1g维生素C | 维生素C溶解,溶液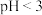 ,滴加5滴KSCN溶液后,溶液近乎无色 ,滴加5滴KSCN溶液后,溶液近乎无色 |
 。由ⅱ中溶液近乎无色可以推测维生素C与
。由ⅱ中溶液近乎无色可以推测维生素C与 发生了反应:
发生了反应: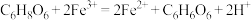 ,该反应的还原剂是
,该反应的还原剂是(2)ⅰ中与
 溶液滴加KSCN溶液后变浅红色相关的2个离子反应方程式为
溶液滴加KSCN溶液后变浅红色相关的2个离子反应方程式为(3)经分析ⅱ中检验方案不严谨,应考虑pH对反应的影响,依据是
Ⅱ.探究pH对ⅱ中反应的影响
补充实验如下,继续探究pH对ⅱ中反应的影响。
实验序号 | 试剂 | 实验操作及现象 |
ⅲ |
| 滴加5滴KSCN溶液后,溶液变为浅红色,浅红色比ⅰ中加深 |
 与SCN的显色反应有影响。
与SCN的显色反应有影响。(5)分析实验ⅰ~ⅲ,下列说法合理的是
a.维生素C具有氧化性和酸性
b.同服维生素C可减缓补铁剂中
 被氧化
被氧化c.使用KSCN检验
 时,宜先将溶液酸化
时,宜先将溶液酸化
您最近一年使用:0次
2023-04-27更新
|
307次组卷
|
2卷引用:吉林省四平市第一高级中学2023-2024学年高一上学期第二次月考化学试题
3 . 金属磷化物(如磷化锌)是常用的蒸杀虫剂。我国卫生部门规定:粮食中磷化物(以PH3计)的含量不超过0.050mg:kg-1时,粮食质量方达标。现设计测定粮食中残留磷化物含量的实验如下
【资料查阅】磷化锌易水解产生PH3;PH3沸点为-88℃,有剧毒性、强还原性、易自然。
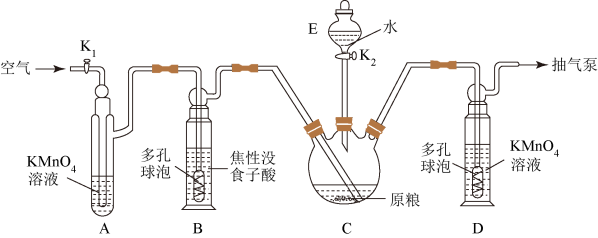
【用量标准]如图:装置A、B、E中盛有的试剂均足量;C中装有100原粮;D中盛有40.00mL6.0×10-5mol・L-1KMnO4溶液(H2SO4酸化)。
【操作流程】安装仪器并检查气密性→PH3的产生与吸收一转移KMnO4吸收溶液→用Na2SO3标准溶液滴定。
试回答下列问题:
(1)仪器E的名称是______ ;仪器B、D中进气管下端设计成多孔球泡形状,目的是______ 。
(2)A装置的作用是______ ;B装置的作用是吸收空气中的O2,防止______ 。
(3)下列操作中,不利于精确测定出实验结果的是______ (选填序号)。
a.实验前,将C中原粮预先磨碎成粉末
b.将蒸馏水预先煮沸、迅速冷却并注入E中
c.实验过程中,用抽气泵尽可能加快抽气速率
(4)磷化锌发生水解反应时除产生PH3外,还生成______ (填化学式)。
(5)D中PH3被氧化成H3PO4,该反应的离子方程式为______ 。
(6)把D中吸收液转移至容量瓶中,加水稀释至250.00mL,取25.00mL于锥形瓶中,用 5.0×10-5mol・L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液10.00mL.则该原粮中磷化物(以PH3计)的含量为______ mg・kg-1,该原粮质量______ (填“达标”或“不达标“)。
【资料查阅】磷化锌易水解产生PH3;PH3沸点为-88℃,有剧毒性、强还原性、易自然。

【用量标准]如图:装置A、B、E中盛有的试剂均足量;C中装有100原粮;D中盛有40.00mL6.0×10-5mol・L-1KMnO4溶液(H2SO4酸化)。
【操作流程】安装仪器并检查气密性→PH3的产生与吸收一转移KMnO4吸收溶液→用Na2SO3标准溶液滴定。
试回答下列问题:
(1)仪器E的名称是
(2)A装置的作用是
(3)下列操作中,不利于精确测定出实验结果的是
a.实验前,将C中原粮预先磨碎成粉末
b.将蒸馏水预先煮沸、迅速冷却并注入E中
c.实验过程中,用抽气泵尽可能加快抽气速率
(4)磷化锌发生水解反应时除产生PH3外,还生成
(5)D中PH3被氧化成H3PO4,该反应的离子方程式为
(6)把D中吸收液转移至容量瓶中,加水稀释至250.00mL,取25.00mL于锥形瓶中,用 5.0×10-5mol・L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液10.00mL.则该原粮中磷化物(以PH3计)的含量为
您最近一年使用:0次
2019-05-29更新
|
453次组卷
|
2卷引用:吉林省四平市2021-2022学年高三下学期最后冲刺化学试题
4 . 为了探究NO2与过氧化钠反应的情况,甲、乙两位同学设计了如下实验,其装置如图。
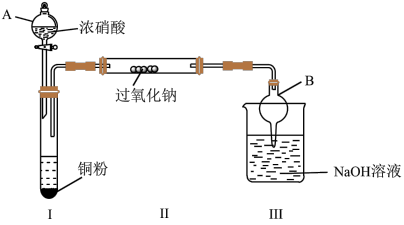
已知:2NO2+2NaOH==NaNO3+NaNO2+H2O
试回答下列问题:
(1)仪器A的名称是________________ ,仪器B的作用是________________________ 。
(2)装入药品前必须检查装置的气密性,具体操作方法是________________________ 。
(3)试管中生成NO2反应的离子方程式是________________________________________ 。
(4)实验过程中,两位同学通过检验得知气体产物中含有较多氧气。该同学通过查阅资料了解NO2具有氧化性,据此甲同学判断NO2与过氧化钠反应可得到氧气,而乙同学认为该结论不合理,理由是__________ 。为验证自己的想法,乙同学对上述装置进行了改进,具体做法是________________ 。
(5)改进装置后,再进行实验,两位同学发现过氧化钠的颜色由淡黄色逐渐变成白色,且检验不出氧气的生成,该反应的化学方程式为________________ 。

已知:2NO2+2NaOH==NaNO3+NaNO2+H2O
试回答下列问题:
(1)仪器A的名称是
(2)装入药品前必须检查装置的气密性,具体操作方法是
(3)试管中生成NO2反应的离子方程式是
(4)实验过程中,两位同学通过检验得知气体产物中含有较多氧气。该同学通过查阅资料了解NO2具有氧化性,据此甲同学判断NO2与过氧化钠反应可得到氧气,而乙同学认为该结论不合理,理由是
(5)改进装置后,再进行实验,两位同学发现过氧化钠的颜色由淡黄色逐渐变成白色,且检验不出氧气的生成,该反应的化学方程式为
您最近一年使用:0次
2019-03-29更新
|
260次组卷
|
2卷引用:吉林省四平市第一高级中学2019届高三下学期第二次模拟考试化学试题
5 . (1)铁钉在氯气中被锈蚀为棕黄色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。则在Cl2、Cl-、H+中,具有氧化性的是__ ,其中氧化性最强的是___ 。
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下三个反应,请写出盐酸在三个反应中,分别起何种作用:
①Zn+2HCl=ZnCl2+H2↑__ ;
②2HCl H2↑+Cl2↑
H2↑+Cl2↑__ 。
(3)化学实验中,如使其步骤中的有害产物作为另一步骤的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如图中:
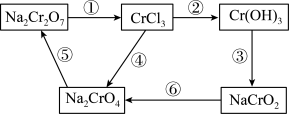
①在上述有编号的步骤中,需用还原剂的是__ ,需用氧化剂的是___ 。(填编号)
②完成步骤①的化学方程式,标出电子转移的方向和数目:
Na2Cr2O7+6KI+14HCl=2CrCl3+2NaCl+6KCl+3I2+___ 。___
(2)盐酸在不同的反应中,可以分别表现出酸性、氧化性和还原性。现有如下三个反应,请写出盐酸在三个反应中,分别起何种作用:
①Zn+2HCl=ZnCl2+H2↑
②2HCl
 H2↑+Cl2↑
H2↑+Cl2↑(3)化学实验中,如使其步骤中的有害产物作为另一步骤的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如图中:

①在上述有编号的步骤中,需用还原剂的是
②完成步骤①的化学方程式,标出电子转移的方向和数目:
Na2Cr2O7+6KI+14HCl=2CrCl3+2NaCl+6KCl+3I2+
您最近一年使用:0次
名校
6 . 下列各组比较中不正确的是
| A.稳定性:NH3>H2O |
| B.碱性:NaOH>Mg(OH)2 |
| C.氧化性:F2>O2 |
| D.酸性: HClO4>H2SO4 |
您最近一年使用:0次
2019-04-30更新
|
133次组卷
|
7卷引用:吉林省四平市公主岭范家屯镇第一中学2019-2020学年高一期中考试化学试题
真题
名校
7 . 二氧化硫能使溴水褪色,说明二氧化硫具有( )
| A.还原性 | B.氧化性 | C.漂白性 | D.酸性 |
您最近一年使用:0次
2016-12-09更新
|
2300次组卷
|
32卷引用:吉林省公主岭市范家屯镇第一中学2020届高三上学期第二次月考化学试题
吉林省公主岭市范家屯镇第一中学2020届高三上学期第二次月考化学试题2015年全国普通高等学校招生统一考试化学(上海卷)2016届安徽省皖江区域示范高中高三摸底联考化学试卷2015-2016学年云南省昆明三中高一上学期期末化学试卷上海交通大学附属中学2016-2017学年高一下学期质量检测一(3月)化学试题贵州省遵义市第四中学2015-2016学年高二上学期期中考试(文)化学试题湖南师范大学附属中学2017-2018学年高一上学期第二次阶段性检测化学试题宁夏固原市第一中学2017-2018学年高一上学期期末考试化学试题(已下线)解密06 非金属及其化合物(教师版)——备战2018年高考化学之高频考点解密【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期开学摸底考试化学试题1(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】【全国百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期开学摸底考试化学试题2【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期10月月考化学试题(已下线)2019高考热点题型和提分秘籍 第四章 常见的非金属及其化合物 第3讲 硫及其化合物 (教学案)(已下线)2019高考备考二轮复习精品资料-专题6 非金属及其化合物(教学案)(已下线)专题六 元素化合物的性质、应用及转化(真题汇编)-2020年高考二轮模块化复习之《元素化合物》名师讲案与提分特训吉林省汪清县第六中学2019-2020学年高一下学期期中考试化学试题专题4 第一单元 第1课时二氧化硫的性质和应用-高中化学苏教2019版必修第一册(已下线)5.1.1 硫与二氧化硫(练好题)(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)安徽省安庆市九一六学校2020-2021学年高一3月月考化学试题湖南省益阳市箴言中学2020-2021学年高一下学期3月月考化学(选考)试题重庆复旦中学2020-2021学年高一下学期(高2023届)期中考试化学试题(已下线)课时22 硫及其化合物-2022年高考化学一轮复习小题多维练(全国通用)广东省广州市玉岩中学2020-2021学年高一下学期期中考试化学试题(已下线)【期中复习】必刷题-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)广东省广州市广东华侨中学2021-2022学年高一下学期期中考试化学试题(已下线)专题05 化工生产中的重要非金属元素-2023年高考化学一轮复习小题多维练(全国通用)新疆霍尔果斯市苏港中学2021-2022学年高一下学期第一次月考化学试题上海中学东校2022学年高一上学期学期素质评估化学试题(已下线)第14讲 硫和二氧化硫-【暑假自学课】2023年新高一化学暑假精品课(鲁科版2019必修第一册)广东省惠州市龙门县高级中学2021-2022学年高一下学期期中考试化学试题(已下线)第3讲 硫及其重要化合物
8 . 某同学设计实验探究工业制乙烯的原理和乙烯主要的化学性质,实验装置如图所示。
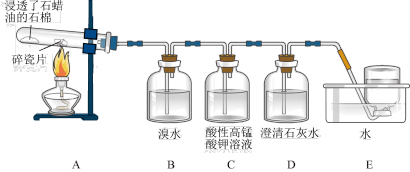
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热、加压条件下发生反应生成不饱和烃。已知烃类都不与碱反应。例如,石油分馏产物之一十六烷可发生如下反应,反应式已配平:C16H34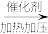 C8H18+甲,甲
C8H18+甲,甲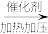 4乙,则甲的分子式为
4乙,则甲的分子式为______ ;乙的结构简式为____ 。
(2)B装置中的实验现象是______ 。
(3)C装置中的实验现象是_____ ,其中发生反应的反应类型是___ 。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置_ (填序号)中的实验现象可判断该资料是否真实。
(5)通过题述实验探究可知,检验甲烷和乙烯的方法是_____ (填序号,下同);除去甲烷中乙烯的方法是____ 。
A.气体通入水中 B.气体通过装溴水的洗气瓶
C.气体通过装酸性高锰酸钾溶液的洗气瓶 D.气体通过氢氧化钠溶液
(6)分别燃烧乙烯和甲烷,乙烯产生黑烟,原因是_____ 。

(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热、加压条件下发生反应生成不饱和烃。已知烃类都不与碱反应。例如,石油分馏产物之一十六烷可发生如下反应,反应式已配平:C16H34
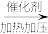 C8H18+甲,甲
C8H18+甲,甲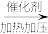 4乙,则甲的分子式为
4乙,则甲的分子式为(2)B装置中的实验现象是
(3)C装置中的实验现象是
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置
(5)通过题述实验探究可知,检验甲烷和乙烯的方法是
A.气体通入水中 B.气体通过装溴水的洗气瓶
C.气体通过装酸性高锰酸钾溶液的洗气瓶 D.气体通过氢氧化钠溶液
(6)分别燃烧乙烯和甲烷,乙烯产生黑烟,原因是
您最近一年使用:0次
2020-06-29更新
|
288次组卷
|
3卷引用:吉林省四平市公主岭范家屯镇第一中学2019-2020学年高一期中考试化学试题
名校
解题方法
9 . 下列物质的性质与用途具有对应关系的是
| A.盐酸有挥发性,可用于除铁锈 | B. 能溶于水,可用于工业制盐酸 能溶于水,可用于工业制盐酸 |
| C.NaClO具有强氧化性,可用作漂白剂 | D.NaOH显碱性,可用作干燥剂 |
您最近一年使用:0次
2023-11-02更新
|
285次组卷
|
6卷引用:吉林省四平市普通高中2023-2024学年高一上学期期中教学质量检测化学试题
19-20高一·浙江·阶段练习
解题方法
10 . 将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个离子反应:SO2+2Fe3++2H2O=SO +2Fe2++4H+;Cr2O
+2Fe2++4H+;Cr2O +6Fe2++14H+ =2Cr3++6Fe3++7H2O。
+6Fe2++14H+ =2Cr3++6Fe3++7H2O。
下列有关说法正确的是
 +2Fe2++4H+;Cr2O
+2Fe2++4H+;Cr2O +6Fe2++14H+ =2Cr3++6Fe3++7H2O。
+6Fe2++14H+ =2Cr3++6Fe3++7H2O。下列有关说法正确的是
| A.还原性:SO2> Fe2+> Cr3+ | B.氧化性:Cr2O > SO > SO >Fe3+ >Fe3+ |
C.Cr2O 能将Na2SO3还原成Na2SO4 能将Na2SO3还原成Na2SO4 | D.两个反应中Fe2(SO4)3均作还原刘 |
您最近一年使用:0次