名校
解题方法
1 . 贵州是国内唯一兼具高海拔、低纬度、寡日照、多云雾适宜种茶制茶条件的茶区,是国内业界公认的高品质绿茶重要产地。茶叶中有两种含量最多的功效成分,一是咖啡因,它易溶于水、乙醇、氯仿,二是茶多酚,是一种天然抗氧化剂(其抗氧化能力是VC的5~10倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。实验室提取茶多酚主要实验步骤如下:
②提取:称取10g茶叶末,用滤纸包好,按如图所示装置进行提取操作。

③分离:将提取液分别过滤后合并滤液,并将滤液按1∶2的体积比与氯仿混合,并搅拌均匀,再用分液漏斗静止分层。取上层液按1∶2体积比加入乙酸乙酯,混合均匀后搅拌3~5分钟,然后倒入分液漏斗中静置,最后分层,操作2次,合并萃取液,用水浴加热减压蒸馏除去乙酸乙酯。
④浓缩:趁热将残液移入洁净干燥的蒸发皿,用蒸汽浴继续浓缩至近干
⑤结晶:冷却至室温,移入冰箱冷冻干燥,得到白色粉末状的茶多酚粗制品。将粗制品用蒸馏水进行1~2次重结晶,得到茶多酚精品。
回答下列问题:
(1)步骤2中滤纸包好的茶叶末装入___________ 中,圆底烧瓶内加___________ 和适量乙醇,通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在90℃。为使恒压漏斗内液面高出茶叶包约0.5cm,并保持约1h,可行的操作方法是___________ 。
(2)步骤3中氯仿的作用是___________ 。
(3)下列关于萃取过程中振摇操作的示意图,正确的是___________ (填序号)。
A. B.
B.  C.
C.
(4)与常压蒸馏相比,减压蒸馏的优点是___________ 。
(5)在酸性介质中,茶多酚能将 还原为
还原为 ,
, 与
与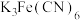 生成的深蓝色配位化合物
生成的深蓝色配位化合物 对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
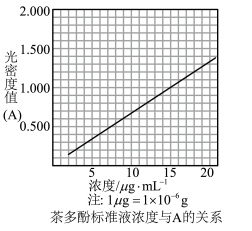
称取1.25g粗产品,用蒸馏水溶解并定容至1000mL,移取该溶液1.00mL,加过量 和
和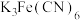 酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值
酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值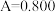 ,则产品的纯度是
,则产品的纯度是___________ (以质量分数表示)。
①准备工作:称取适量干燥的绿茶样品,并将其粉碎成细粉末。
②提取:称取10g茶叶末,用滤纸包好,按如图所示装置进行提取操作。

③分离:将提取液分别过滤后合并滤液,并将滤液按1∶2的体积比与氯仿混合,并搅拌均匀,再用分液漏斗静止分层。取上层液按1∶2体积比加入乙酸乙酯,混合均匀后搅拌3~5分钟,然后倒入分液漏斗中静置,最后分层,操作2次,合并萃取液,用水浴加热减压蒸馏除去乙酸乙酯。
④浓缩:趁热将残液移入洁净干燥的蒸发皿,用蒸汽浴继续浓缩至近干
⑤结晶:冷却至室温,移入冰箱冷冻干燥,得到白色粉末状的茶多酚粗制品。将粗制品用蒸馏水进行1~2次重结晶,得到茶多酚精品。
回答下列问题:
(1)步骤2中滤纸包好的茶叶末装入
(2)步骤3中氯仿的作用是
(3)下列关于萃取过程中振摇操作的示意图,正确的是
A.
 B.
B.  C.
C.
(4)与常压蒸馏相比,减压蒸馏的优点是
(5)在酸性介质中,茶多酚能将
 还原为
还原为 ,
, 与
与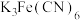 生成的深蓝色配位化合物
生成的深蓝色配位化合物 对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
对特定波长光的吸收程度(用光密度值A表示)与茶多酚在一定浓度范围内成正比。A与茶多酚标准液浓度的关系如图所示:
称取1.25g粗产品,用蒸馏水溶解并定容至1000mL,移取该溶液1.00mL,加过量
 和
和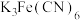 酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值
酸性溶液,用蒸馏水定容至100mL后,测得溶液光密度值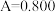 ,则产品的纯度是
,则产品的纯度是
您最近一年使用:0次
名校
解题方法
2 . 三氯化硼( )是一种重要的化工原料,可用来制造氮化硼及硼烷化合物等。查阅资料可知:
)是一种重要的化工原料,可用来制造氮化硼及硼烷化合物等。查阅资料可知:
① 的熔点为
的熔点为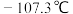 ,沸点为12.5℃,与水(包括水蒸气)能剧烈反应生成硼酸(
,沸点为12.5℃,与水(包括水蒸气)能剧烈反应生成硼酸( ),同时有白雾出现。
),同时有白雾出现。
②硼与铝的性质相似。硼与强酸或强碱溶液均能反应,与HCl气体反应生成 。
。
据此,某实验小组利用下列装置制备 (原理为
(原理为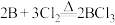 )。
)。
(1) 分子的空间结构为
分子的空间结构为__________ 。
(2)装置F的作用为__________ ,装置E的作用为____________________ 。
(3)实验装置合理的连接顺序为_______ →D→B。(装置可重复使用)
(4)连接好仪器,装入药品前,应进行的操作是_________ 。
(5)写出装置A中发生反应的化学方程式:____________________________ 。
(6)测定 产品中氯元素的含量。
产品中氯元素的含量。
称取a g样品置于蒸馏水中完全水解,并配制成100mL溶液,取出25mL于锥形瓶中,再加入
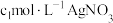 溶液使
溶液使 充分沉淀,然后加入3mL硝基苯(常温常压下,密度为
充分沉淀,然后加入3mL硝基苯(常温常压下,密度为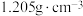 ),振荡、静置,再向锥形瓶中滴加3滴
),振荡、静置,再向锥形瓶中滴加3滴 溶液作指示剂,用
溶液作指示剂,用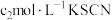 标准溶液滴定
标准溶液滴定 (发生反应
(发生反应 ),达到滴定终点时,消耗标准溶液
),达到滴定终点时,消耗标准溶液 。已知:
。已知: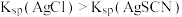 ;该实验条件下,硼酸不与
;该实验条件下,硼酸不与 反应。
反应。
①达到滴定终点时的现象为_________ 。
②样品中氯元素的质量分数为_______ %。若其他操作都正确,仅滴定管没有用KSCN标准溶液润洗,则测得产品中 的质量分数
的质量分数_______ (填“偏高”“偏低”或“无影响”)。
 )是一种重要的化工原料,可用来制造氮化硼及硼烷化合物等。查阅资料可知:
)是一种重要的化工原料,可用来制造氮化硼及硼烷化合物等。查阅资料可知:①
 的熔点为
的熔点为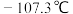 ,沸点为12.5℃,与水(包括水蒸气)能剧烈反应生成硼酸(
,沸点为12.5℃,与水(包括水蒸气)能剧烈反应生成硼酸( ),同时有白雾出现。
),同时有白雾出现。②硼与铝的性质相似。硼与强酸或强碱溶液均能反应,与HCl气体反应生成
 。
。据此,某实验小组利用下列装置制备
 (原理为
(原理为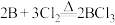 )。
)。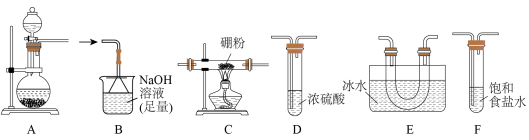
(1)
 分子的空间结构为
分子的空间结构为(2)装置F的作用为
(3)实验装置合理的连接顺序为
(4)连接好仪器,装入药品前,应进行的操作是
(5)写出装置A中发生反应的化学方程式:
(6)测定
 产品中氯元素的含量。
产品中氯元素的含量。称取a g样品置于蒸馏水中完全水解,并配制成100mL溶液,取出25mL于锥形瓶中,再加入

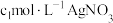 溶液使
溶液使 充分沉淀,然后加入3mL硝基苯(常温常压下,密度为
充分沉淀,然后加入3mL硝基苯(常温常压下,密度为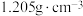 ),振荡、静置,再向锥形瓶中滴加3滴
),振荡、静置,再向锥形瓶中滴加3滴 溶液作指示剂,用
溶液作指示剂,用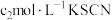 标准溶液滴定
标准溶液滴定 (发生反应
(发生反应 ),达到滴定终点时,消耗标准溶液
),达到滴定终点时,消耗标准溶液 。已知:
。已知: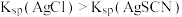 ;该实验条件下,硼酸不与
;该实验条件下,硼酸不与 反应。
反应。①达到滴定终点时的现象为
②样品中氯元素的质量分数为
 的质量分数
的质量分数
您最近一年使用:0次
2024-03-08更新
|
274次组卷
|
3卷引用:贵州省黔东南州2024届高三下学期模拟统测(二模)化学试题
名校
解题方法
3 . 亚硝酸钠(NaNO2)是一种工业盐,实验室可用如图装置(略去部分夹持仪器)制备。

已知:
① ;
;
② ;
;
③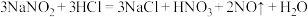 ;
;
④酸性条件下,NO和 都能与
都能与 反应生成
反应生成 和
和 ;
; 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是_______ ;
(2)装置A中发生反应的化学方程式为_______ ;
(3)实验结束后,B瓶溶液中溶质的主要成分是_______ (填化学式)。
(4)仪器C中盛放的药品为_______ (填名称)。
(5)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,_______ ,则产物是NaNO2 (注明试剂、现象)。
(6)装置F的作用是_______ ;
(7)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,再向锥形瓶中加入0.1000molL酸性KMnO4溶液20.00mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数_______ 。(写出计算过程)

已知:
①
 ;
;②
 ;
;③
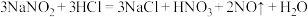 ;
;④酸性条件下,NO和
 都能与
都能与 反应生成
反应生成 和
和 ;
; 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。(1)加热装置A前,先通一段时间N2,目的是
(2)装置A中发生反应的化学方程式为
(3)实验结束后,B瓶溶液中溶质的主要成分是
(4)仪器C中盛放的药品为
(5)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,
(6)装置F的作用是
(7)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,再向锥形瓶中加入0.1000molL酸性KMnO4溶液20.00mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数
您最近一年使用:0次
2021-04-28更新
|
449次组卷
|
4卷引用:贵州省贵阳市五校2021-2022学年高三下学期联考(五)理科综合化学试题
解题方法
4 . 过滤在实验、生产、生活中有着广泛的应用。某研究性学习小组在实验室测定某含NaCl杂质的碳酸钠样品中Cl-的含量,其实验步骤如下:
①将100g样品溶于水得到溶液A;
②向A中加入稀HNO3酸化后,再加入沉淀剂B,使Cl-完全沉淀下来;
③经过滤,得到固体C,洗涤,干燥;
④称量得固体C的质量
(1)沉淀剂B为___________ (填化学式)。
(2)向A中加入稀HNO3酸化的目的是___________ 。
(3)如何洗涤固体C:___________ 。
(4)如果得到固体C后直接干燥、称量,会使样品中氯元素的质量分数___________ (填“偏大”“偏小”或“不变”)。
①将100g样品溶于水得到溶液A;
②向A中加入稀HNO3酸化后,再加入沉淀剂B,使Cl-完全沉淀下来;
③经过滤,得到固体C,洗涤,干燥;
④称量得固体C的质量
(1)沉淀剂B为
(2)向A中加入稀HNO3酸化的目的是
(3)如何洗涤固体C:
(4)如果得到固体C后直接干燥、称量,会使样品中氯元素的质量分数
您最近一年使用:0次
名校
解题方法
5 . 2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(C1O2)就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为NaClO2保存。分别利用吸收法和电解法两种方法得到较稳定的NaClO2。其工艺流程示意图如图所示:
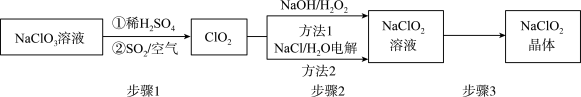
已知:1.纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
2.长期放置或高于60℃时NaClO2易分解生成NaClO3和NaCl
(1)步骤1中,生成C1O2的离子方程式是___ ,通入空气的作用是____ 。
(2)方法1中,反应的离子方程式是___ ,利用方法1制NaClO2时,温度不能超过20℃,可能的原因是____ 。
(3)方法2中,NaClO2在___ 生成(选填“阴极”或“阳极”)。
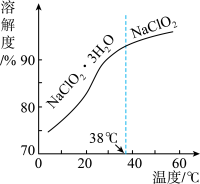
(4)NaClO2的溶解度曲线如图所示,步骤3中从NaClO2溶液中获得NaClO2的操作是__ 。
(5)为测定制得的晶体中NaClO2的含量,做如下操作:
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO +4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用bmol/LNa2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2S2O =2I-+S4O
=2I-+S4O )。样品中NaClO2的质量分数为
)。样品中NaClO2的质量分数为____ 。(用含a、b、c的代数式表示)。

已知:1.纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下。
2.长期放置或高于60℃时NaClO2易分解生成NaClO3和NaCl
(1)步骤1中,生成C1O2的离子方程式是
(2)方法1中,反应的离子方程式是
(3)方法2中,NaClO2在
(4)NaClO2的溶解度曲线如图所示,步骤3中从NaClO2溶液中获得NaClO2的操作是

(5)为测定制得的晶体中NaClO2的含量,做如下操作:
①称取a克样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO
 +4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。②移取25.00mL待测溶液于锥形瓶中,用bmol/LNa2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为cmL(已知:I2+2S2O
 =2I-+S4O
=2I-+S4O )。样品中NaClO2的质量分数为
)。样品中NaClO2的质量分数为
您最近一年使用:0次
名校
6 . 某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有___ 离子,滤渣中含有___ ;在溶解过滤时使用的仪器有___ 。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式____ 。
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为____ 。
(5)计算该样品中铝的质量分数的表达式为___ 。
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果___ (“偏高”“偏低”或“无影响”,下同)。若第(4)步对沉淀的灼烧不充分时,会使测定的结果___ 。若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果____ 。
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为
(5)计算该样品中铝的质量分数的表达式为
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果
您最近一年使用:0次
2020-01-07更新
|
163次组卷
|
5卷引用:贵州省黎平第二中学2019-2020学年高一上学期期末考试化学试题
解题方法
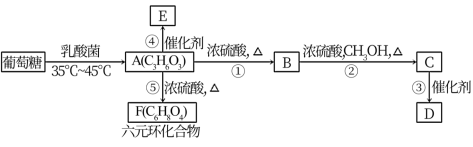
7 . 如图中化合物B既能使溴水褪色,又能溶解碳酸钙,D、E均为高分子化合物。根据下图填空:
(1)写出葡萄糖与新制氢氧化铜浊液反应的化学方程式:_____ 。
(2)A中的官能团有_____ (写结构简式)。
(3)E在自然界中可降解,对环境无害,下列说法正确的是___ 。
A.由A生成E的反应属于加聚反应
B.E的相对分子质量为72
C.E用作一次性快餐盒有助于减少白色污染
(4)在反应①-⑤中,属于取代反应的是_____ 。写出D和F的结构简式:D_______ ,F_______ 。
(5)A跟氢氧化钙作用可制得一种常用的人体补钙剂,测得这种补钙剂的纯净物中钙元素的质量分数为13.0%,其结晶水的含量为_____ 。

(1)写出葡萄糖与新制氢氧化铜浊液反应的化学方程式:
(2)A中的官能团有
(3)E在自然界中可降解,对环境无害,下列说法正确的是
A.由A生成E的反应属于加聚反应
B.E的相对分子质量为72
C.E用作一次性快餐盒有助于减少白色污染
(4)在反应①-⑤中,属于取代反应的是
(5)A跟氢氧化钙作用可制得一种常用的人体补钙剂,测得这种补钙剂的纯净物中钙元素的质量分数为13.0%,其结晶水的含量为
您最近一年使用:0次
解题方法
8 . 冰晶石(Na3AlF6)微溶于水。冰晶石主要用作冶炼金属铝的助熔剂,也可用作农作物杀虫剂、制造乳白色玻璃和搪瓷的遮光剂等。工业上用萤石(CaF2含量为96%)、二氧化硅为原料,采用氟硅酸钠法制备冰晶石,其工艺流程如下:
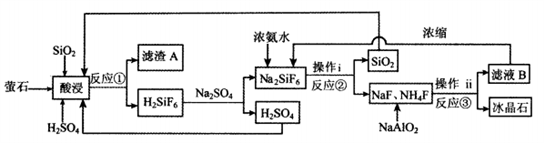
(1)Na3AlF6中Al的化合价为__________ ,滤渣A的主要成分是__________ (填化学式)。
(2)为了提高浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③__________ 。
(3)根据下表数据,选择“酸浸”时最适合的条件为__________ 。
(4)写出反应③的化学方程式__________ 。
(5)电解熔融Al2O3冶炼铝,化学方程式为 ,下图表示一定质量的Al2O3和Na3AlF6固体混合物受热过程中,某变量y随时间的变化趋势。纵坐标表示的是
,下图表示一定质量的Al2O3和Na3AlF6固体混合物受热过程中,某变量y随时间的变化趋势。纵坐标表示的是__________ 。

A.生成O2的速率 B.固体中Na3AlF6的质量
C.固体中氧元素的质量 D.固体中铝元素的质量分数
(6)此生产工艺的优点为__________ (答一条即可)。

(1)Na3AlF6中Al的化合价为
(2)为了提高浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③
(3)根据下表数据,选择“酸浸”时最适合的条件为
| 实验编号 | 萤石品位 | 硫酸浓度 | 反应温度/℃ | 获得Na2SiF6的质量/g |
| 1 | 96% | 25% | 60-70 | 120 |
| 2 | 96% | 35% | 60-70 | 153 |
| 3 | 96% | 35% | 80-90 | 100 |
| 4 | 96% | 40% | 60-70 | 141 |
(4)写出反应③的化学方程式
(5)电解熔融Al2O3冶炼铝,化学方程式为
 ,下图表示一定质量的Al2O3和Na3AlF6固体混合物受热过程中,某变量y随时间的变化趋势。纵坐标表示的是
,下图表示一定质量的Al2O3和Na3AlF6固体混合物受热过程中,某变量y随时间的变化趋势。纵坐标表示的是
A.生成O2的速率 B.固体中Na3AlF6的质量
C.固体中氧元素的质量 D.固体中铝元素的质量分数

(6)此生产工艺的优点为
您最近一年使用:0次
9 . 绿矾(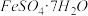 )是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
)是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
I .【制备产品】
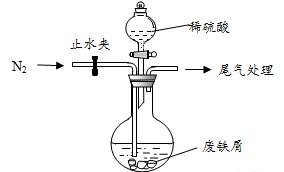
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用上图所示装置制备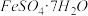 晶体,步骤如下:
晶体,步骤如下:
(1)预处理:先将废铁屑加入到饱和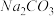 溶液中洗涤,目的是
溶液中洗涤,目的是_____ ,然后将废铁屑用水洗涤2~3 遍。
(2)将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入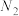 ,
,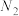 的作用是
的作用是________ 。
(3)再加入足量稀硫酸,控制温度 50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为_____________ 。
(4)获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤,____________ 。
滤出晶体,用少量冰水洗涤 2~3 次,再用滤纸将晶体吸干,密闭保存。
II.【测定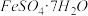 含量】
含量】
(1)称取上述样品 10.0g,溶于适量的稀硫酸中,配成 100mL 溶液,需要的仪器除天平、胶头滴管、 烧杯、量筒外,还需要的仪器有(填仪器名称)____________________ 、_______________________ 。
(2)准确量取 25mL 该液体于锥形瓶中,用 0.1000mol/L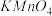 标准溶液滴定,则滴定终点的判断方法是
标准溶液滴定,则滴定终点的判断方法是________________________ 。
(3)用同样的方法滴定 3 次,平均消耗 10.00mL 标准液,该样品中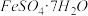 的质量分数为
的质量分数为____________ 。 (已知 Mr(
(已知 Mr(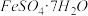 )=278)
)=278)
(4)若测量结果偏小,则可能是在定容时_________________ (填“俯视”或“仰视”)读数。
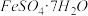 )是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
)是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:I .【制备产品】

该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用上图所示装置制备
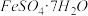 晶体,步骤如下:
晶体,步骤如下:(1)预处理:先将废铁屑加入到饱和
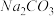 溶液中洗涤,目的是
溶液中洗涤,目的是(2)将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入
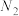 ,
,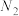 的作用是
的作用是(3)再加入足量稀硫酸,控制温度 50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为
(4)获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤,
滤出晶体,用少量冰水洗涤 2~3 次,再用滤纸将晶体吸干,密闭保存。
II.【测定
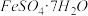 含量】
含量】(1)称取上述样品 10.0g,溶于适量的稀硫酸中,配成 100mL 溶液,需要的仪器除天平、胶头滴管、 烧杯、量筒外,还需要的仪器有(填仪器名称)
(2)准确量取 25mL 该液体于锥形瓶中,用 0.1000mol/L
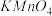 标准溶液滴定,则滴定终点的判断方法是
标准溶液滴定,则滴定终点的判断方法是(3)用同样的方法滴定 3 次,平均消耗 10.00mL 标准液,该样品中
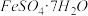 的质量分数为
的质量分数为 (已知 Mr(
(已知 Mr(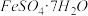 )=278)
)=278)(4)若测量结果偏小,则可能是在定容时
您最近一年使用:0次
2017-04-30更新
|
292次组卷
|
4卷引用:2016届贵州省贵阳一中高三上学期第二次月考理综化学试卷
10 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.将2mol NO和2mol  混合,充分反应后体系中原子总数为8 混合,充分反应后体系中原子总数为8 |
B.标准状况下,22.4L  中所含原子数为4 中所含原子数为4 |
C.1mol的铁与足量的硫粉发生反应,转移的电子数为3 |
D.100g质量分数为9.8%的 水溶液中所含氧原子数目为0.4 水溶液中所含氧原子数目为0.4 |
您最近一年使用:0次



