名校
1 . 高锰酸钾溶液常用于物质的定性检验与定量分析。
Ⅰ.实验室里欲用KMnO4固体来配制240mL0.2mol/L的KMnO4溶液。
(1)计算所需KMnO4固体的质量为___________ g。
(2)配制溶液时,必须用到的玻璃仪器有烧杯、玻璃棒、___________ 、___________ 。
(3)配制过程中,下列操作导致溶液浓度偏小的是___________ (填序号)。
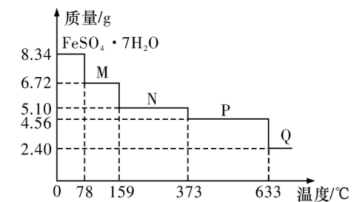
Ⅱ.为了增强高锰酸钾溶液的氧化性,需要加入2mol/L的稀硫酸溶液。现用其测定某补血剂片中亚铁的含量:称取含FeSO4·7H2O的补血剂片a克,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与cmol/L的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液25.00mL。上述过程发生反应的化学方程式为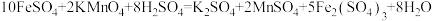 。
。
(4)则该补血剂中FeSO4·7H2O的质量分数为___________ (用含a、c的代数式表示)。
(5)将8.34gFeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。在100℃时,M的化学式为___________
Ⅰ.实验室里欲用KMnO4固体来配制240mL0.2mol/L的KMnO4溶液。
(1)计算所需KMnO4固体的质量为
(2)配制溶液时,必须用到的玻璃仪器有烧杯、玻璃棒、
(3)配制过程中,下列操作导致溶液浓度偏小的是
| A.加水定容时俯视刻度线 |
| B.容量瓶未干燥处理 |
| C.定容加水时超过刻度线后,立即吸出多余的水 |
| D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
Ⅱ.为了增强高锰酸钾溶液的氧化性,需要加入2mol/L的稀硫酸溶液。现用其测定某补血剂片中亚铁的含量:称取含FeSO4·7H2O的补血剂片a克,充分研磨后溶于水,配成100mL溶液,取25.00mL的该溶液与cmol/L的酸性高锰酸钾溶液反应,消耗酸性高锰酸钾溶液25.00mL。上述过程发生反应的化学方程式为
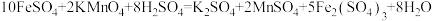 。
。(4)则该补血剂中FeSO4·7H2O的质量分数为
(5)将8.34gFeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。在100℃时,M的化学式为

您最近一年使用:0次
名校
解题方法
2 . 某同学为测定某NaHCO3(含少量NaCl)固体中NaHCO3的含量,设计如下实验。
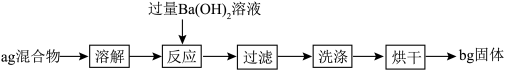
A.NaHCO3的质量分数为: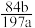 |
| B.可通过恒重操作确保固体完全烘干 |
C.反应的离子方程式为:HCO +Ba2++OH-=BaCO3↓+H2O +Ba2++OH-=BaCO3↓+H2O |
| D.确定Ba(OH)2是否过量的操作:取上层清液,继续加Ba(OH)2溶液,看有无沉淀生成 |
您最近一年使用:0次
2023-04-14更新
|
317次组卷
|
4卷引用:宁夏平罗中学2022-2023学年高二下学期期末考试化学试题
宁夏平罗中学2022-2023学年高二下学期期末考试化学试题上海市虹口区2022~2023学年高三下学期二模测试化学试题(已下线)化学-2023年高考押题预测卷01(云南,安徽,黑龙江,山西,吉林五省通用)(含考试版、全解全析、参考答案、答题卡)(已下线)单项选择题1-5
名校
解题方法
3 . 三氯化氧磷(POCl₃)是一种重要的化工原料,常用作半导体掺杂剂及光导纤维原料。研究小组在实验室模拟反应CPCl3+SO2+Cl2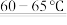 POCl3+SOCl2,制备POCl3并测定产品的含量。
POCl3+SOCl2,制备POCl3并测定产品的含量。

资料卡片:
(1)甲装置中盛放的试剂为___________ ,洗气瓶甲、丁的作用是净化原料气体和___________ ,实验室制备SO₂的化学方程式为___________ 。
(2)反应装置图中装置丙、戊间方框内未画出的仪器应选择___________ (填“球形冷凝管”或“直形冷凝管”),如果没有装置戊,可能发生的反应是___________ (写一个即可)。
(3)该实验需控制反应温度60-65℃,则温度不宜过高和过低的原因是___________ ,该实验应采用的加热方式为___________ 。
(4)测定提纯后产品中POCl₃的含量:准确称取1.700g样品在水解瓶中摇动至完全水解,将水解液配成100mL溶液,取10.00mL于锥形瓶中,加入0.2000mol·L⁻¹的AgNO₃溶液20.00mL(发生的反应为Ag⁺+Cl⁻=AgCl↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入指示剂,用0.1000mol·L⁻¹KSCN标准溶液滴定过量的AgNO₃至终点(Ag⁺+SCN⁻=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
①滴定选用的指示剂是___________ (填标号)。
a.酚酞 b.淀粉 c.NH₄Fe(SO4)2 d.甲基橙
②产品中POCl₃的质量分数为___________ %(保留三位有效数字)。
③已知:Ksp(AgCl)=3.2×10⁻10,Ksp(AgSCN)=2×10⁻¹²,若无硝基苯覆盖沉淀表面,测定产品中POCl₃的质量分数将___________ (填“偏大”“偏小”或“无影响”)。
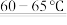 POCl3+SOCl2,制备POCl3并测定产品的含量。
POCl3+SOCl2,制备POCl3并测定产品的含量。
资料卡片:
| 物质 | 熔点/℃ | 沸点/℃ | 有关性质 |
| PCl₃ | -93.6 | 76.1 | 遇水剧烈水解,易与O₂反应 |
| POCl₃ | 1.25 | 105.8 | 遇水剧烈水解,能溶于PCl₃ |
| SOCl₂ | -105 | 78.8 | 遇水剧烈水解,受热易分解 |
(2)反应装置图中装置丙、戊间方框内未画出的仪器应选择
(3)该实验需控制反应温度60-65℃,则温度不宜过高和过低的原因是
(4)测定提纯后产品中POCl₃的含量:准确称取1.700g样品在水解瓶中摇动至完全水解,将水解液配成100mL溶液,取10.00mL于锥形瓶中,加入0.2000mol·L⁻¹的AgNO₃溶液20.00mL(发生的反应为Ag⁺+Cl⁻=AgCl↓),再加少许硝基苯,用力振荡,使沉淀被有机物覆盖。加入指示剂,用0.1000mol·L⁻¹KSCN标准溶液滴定过量的AgNO₃至终点(Ag⁺+SCN⁻=AgSCN↓),做平行实验,平均消耗KSCN标准溶液10.00mL。
①滴定选用的指示剂是
a.酚酞 b.淀粉 c.NH₄Fe(SO4)2 d.甲基橙
②产品中POCl₃的质量分数为
③已知:Ksp(AgCl)=3.2×10⁻10,Ksp(AgSCN)=2×10⁻¹²,若无硝基苯覆盖沉淀表面,测定产品中POCl₃的质量分数将
您最近一年使用:0次
2023-03-21更新
|
410次组卷
|
2卷引用:2023届宁夏回族自治区石嘴山市第三中学高三下学期第三次模拟考试理综试题
名校
解题方法
4 . 无水四氯化锡(SnCl4)是一种用途广泛的化工中间体,常用作媒染剂和有机合成的氯化催化剂。已知:①熔融的金属锡(熔点231℃)在300℃左右能直接与干燥Cl2作用生成无水四氯化锡。②无水四氯化锡是无色易流动的液体,熔点为-33℃,沸点为114.1℃。二氯化锡是无色晶体,熔点为246℃,沸点为652℃。③无水四氯化锡在空气中极易水解,水解产物之一是SnO2·xH2O,并产生白烟。实验室装置如图所示:
请回答下列问题

(1)开始实验前一定要_______ ,仪器a的名称是_______ 。
(2)装置F中球形干燥管内试剂为_______ 。
(3)装置E中冷凝管的作用是_______ 。
(4)若撤去装置C,则D中还可能发生反应的化学方程式为_______ 。
(5)Cl2和锡作用即可生成SnC14,也会生成SnCl2,为减少SnCl2的生成,可采取的措施是_______ 。
(6)得到的产物中常含有杂质SnCl2 ,SnCl2是常用的还原剂。某实验小组用碘氧化法滴定分析产品中杂质SnCl2的质量分数。准确称取a g该样品于锥形瓶,用适量浓盐酸溶解,淀粉溶液作指示剂,c mol/L碘标准溶液滴定至终点,消耗标准液20. 00mL,已知滴定原理是:SnCl2+2HCl+I2=SnC14+2HI,则产品中杂质SnCl2的质量分数为_______ (用含a、c的代数式表示);即使此法测定的操作均正确,但测得的SnCl2含量仍低于实际含量,其原因可能是_______ (用离子方程式表示)。
请回答下列问题

(1)开始实验前一定要
(2)装置F中球形干燥管内试剂为
(3)装置E中冷凝管的作用是
(4)若撤去装置C,则D中还可能发生反应的化学方程式为
(5)Cl2和锡作用即可生成SnC14,也会生成SnCl2,为减少SnCl2的生成,可采取的措施是
(6)得到的产物中常含有杂质SnCl2 ,SnCl2是常用的还原剂。某实验小组用碘氧化法滴定分析产品中杂质SnCl2的质量分数。准确称取a g该样品于锥形瓶,用适量浓盐酸溶解,淀粉溶液作指示剂,c mol/L碘标准溶液滴定至终点,消耗标准液20. 00mL,已知滴定原理是:SnCl2+2HCl+I2=SnC14+2HI,则产品中杂质SnCl2的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 有A、B、C、D四种短周期元素,A元素的气态氢化物分子式为AH4,其中A元素的质量分数为75%,该元素原子核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。
(1)A元素的一种无色透明的单质,名称叫_______ ,其晶体类型是_______ 。
(2)B的氢化物电子式为_______ ,属_______ (填“极性”或“非极性”)分子。
(3)A和B形成化合物的分子空间构型是_______ ,属_______ 分子,其晶体类型是_______ 。
(4)C元素位于周期表中第_______ 周期_______ 族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列_______ (用分子式表示)。
(1)A元素的一种无色透明的单质,名称叫
(2)B的氢化物电子式为
(3)A和B形成化合物的分子空间构型是
(4)C元素位于周期表中第
您最近一年使用:0次
名校
解题方法
6 . 黑木耳中含有丰富的人体所必需的铁元素。某研究小组测定黑木耳中铁元素含量,实验方案如下。回答下列问题:
(1)配制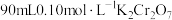 溶液
溶液
①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管外,还有___________ 、___________ 。
②计算,称量:需用天平称量___________ 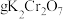 固体(
固体(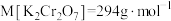 )。
)。
③溶解,恢复到室温、转移、洗涤、定容。
定容的操作是:将蒸馏水注入容量瓶,先___________ ,再改用胶头滴管加水至溶液凹液面最低处与刻度线相切。
④下列操作使结果偏低的是___________ 。
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线 D.未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2+和Fe3+的形式存在)
①“步骤一”中加入过量铜粉的目的是___________ 。
②请配平步骤②中发生反应的离子反应方程式:___________
6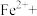 1
1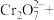 □
□ =□
=□ □
□ □
□ 。
。
③实验测得黑木耳中铁元素的质量分数为___________ 。
(1)配制
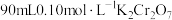 溶液
溶液①选择仪器:所必需的玻璃仪器除烧杯、胶头滴管外,还有
②计算,称量:需用天平称量
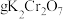 固体(
固体(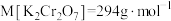 )。
)。③溶解,恢复到室温、转移、洗涤、定容。
定容的操作是:将蒸馏水注入容量瓶,先
④下列操作使结果偏低的是
A.定容时,加水超过刻度线,用胶头滴管吸取多余的液体
B.容量瓶未干燥即用来配制溶液
C.定容时,俯视刻度线 D.未用蒸馏水洗涤烧杯和玻璃棒
(2)测定黑木耳中铁元素含量(已知黑木耳提取液中铁元素以Fe2+和Fe3+的形式存在)
| 步骤一 | 取112g黑木耳,经灼烧、酸浸制得提取液,加入过量的铜粉 |
| 步骤二 | 过滤,向滤液中加入0.10mol/L酸性 溶液10mL时,恰好完全反应 溶液10mL时,恰好完全反应 |
②请配平步骤②中发生反应的离子反应方程式:
6
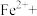 1
1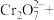 □
□ =□
=□ □
□ □
□ 。
。③实验测得黑木耳中铁元素的质量分数为
您最近一年使用:0次
2022-01-19更新
|
462次组卷
|
5卷引用:宁夏石嘴山第三中学2023-2024学年高三上学期期中考试化学试题
名校
7 . 氧钒(IV)碱式碳酸铵晶体难溶于水,是制备热敏材料VO2的原料,其化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O。实验室以VOCl2和NH4HCO3为原料制备氧钒(IV)碱式碳酸铵晶体的装置如图所示。

已知:+4价钒的化合物易被氧化。回答下列问题:
(1)装置A中饱和NaHCO3的作用是_______ ;上述装置依次连接的合理顺序为e→_______ (按气流方向,用小写字母表示)。
(2)实验开始时,先____ (填实验操作),当B中溶液变浑浊,关闭K1,打开K2,进行实验。
(3)写出装置D中生成氧钒(IV)碱式碳酸铵晶体的化学方程式_________ ;
(4)测定粗产品中钒的含量。实验步骤如下:称量a g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1 KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知: +Fe2++2H+=VO2++Fe3++H2O)
+Fe2++2H+=VO2++Fe3++H2O)
①NaNO2溶液的作用是___________ 。
②粗产品中钒的质量分数表达式为___________ (以VO2计)。
③若滴定前仰视读数,终点时俯视读数,则测定结果___________ (填“偏高”“偏低”或“无影响”)。

已知:+4价钒的化合物易被氧化。回答下列问题:
(1)装置A中饱和NaHCO3的作用是
(2)实验开始时,先
(3)写出装置D中生成氧钒(IV)碱式碳酸铵晶体的化学方程式
(4)测定粗产品中钒的含量。实验步骤如下:称量a g产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1 KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知:
 +Fe2++2H+=VO2++Fe3++H2O)
+Fe2++2H+=VO2++Fe3++H2O)①NaNO2溶液的作用是
②粗产品中钒的质量分数表达式为
③若滴定前仰视读数,终点时俯视读数,则测定结果
您最近一年使用:0次
2022-01-07更新
|
356次组卷
|
4卷引用:宁夏石嘴山市第三中学2022-2023学年高三上学期期中考试化学试题
宁夏石嘴山市第三中学2022-2023学年高三上学期期中考试化学试题湖南省益阳市箴言中学2021-2022学年高三上学期第三次模拟考试(11月)化学试题(已下线)押新高考卷16题 化学实验综合题-备战2022年高考化学临考题号押题(新高考通版)(已下线)专题27 物质制备类综合性实验题(学生版)-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)
8 . 钒是地壳中含量第21丰富元素,是人体必需的微量元素,对治疗糖尿病和癌症及保护心血管等具有潜在的药理学作用。工业上用含三价钒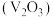 为主的某石煤为原料(含有
为主的某石煤为原料(含有 、CaO等杂质),钙化法焙烧制备
、CaO等杂质),钙化法焙烧制备 ,其流程如下:
,其流程如下:
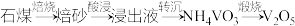
已知:+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
(1)焙烧:向石煤中加生石灰焙烧,将 转化为
转化为 的化学方程式是
的化学方程式是________________ 。
(2)酸浸: 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 ,
, 溶于盐酸的离子方程式是
溶于盐酸的离子方程式是________________ 。
(3)转沉:将浸出液中的钒转化为 固体,其流程如下:
固体,其流程如下:
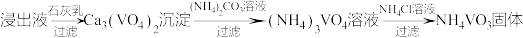
①浸出液中加入石灰乳的作用是____________________________________ 。
②向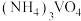 溶液中加入
溶液中加入 溶液,控制溶液的
溶液,控制溶液的 。当
。当 时,
时, 的产量明显降低,原因是
的产量明显降低,原因是_______________________________________ 。
(4)实验室以 为原料还可以合成用于制备
为原料还可以合成用于制备 的氧钒(IV)碱式碳酸铵晶体,过程如下:
的氧钒(IV)碱式碳酸铵晶体,过程如下:
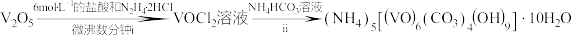
①步骤ⅱ可在如图装置(气密性良好)中进行。已知: 能被
能被 氧化。
氧化。

药品填装完成后的实验操作是________ (填“活塞a”、“活塞b”的操作顺序),装置B中的试剂是________ 。
②测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加 的
的 溶液至稍过量,充分反应后继续加1%
溶液至稍过量,充分反应后继续加1% 溶液至稍过量,再用尿素除去过量的
溶液至稍过量,再用尿素除去过量的 ,最后用
,最后用 的
的 标准溶液滴定至终点,消耗体积为30.00mL(滴定反应:
标准溶液滴定至终点,消耗体积为30.00mL(滴定反应: )。
)。
 溶液的作用是
溶液的作用是________________ ,粗产品中钒的质量分数为________________ (精确到小数点后两位)。
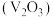 为主的某石煤为原料(含有
为主的某石煤为原料(含有 、CaO等杂质),钙化法焙烧制备
、CaO等杂质),钙化法焙烧制备 ,其流程如下:
,其流程如下: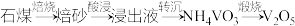
已知:+5价钒在溶液中的主要存在形式与溶液pH的关系如下表。
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 |  |  |  |  |
(1)焙烧:向石煤中加生石灰焙烧,将
 转化为
转化为 的化学方程式是
的化学方程式是(2)酸浸:
 难溶于水,可溶于盐酸。若焙砂酸浸时溶液的
难溶于水,可溶于盐酸。若焙砂酸浸时溶液的 ,
, 溶于盐酸的离子方程式是
溶于盐酸的离子方程式是(3)转沉:将浸出液中的钒转化为
 固体,其流程如下:
固体,其流程如下: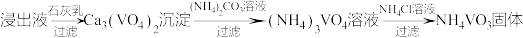
①浸出液中加入石灰乳的作用是
②向
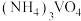 溶液中加入
溶液中加入 溶液,控制溶液的
溶液,控制溶液的 。当
。当 时,
时, 的产量明显降低,原因是
的产量明显降低,原因是(4)实验室以
 为原料还可以合成用于制备
为原料还可以合成用于制备 的氧钒(IV)碱式碳酸铵晶体,过程如下:
的氧钒(IV)碱式碳酸铵晶体,过程如下: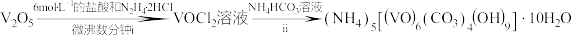
①步骤ⅱ可在如图装置(气密性良好)中进行。已知:
 能被
能被 氧化。
氧化。
药品填装完成后的实验操作是
②测定氧钒(IV)碱式碳酸铵晶体粗产品中钒的含量。
称量4.246g样品于锥形瓶中,用20mL蒸馏水与30mL硫酸混合溶解后,加
 的
的 溶液至稍过量,充分反应后继续加1%
溶液至稍过量,充分反应后继续加1% 溶液至稍过量,再用尿素除去过量的
溶液至稍过量,再用尿素除去过量的 ,最后用
,最后用 的
的 标准溶液滴定至终点,消耗体积为30.00mL(滴定反应:
标准溶液滴定至终点,消耗体积为30.00mL(滴定反应: )。
)。 溶液的作用是
溶液的作用是
您最近一年使用:0次
9 . 下图中A~J均代表无机物或其水溶液,其中A是红色固体,H是生活中常见的液体,J是磁性材料,而B、D、G是单质,B是地壳中含量最高的金属元素,G是气体。根据图示回答问题:
(1)写出下列物质的化学式:A_______ ,I___________ 。
(2)反应②的化学方程式是____________ 。
(3)上述物质D可与硫酸反应生成FeSO4,利用FeSO4可制得一种高效净水剂。方程式如下,若FeSO4和O2的化学计量数之比为2∶1,试配平下列方程式______ :FeSO4+K2O2→K2FeO4+K2O+K2SO4+O2↑。
(4)高铁酸钾(K2FeO4)作为高效的绿色水处理剂,在水中发生反应生成Fe(OH)3,高铁酸钾作为水处理剂发挥的作用是____ 、____ 。
(5)氧化铁是重要工业颜料,用废铁屑制备氧化铁的流程如下:回答下列问题:
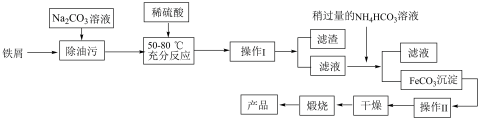
①操作I、Ⅱ的名称分别是_____ 、_________ 。
②加入NH4HCO3溶液后过滤,所得滤液的主要成分是:_________ 。
③写出在空气中煅烧FeCO3的化学方程式________ ;
(6)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定:a.称取2.850g绿矾 (FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为 20.00mL。计算上述样品中FeSO4·7H2O的质量分数为_____ 。

(1)写出下列物质的化学式:A
(2)反应②的化学方程式是
(3)上述物质D可与硫酸反应生成FeSO4,利用FeSO4可制得一种高效净水剂。方程式如下,若FeSO4和O2的化学计量数之比为2∶1,试配平下列方程式
(4)高铁酸钾(K2FeO4)作为高效的绿色水处理剂,在水中发生反应生成Fe(OH)3,高铁酸钾作为水处理剂发挥的作用是
(5)氧化铁是重要工业颜料,用废铁屑制备氧化铁的流程如下:回答下列问题:

①操作I、Ⅱ的名称分别是
②加入NH4HCO3溶液后过滤,所得滤液的主要成分是:
③写出在空气中煅烧FeCO3的化学方程式
(6)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定:a.称取2.850g绿矾 (FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为 20.00mL。计算上述样品中FeSO4·7H2O的质量分数为
您最近一年使用:0次
名校
解题方法
10 . 无水四氯化锡(SnC14)是一种用途广泛的化工中间体,常用作媒染剂和有机合成的氯化催化剂。熔融的金属锡(熔点231℃)在300℃左右能直接与Cl2作用生成无水四氯化锡,实验室装置如图所示:
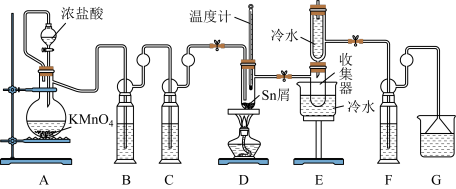
已知信息如下:①将金属锡熔融,通入干燥氯气进行反应,生成四氯化锡。②无水四氯化锡是无色易流动的液体,熔点为一33℃,沸点为114.1℃。二氯化锡是无色晶体,熔点为246℃,沸点为652℃。③无水四氯化锡在空气中极易水解,水解产物之一是SnO2.xH2O,并产生白烟。请回答下列问题:
(l)开始实验前一定要____ ,E中冷水的作用是___ 。
(2)装置F中盛放的最佳试剂为___ ,作用是____ 。
(3)实验时应先打开A处分液漏斗旋塞和整套装置的阀门,待观察到____ 这一现象时,再点燃D处酒精灯。
(4)若撤去装置C,则D中还可能发生反应的化学方程式为__ 。
(5)Cl2和锡作用即可生成SnC14,也会生成SnCl2,为减少SnCl2的生成,可采取的措施是_______ .
(6)得到的产物中常含有杂质SnCl2,SnCl2是常用的还原剂。某实验小组用碘氧化法滴定分析产品中杂质SnCl2的质量分数。准确称取a克该样品于锥形瓶,用适量浓盐酸溶解,淀粉溶液作指示剂,c mol.L-l碘标准溶液滴定至终点,消耗标准液20. 00mL,已知滴定原理是:SnCl2+2HCl+I2=SnC14+2HI,则产品中杂质SnCl2的质量分数为____ (用含a、c的代数式表示);即使此法测定的操作均正确,但测得的SnCl2含量仍低于实际含量,其原因可能是________ (用离子方程式表示)。

已知信息如下:①将金属锡熔融,通入干燥氯气进行反应,生成四氯化锡。②无水四氯化锡是无色易流动的液体,熔点为一33℃,沸点为114.1℃。二氯化锡是无色晶体,熔点为246℃,沸点为652℃。③无水四氯化锡在空气中极易水解,水解产物之一是SnO2.xH2O,并产生白烟。请回答下列问题:
(l)开始实验前一定要
(2)装置F中盛放的最佳试剂为
(3)实验时应先打开A处分液漏斗旋塞和整套装置的阀门,待观察到
(4)若撤去装置C,则D中还可能发生反应的化学方程式为
(5)Cl2和锡作用即可生成SnC14,也会生成SnCl2,为减少SnCl2的生成,可采取的措施是
(6)得到的产物中常含有杂质SnCl2,SnCl2是常用的还原剂。某实验小组用碘氧化法滴定分析产品中杂质SnCl2的质量分数。准确称取a克该样品于锥形瓶,用适量浓盐酸溶解,淀粉溶液作指示剂,c mol.L-l碘标准溶液滴定至终点,消耗标准液20. 00mL,已知滴定原理是:SnCl2+2HCl+I2=SnC14+2HI,则产品中杂质SnCl2的质量分数为
您最近一年使用:0次
2020-04-17更新
|
978次组卷
|
6卷引用:宁夏石嘴山市第三中学2022-2023学年高三上学期期中考试化学试题
宁夏石嘴山市第三中学2022-2023学年高三上学期期中考试化学试题河南省六市2020届高三第一次联合调研监测(全国I卷)理综化学试题河南省六市(南阳市、驻马店市、信阳市、漯河市、周口市、三门峡市)2020届高三第一次模拟调研理科综合化学试题四川省成都石室中学高2020届第三次高考适应性考试理综化学试题(已下线)专题讲座(四) 常见气体的实验室制备、净化和收集(精练)-2022年高考化学一轮复习讲练测(已下线)秘籍20 制备实验-备战2022年高考化学抢分秘籍(全国通用)



