1 . 下列实验设计可以达到实验目的的是
选项 | 实验目的 | 实验设计 |
A | 检验 | 将少量 |
B | 检验待测液中含有 | 用玻璃棒蘸取待测液在无色火焰上灼烧观察现象 |
C | 制备 | 将5~6滴饱和 |
D | 室温下,用pH试纸测定浓度均为0.1mol/L的NaClO溶液和 | 比较HClO和 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 下列“实验结论”与“实验操作及现象”一致的是
| 选项 | 实验操作及现象 | 实验结论 |
| A | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变红 | Fe(NO3)2样品已变质 |
| B | 将HCI通入NaHCO3溶液,产生的气体通入Na2SiO3溶液中产生白色沉淀 | 酸性:H2CO3>H2SiO3 |
| C | 向KI—淀粉溶液中滴加氯水,溶液变成蓝色 | 氧化性:Cl2>I2 |
| D | 某溶液中加入BaCl2溶液,产生白色沉淀,再加入稀盐酸, 沉淀不消失 | 原溶液中一定存在SO |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-07更新
|
201次组卷
|
2卷引用:贵州省思南中学2023-2024学年高三上学期第二次月考化学试题
3 . 下列说法或推理正确的是
| A.将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,溶液变红,则Fe(NO3)2晶体已氧化变质 |
| B.常温下,pH都为11的氢氧化钠溶液和氨水均加水稀释100倍,pH都变为9 |
| C.25℃时,Ksp(BaCO3)>Ksp(BaCrO4),则沉淀水体中的Ba2+选择Na2CrO4比Na2CO3好 |
| D.将CH3CH2Br与NaOH溶液共热,冷却后取出上层溶液,加入AgNO3溶液,产生沉淀,则CH3CH2Br在NaOH溶液中发生了水解 |
您最近一年使用:0次
2016-09-01更新
|
196次组卷
|
5卷引用:2015-2016学年贵州省习水县一中高二下学期期中考试化学试卷
4 . 某兴趣小组为丰富课本所学的SO2性质,设计了下列系列实验:
(1)用下图装置制取并收集SO2以验证其氧化性
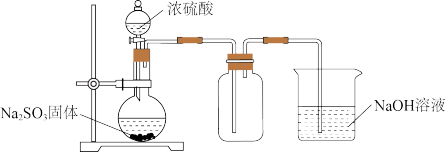
①Na2SO3久置于空气中易变质,体现了Na2SO3具有___________ 性。
②烧杯中NaOH溶液的作用是___________ 。
③若将集气瓶换成盛有Na2S溶液的广口瓶,通气一段时间后产生大量淡黄色浑浊现象,经测定,产物中还有一种相对分子质量为104的酸式盐。则该酸式盐的化学式为___________ 。
(2)用下图装置验证H2SO3比H2CO3酸性强
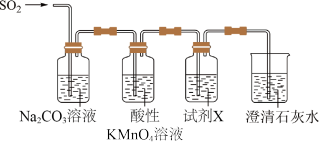
①试剂X是___________ ,其作用是___________ 。
②当观察到___________ ,即证明H2SO3比H2CO3酸性强。
(1)用下图装置制取并收集SO2以验证其氧化性

①Na2SO3久置于空气中易变质,体现了Na2SO3具有
②烧杯中NaOH溶液的作用是
③若将集气瓶换成盛有Na2S溶液的广口瓶,通气一段时间后产生大量淡黄色浑浊现象,经测定,产物中还有一种相对分子质量为104的酸式盐。则该酸式盐的化学式为
(2)用下图装置验证H2SO3比H2CO3酸性强

①试剂X是
②当观察到
您最近一年使用:0次
2020-12-17更新
|
506次组卷
|
4卷引用:贵州省六盘水市六枝特区2021-2022学年高一下学期期中教学质量检测化学试题
名校
解题方法
5 . 铁及其化合物之间的相互转化可用下式表示:Fe2+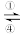 Fe3+
Fe3+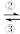 FeO42-(高铁酸根离子)。回答下列有关问题:
FeO42-(高铁酸根离子)。回答下列有关问题:
(1)Fe与过量盐酸反应可以制取FeCl2。若用反应所得的酸性溶液,实现上述①、④的转化,要求产物纯净,可选用__________ (填字母)。
a.Cl2 b.Fe c.Cu d.KMnO4
(2)如下化学方程式中:Fe2O3+3NaClO+4KOH=2K2FeO4(高铁酸钾)+3NaCl+2H2O,还原剂是______________ ,具有__________ 性。
(3)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是___________ 、__________ 。
(4)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在试管Ⅰ中滴入酸性高锰酸钾溶液,在试管Ⅱ中滴入KSCN溶液。
①请你填出该同学实验中出现以下现象时应得出的结论:
②能不能将KMnO4和KSCN滴入到同一试管中进行验证,为什么?试进行解释:________ 。
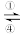 Fe3+
Fe3+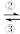 FeO42-(高铁酸根离子)。回答下列有关问题:
FeO42-(高铁酸根离子)。回答下列有关问题:(1)Fe与过量盐酸反应可以制取FeCl2。若用反应所得的酸性溶液,实现上述①、④的转化,要求产物纯净,可选用
a.Cl2 b.Fe c.Cu d.KMnO4
(2)如下化学方程式中:Fe2O3+3NaClO+4KOH=2K2FeO4(高铁酸钾)+3NaCl+2H2O,还原剂是
(3)高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中发生反应生成氢氧化铁胶体。高铁酸钾作为水处理剂发挥的作用是
(4)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在试管Ⅰ中滴入酸性高锰酸钾溶液,在试管Ⅱ中滴入KSCN溶液。
①请你填出该同学实验中出现以下现象时应得出的结论:
| 实验现象 | 试管Ⅰ | 试管Ⅱ | 结论 |
| a | 褪色 | 不变红 | |
| b | 不褪色 | 变红 | |
| c | 褪色 | 变红 |
您最近一年使用:0次
解题方法
6 . 无水FeCl3是常用的芳香烃取代反应的催化剂,它具有易水解、易升华的性质。某同学用干燥铁粉与氯气反应制备无水FeCl3的实验装置如图所示:
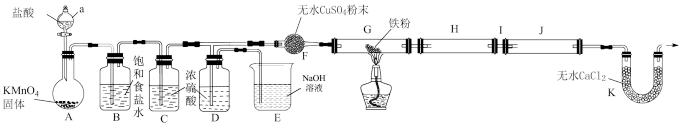
已知:①H装置和J装置用来收集产物;
②D装置的作用是便于观察实验过程中Ⅰ装置处是否出现堵塞。
回答下列问题:
(1)仪器a的名称为___________ 。
(2)实验开始前,先通一会儿氯气,其目的是___________ 。
(3)F装置中无水CuSO4粉末的作用是___________ 。
(4)A装置中发生反应的离子方程式为___________ 。
(5)某同学用11.20 g干燥铁粉制得无水FeCl3样品29.25 g,该次实验的产率为________ 。
(6)实验过程中,某同学发现该实验有不足之处,请提出改进措施:______ 。

已知:①H装置和J装置用来收集产物;
②D装置的作用是便于观察实验过程中Ⅰ装置处是否出现堵塞。
回答下列问题:
(1)仪器a的名称为
(2)实验开始前,先通一会儿氯气,其目的是
(3)F装置中无水CuSO4粉末的作用是
(4)A装置中发生反应的离子方程式为
(5)某同学用11.20 g干燥铁粉制得无水FeCl3样品29.25 g,该次实验的产率为
(6)实验过程中,某同学发现该实验有不足之处,请提出改进措施:
您最近一年使用:0次
解题方法
7 . 化学上常用燃烧法确定有机物的组成,这种方法是在电炉加热下用纯氧氧化管内样品,根据产物的质量确定有机物的组成。本实验是通过A、B装置的质量改变,确定有机物M的组成。
回答下列问题:

(1)装置的连接顺序(从左到右)是_______ (填序号,装置不能重复使用)。
(2)C装置的作用是_______
(3)E装置中反应的化学方程式为_______
(4)F装置(燃烧管)中CuO的作用是_______
(5)本实验中,F装置反应完全后继续通入一段时间O2的目的是_______
(6)若实验中所取纯样品M只含C、H、O三种元素中的两种或三种,M的相对分子质量小于150,准确称取2.44gM,经充分反应后,A管质量增加6.16g,B管质量增加1.08g。
①该样品M的实验式为_______
②能否确定M的分子式_______ (填“能”或“不能”)。
回答下列问题:

(1)装置的连接顺序(从左到右)是
(2)C装置的作用是
(3)E装置中反应的化学方程式为
(4)F装置(燃烧管)中CuO的作用是
(5)本实验中,F装置反应完全后继续通入一段时间O2的目的是
(6)若实验中所取纯样品M只含C、H、O三种元素中的两种或三种,M的相对分子质量小于150,准确称取2.44gM,经充分反应后,A管质量增加6.16g,B管质量增加1.08g。
①该样品M的实验式为
②能否确定M的分子式
您最近一年使用:0次
名校
解题方法
8 . 亚硝酸钠(NaNO2)是一种工业盐,实验室可用如图装置(略去部分夹持仪器)制备。

已知:
① ;
;
② ;
;
③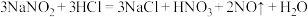 ;
;
④酸性条件下,NO和 都能与
都能与 反应生成
反应生成 和
和 ;
; 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。
(1)加热装置A前,先通一段时间N2,目的是_______ ;
(2)装置A中发生反应的化学方程式为_______ ;
(3)实验结束后,B瓶溶液中溶质的主要成分是_______ (填化学式)。
(4)仪器C中盛放的药品为_______ (填名称)。
(5)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,_______ ,则产物是NaNO2 (注明试剂、现象)。
(6)装置F的作用是_______ ;
(7)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,再向锥形瓶中加入0.1000molL酸性KMnO4溶液20.00mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数_______ 。(写出计算过程)

已知:
①
 ;
;②
 ;
;③
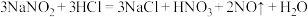 ;
;④酸性条件下,NO和
 都能与
都能与 反应生成
反应生成 和
和 ;
; 能使酸性高锰酸钾溶液褪色。
能使酸性高锰酸钾溶液褪色。(1)加热装置A前,先通一段时间N2,目的是
(2)装置A中发生反应的化学方程式为
(3)实验结束后,B瓶溶液中溶质的主要成分是
(4)仪器C中盛放的药品为
(5)充分反应后,检验装置D中产物的方法是:取产物少许置于试管中,
(6)装置F的作用是
(7)为测定亚硝酸钠的含量,称取4.000g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,再向锥形瓶中加入0.1000molL酸性KMnO4溶液20.00mL,两者恰好完全反应。计算所得固体中亚硝酸钠的质量分数
您最近一年使用:0次
2021-04-28更新
|
449次组卷
|
4卷引用:贵州省贵阳市五校2021-2022学年高三下学期联考(五)理科综合化学试题
9 . 九天揽月探广寒,嫦娥携宝返神舟,我国探月工程取得重大成果。高氯酸铵( )是运载火箭推进剂的重要成分,其在一定条件下分解产生
)是运载火箭推进剂的重要成分,其在一定条件下分解产生 (g)和
(g)和 、
、 、
、 。三种单质气体。
。三种单质气体。
(1)某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,检查装置的气密性,装入试剂,通干燥的惰性气体排尽装置内的空气,将导管末端移入盛满水的试管,通入气体产物。(已知:焦性没食子酸溶液可吸收氧气)
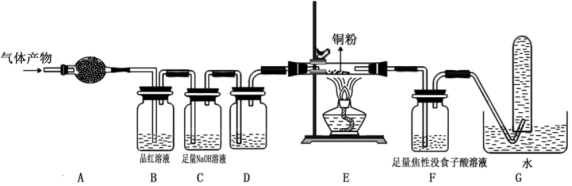
①装置A用于检验分解产物中的 (g),则A中盛放的试剂为
(g),则A中盛放的试剂为_______ 。
②品红溶液的作用是_______ ,E装置硬质玻璃管中的现象是_______ 。
③G装置试管中收集到的气体是_______ 。
(2)研究小组通过甲醛(HCHO)法测定某样品中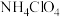 的质量分数。已知:
的质量分数。已知: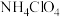 的相对分子质量为117.5;
的相对分子质量为117.5; 与甲醛反应的离子方程式为:
与甲醛反应的离子方程式为:
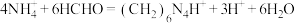
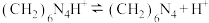
实验步骤:准确称取3.1250g样品溶于水配制成250mL溶液,量取25.00mL样品溶液于锥形瓶中,加入过量中性甲醛溶液(甲醛与NaOH不反应),摇匀、静置5min后,加入1~2滴酚酞试液用0. 1000 NaOH标准溶液滴定至终点,记录数据。重复此操作2次,平均消耗NaOH标准溶液25.00mL。
NaOH标准溶液滴定至终点,记录数据。重复此操作2次,平均消耗NaOH标准溶液25.00mL。
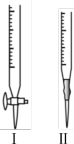
①标准溶液应盛放在下图装置_______ 中(填“Ⅰ”或“Ⅱ”),达到滴定终点的现象是_______ 。
②该样品中 的质量分数为
的质量分数为_______ 。
 )是运载火箭推进剂的重要成分,其在一定条件下分解产生
)是运载火箭推进剂的重要成分,其在一定条件下分解产生 (g)和
(g)和 、
、 、
、 。三种单质气体。
。三种单质气体。(1)某研究小组在实验室设计如下装置检验高氯酸铵分解的产物。该小组连接好装置后,检查装置的气密性,装入试剂,通干燥的惰性气体排尽装置内的空气,将导管末端移入盛满水的试管,通入气体产物。(已知:焦性没食子酸溶液可吸收氧气)

①装置A用于检验分解产物中的
 (g),则A中盛放的试剂为
(g),则A中盛放的试剂为②品红溶液的作用是
③G装置试管中收集到的气体是
(2)研究小组通过甲醛(HCHO)法测定某样品中
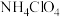 的质量分数。已知:
的质量分数。已知: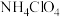 的相对分子质量为117.5;
的相对分子质量为117.5; 与甲醛反应的离子方程式为:
与甲醛反应的离子方程式为: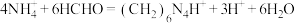
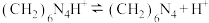
实验步骤:准确称取3.1250g样品溶于水配制成250mL溶液,量取25.00mL样品溶液于锥形瓶中,加入过量中性甲醛溶液(甲醛与NaOH不反应),摇匀、静置5min后,加入1~2滴酚酞试液用0. 1000
 NaOH标准溶液滴定至终点,记录数据。重复此操作2次,平均消耗NaOH标准溶液25.00mL。
NaOH标准溶液滴定至终点,记录数据。重复此操作2次,平均消耗NaOH标准溶液25.00mL。①标准溶液应盛放在下图装置

②该样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
10 . 焦亚硫酸钠(Na2S2O5)是一种常用的食品添加剂,有抗氧化的作用,其生产工艺流程如图所示。
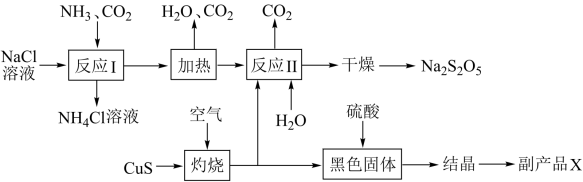
已知:在反应II中,测得水溶液的pH=4.1后停止反应;反应II中的产物经过干燥、加热脱水后可制备得到Na2S2O5固体。
(1)反应I是侯氏制碱法的核心步骤,其具体操作是先向饱和NaCl溶液中通入__ ,请写出反应的化学方程式___ 。
(2)“灼烧”时发生的氧化还原反应中,氧化剂和还原剂的物质的量之比为___ 。
(3)反应II制得的主要产物是__ 。
(4)将生产过程中产生的黑色固体溶于稀硫酸后得到澄清透明的溶液,对该溶液进行__ 、过滤、洗涤等一系列操作后得到副产品X。在整个生产流程中可以循环使用的物质是__ 。
(5)已知Na2S2O5与稀硫酸反应放出SO2其离子方程式为__ 。
(6)由于Na2S2O5具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中的Na2S2O5残留量时,取40mL葡萄酒样品,向其中加入淀粉溶液并用0.02mol/L的碘的标准溶液滴定至终点,消耗碘标准液5mL,滴定终点的现象是__ ,该葡萄酒样品中Na2S2O5的残留量为__ g/L。

已知:在反应II中,测得水溶液的pH=4.1后停止反应;反应II中的产物经过干燥、加热脱水后可制备得到Na2S2O5固体。
(1)反应I是侯氏制碱法的核心步骤,其具体操作是先向饱和NaCl溶液中通入
(2)“灼烧”时发生的氧化还原反应中,氧化剂和还原剂的物质的量之比为
(3)反应II制得的主要产物是
(4)将生产过程中产生的黑色固体溶于稀硫酸后得到澄清透明的溶液,对该溶液进行
(5)已知Na2S2O5与稀硫酸反应放出SO2其离子方程式为
(6)由于Na2S2O5具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中的Na2S2O5残留量时,取40mL葡萄酒样品,向其中加入淀粉溶液并用0.02mol/L的碘的标准溶液滴定至终点,消耗碘标准液5mL,滴定终点的现象是
您最近一年使用:0次

 晶体是否已经氧化变质
晶体是否已经氧化变质 中,滴加几滴KSCN溶液,观察溶液是否变红
中,滴加几滴KSCN溶液,观察溶液是否变红
 胶体
胶体 溶液滴加到煮沸的蒸馏水中,继续煮沸至液体呈红褐色为止
溶液滴加到煮沸的蒸馏水中,继续煮沸至液体呈红褐色为止 溶液的pH
溶液的pH 的酸性强弱
的酸性强弱

