名校
解题方法
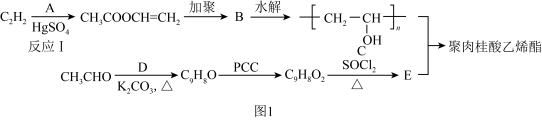
1 . 聚肉桂酸乙烯酯(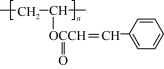 )是我国电子工业制造集成电路和半导体器件不可缺少的产品,其合成路线如图1所示:
)是我国电子工业制造集成电路和半导体器件不可缺少的产品,其合成路线如图1所示:
②
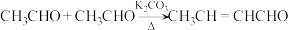 ;
;③
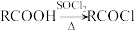 ;
;④
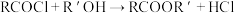 。
。回答下列问题:
(1)有机物A的名称为
(2)B的链节为
(3)C与E反应生成聚肉桂酸乙烯酯的化学方程式为
(4)工业上合成
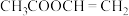 采用反应Ⅰ而不是利用相应的醇与羧酸酯化的原因是
采用反应Ⅰ而不是利用相应的醇与羧酸酯化的原因是(5)如图2所示是实验室中合成
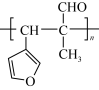 的路线,回答下列问题:
的路线,回答下列问题: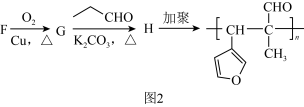
①呋喃( )与苯类似具有芳香性,分子中所有原子均共面且具有
)与苯类似具有芳香性,分子中所有原子均共面且具有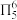 (5中心6电子大
(5中心6电子大 键),则呋喃中氧原子的杂化方式为
键),则呋喃中氧原子的杂化方式为
您最近一年使用:0次
名校
解题方法
2 . 乙炔是一种重要的化工原料,利用乙炔可以合成很多有机物,如下列转化关系: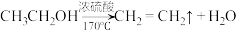
回答下面问题:
(1)写出实验室制备乙炔的化学方程式_______ ;制得的乙炔气体中含有H2S和PH3等气体而有难闻臭味,除去这些杂质气体,可将气体通过盛有_______ (填化学式)溶液的洗气瓶。
(2)有机物A中含有官能团的名称是_______ ,有机物D的结构简式为_______ 。
(3)反应③的反应类型是_______ ,有机物E的结构简式为_______ 。
(4)有机物F的名称为_______ ,其分子中位于同一平面的原子数是_______ 。
(5)写出反应②的化学方程式_______ 。
(6)写出反应⑦的化学方程式_______ 。

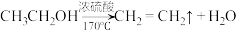
回答下面问题:
(1)写出实验室制备乙炔的化学方程式
(2)有机物A中含有官能团的名称是
(3)反应③的反应类型是
(4)有机物F的名称为
(5)写出反应②的化学方程式
(6)写出反应⑦的化学方程式
您最近一年使用:0次
名校
解题方法
3 . 某课外兴趣小组通过如图所示的流程来制取少量亚硝酸钠晶体( ),并对其进行纯度测定和相关性质的实验。
),并对其进行纯度测定和相关性质的实验。
②NaNO2是白色固体,易被氧化。
(1)生产过程中,SO2从底部通入,硝酸从顶部以雾状喷下,其目的是___________ 。
(2)写出“还原”步骤中生成NO反应的离子方程式___________ 。
(3)若使“吸收”步骤中NO、NO2完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为___________ 。
(4)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取4.000g样品,将其配成500mL溶液。
b.先向锥形瓶内加入40.00ml 0.1000mol·L-1的H2SO4溶液,加热至40~50℃,冷却后再向其中加入12.00ml 0.1500mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与锥形瓶内溶液恰好完全反应,重复三次,平均每次消耗样品溶液40.00mL。求NaNO2晶体的纯度,请写出计算过程___________ 。(保留小数点后2位有效数字)已知: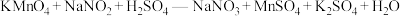 (未配平)。
(未配平)。
 ),并对其进行纯度测定和相关性质的实验。
),并对其进行纯度测定和相关性质的实验。
②NaNO2是白色固体,易被氧化。
(1)生产过程中,SO2从底部通入,硝酸从顶部以雾状喷下,其目的是
(2)写出“还原”步骤中生成NO反应的离子方程式
(3)若使“吸收”步骤中NO、NO2完全转化为NaNO2,则理论上“还原”步骤中SO2与HNO3的物质的量之比为
(4)该课外兴趣小组对实验制取的NaNO2晶体进行纯度测定:
a.称取4.000g样品,将其配成500mL溶液。
b.先向锥形瓶内加入40.00ml 0.1000mol·L-1的H2SO4溶液,加热至40~50℃,冷却后再向其中加入12.00ml 0.1500mol·L-1KMnO4溶液,充分混合。
c.最后用待测的样品溶液与锥形瓶内溶液恰好完全反应,重复三次,平均每次消耗样品溶液40.00mL。求NaNO2晶体的纯度,请写出计算过程
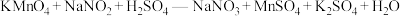 (未配平)。
(未配平)。
您最近一年使用:0次
名校
解题方法
4 . 氯及其部分化合物相关转化如图:
(1)化合物C的分子为 ,各原子最外层均达8电子稳定结构,C与水反应有沉淀和无色刺激性气体产生,写出C与水反应的化学反应方程式:
,各原子最外层均达8电子稳定结构,C与水反应有沉淀和无色刺激性气体产生,写出C与水反应的化学反应方程式:_______ 。
(2)下列有关流程中的说法正确的是_______。
(3)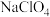 与浓硫酸反应可得
与浓硫酸反应可得 (
(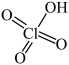 );
); 在液态时存在八元环状结构的双聚体,请画出环状
在液态时存在八元环状结构的双聚体,请画出环状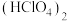 的结构式:
的结构式:_______ 。
(4)工业上利用过量的氨气、 、和乙醛进行气相反应合成异肼
、和乙醛进行气相反应合成异肼 然后使其水解得到肼
然后使其水解得到肼 :理论上生成
:理论上生成 的肼需要消耗
的肼需要消耗
_______ mol。
比较相同温度下,同浓度的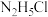 溶液和
溶液和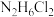 溶液的
溶液的 大小,
大小,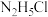
_______ 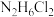 。(填大于、小于、等于或不能确定)
。(填大于、小于、等于或不能确定)
(5)设计实验证明 的碱性比
的碱性比 强
强_______ 。

(1)化合物C的分子为
 ,各原子最外层均达8电子稳定结构,C与水反应有沉淀和无色刺激性气体产生,写出C与水反应的化学反应方程式:
,各原子最外层均达8电子稳定结构,C与水反应有沉淀和无色刺激性气体产生,写出C与水反应的化学反应方程式:(2)下列有关流程中的说法正确的是_______。
A.工业上采用软锰矿(主要成分是 )与浓盐酸混合加热制备 )与浓盐酸混合加热制备 |
B.步骤④中以惰性电极电解制备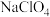 时,另一电极上产生 时,另一电极上产生 |
C.混合物 的物质的量之比可以是 的物质的量之比可以是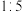 |
D.和1.2-二氯乙烯相似, 分子也存在顺反异构 分子也存在顺反异构 |
(3)
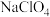 与浓硫酸反应可得
与浓硫酸反应可得 (
( );
); 在液态时存在八元环状结构的双聚体,请画出环状
在液态时存在八元环状结构的双聚体,请画出环状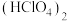 的结构式:
的结构式:(4)工业上利用过量的氨气、
 、和乙醛进行气相反应合成异肼
、和乙醛进行气相反应合成异肼 然后使其水解得到肼
然后使其水解得到肼 :理论上生成
:理论上生成 的肼需要消耗
的肼需要消耗
比较相同温度下,同浓度的
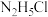 溶液和
溶液和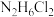 溶液的
溶液的 大小,
大小,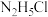
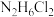 。(填大于、小于、等于或不能确定)
。(填大于、小于、等于或不能确定)(5)设计实验证明
 的碱性比
的碱性比 强
强
您最近一年使用:0次
名校
解题方法
5 .  是主要的大气污染物,必须脱除才能排放。一定条件下,
是主要的大气污染物,必须脱除才能排放。一定条件下, 与
与 反应可转化为无污染物质,某小组在实验室模拟了该过程。
反应可转化为无污染物质,某小组在实验室模拟了该过程。
(1)氨气的制备:___________ 。
②实验室制氨气的化学方程式为___________ 。
③若要制备和收集纯净、干燥的氨气,应该选择如图装置___________ (填序号),其中C中试剂为___________ (填试剂名称)。
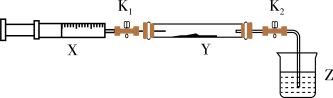
(2)氨气与氮氧化物的反应(已知: 。)
。) 中加入少量催化剂,将
中加入少量催化剂,将 和
和 的混合气体注入
的混合气体注入 管中,关闭
管中,关闭 。
。
②打开 ,将注射器
,将注射器 中的
中的 缓慢注入
缓慢注入 中,此时观察到的现象为
中,此时观察到的现象为___________ ,写出其中一个化学反应方程式___________
③待装置恢复到室温,打开 ,同时向
,同时向 中注入适量空气,试分析注入适量空气的原因
中注入适量空气,试分析注入适量空气的原因___________ 。
④若 氨气恰好能将
氨气恰好能将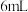 混合气体进行无毒化处理,则混合气体中
混合气体进行无毒化处理,则混合气体中 和
和 的物质的量之比为
的物质的量之比为___________ 。
 是主要的大气污染物,必须脱除才能排放。一定条件下,
是主要的大气污染物,必须脱除才能排放。一定条件下, 与
与 反应可转化为无污染物质,某小组在实验室模拟了该过程。
反应可转化为无污染物质,某小组在实验室模拟了该过程。(1)氨气的制备:
②实验室制氨气的化学方程式为
③若要制备和收集纯净、干燥的氨气,应该选择如图装置
(2)氨气与氮氧化物的反应(已知:
 。)
。)
 中加入少量催化剂,将
中加入少量催化剂,将 和
和 的混合气体注入
的混合气体注入 管中,关闭
管中,关闭 。
。②打开
 ,将注射器
,将注射器 中的
中的 缓慢注入
缓慢注入 中,此时观察到的现象为
中,此时观察到的现象为③待装置恢复到室温,打开
 ,同时向
,同时向 中注入适量空气,试分析注入适量空气的原因
中注入适量空气,试分析注入适量空气的原因④若
 氨气恰好能将
氨气恰好能将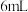 混合气体进行无毒化处理,则混合气体中
混合气体进行无毒化处理,则混合气体中 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
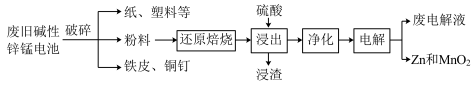
6 . 碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。放电时总反应为: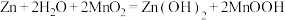 ,从废旧碱性锌锰电池中回收
,从废旧碱性锌锰电池中回收 和
和 的工艺如图:
的工艺如图: 中,
中, 元素的化合价为
元素的化合价为___________ 。
(2)碱性锌锰电池放电时正极的电极反应为___________ 。
(3)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中 、
、 被还原成
被还原成 ),能发生这样反应的主要原因是“粉料”中含有
),能发生这样反应的主要原因是“粉料”中含有___________ (填化学式)。
(4)“浸出”后的溶液中含有的金属阳离子有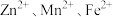 ,写出该过程生成
,写出该过程生成 的离子反应方程式
的离子反应方程式___________ 。
(5) “净化”是为了除去浸出液中的 ,方法为:加入试剂A,再调节
,方法为:加入试剂A,再调节 使
使 完全沉淀。则该步骤中试剂A的主要作用为
完全沉淀。则该步骤中试剂A的主要作用为___________ 。
A.作催化剂 B.作还原剂 C.作氧化剂
(6)“电解”时,控制溶液 值,使电解过程不产生任何气体,写出阳极的电极反应式为
值,使电解过程不产生任何气体,写出阳极的电极反应式为___________ ,当电解回收 的质量为
的质量为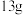 ,理论上能回收
,理论上能回收 的质量为
的质量为___________ 。
(7)本工艺中应循环利用的物质是___________ (填化学式)。
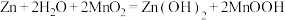 ,从废旧碱性锌锰电池中回收
,从废旧碱性锌锰电池中回收 和
和 的工艺如图:
的工艺如图: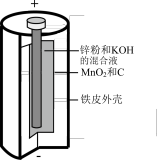
 中,
中, 元素的化合价为
元素的化合价为(2)碱性锌锰电池放电时正极的电极反应为
(3)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中
 、
、 被还原成
被还原成 ),能发生这样反应的主要原因是“粉料”中含有
),能发生这样反应的主要原因是“粉料”中含有(4)“浸出”后的溶液中含有的金属阳离子有
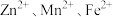 ,写出该过程生成
,写出该过程生成 的离子反应方程式
的离子反应方程式(5) “净化”是为了除去浸出液中的
 ,方法为:加入试剂A,再调节
,方法为:加入试剂A,再调节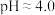 使
使 完全沉淀。则该步骤中试剂A的主要作用为
完全沉淀。则该步骤中试剂A的主要作用为A.作催化剂 B.作还原剂 C.作氧化剂
(6)“电解”时,控制溶液
 值,使电解过程不产生任何气体,写出阳极的电极反应式为
值,使电解过程不产生任何气体,写出阳极的电极反应式为 的质量为
的质量为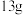 ,理论上能回收
,理论上能回收 的质量为
的质量为(7)本工艺中应循环利用的物质是
您最近一年使用:0次
名校
解题方法
7 . 低碳烯烃(乙烯、丙烯等)作为化学工业重要基本有机化工原料,在现代石油和化学工业中起着举足轻重的作用。碘甲烷 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:
反应Ⅰ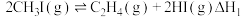
反应Ⅱ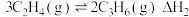
反应Ⅲ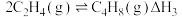
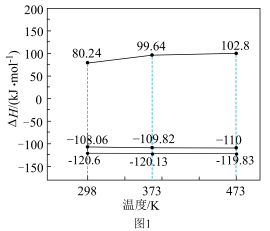
(1)反应Ⅰ、Ⅱ、Ⅲ的 随温度的变化如图1所示。
随温度的变化如图1所示。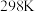 下,
下,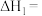
_______ kJ/mol。
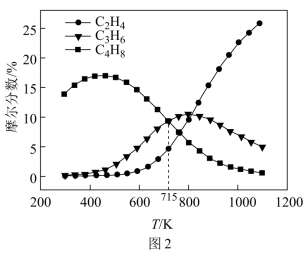
(3)利用计算机模拟反应过程。一定压强条件下,测定反应温度对碘甲烷热裂解制低碳烯烃平衡体系中乙烯、丙烯和丁烯组成的影响如图2所示。结合图1、图2,回答下列问题:_______ 。
A.同一个反应, 会随温度的变化而变,但变化程度不大
会随温度的变化而变,但变化程度不大
B.若 随温度的上升而增大,则
随温度的上升而增大,则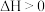
C.随温度升高,反应Ⅱ的化学平衡先正向移动后逆向移动
D.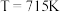 时,反应Ⅱ的平衡常数小于反应Ⅲ
时,反应Ⅱ的平衡常数小于反应Ⅲ
②从图2中可看出,当体系温度高于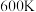 时,乙烯的摩尔分数随温度升高而显著增加,可能的原因是:
时,乙烯的摩尔分数随温度升高而显著增加,可能的原因是:_______ 。
(4)维持温度为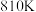 ,压强为
,压强为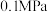 ,起始投料
,起始投料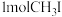 ,测得平衡体系中
,测得平衡体系中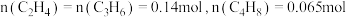 。
。
①平衡时 的物质的量分数
的物质的量分数 为
为_______ 。
②已知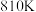 条件下,存在等式
条件下,存在等式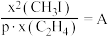 (常数)
(常数)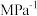 (对于气相反应,用某组分B的平衡压强
(对于气相反应,用某组分B的平衡压强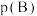 可代替物质的量浓度
可代替物质的量浓度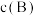 ,如
,如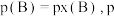 为平衡总压强,
为平衡总压强,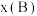 为平衡系统中B的物质的量分数)。保持其它条件不变,请在图3中画出
为平衡系统中B的物质的量分数)。保持其它条件不变,请在图3中画出 与压强
与压强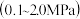 关系的曲线示意图
关系的曲线示意图_______ 。
 热裂解制低碳烯烃的主要反应有:
热裂解制低碳烯烃的主要反应有:反应Ⅰ
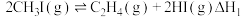
反应Ⅱ
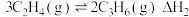
反应Ⅲ
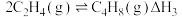
(1)反应Ⅰ、Ⅱ、Ⅲ的
 随温度的变化如图1所示。
随温度的变化如图1所示。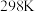 下,
下,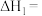
| A.高压 | B.高温 | C.移去 | D.催化剂 |
(3)利用计算机模拟反应过程。一定压强条件下,测定反应温度对碘甲烷热裂解制低碳烯烃平衡体系中乙烯、丙烯和丁烯组成的影响如图2所示。结合图1、图2,回答下列问题:
A.同一个反应,
 会随温度的变化而变,但变化程度不大
会随温度的变化而变,但变化程度不大B.若
 随温度的上升而增大,则
随温度的上升而增大,则
C.随温度升高,反应Ⅱ的化学平衡先正向移动后逆向移动
D.
 时,反应Ⅱ的平衡常数小于反应Ⅲ
时,反应Ⅱ的平衡常数小于反应Ⅲ②从图2中可看出,当体系温度高于
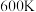 时,乙烯的摩尔分数随温度升高而显著增加,可能的原因是:
时,乙烯的摩尔分数随温度升高而显著增加,可能的原因是:(4)维持温度为
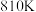 ,压强为
,压强为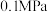 ,起始投料
,起始投料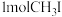 ,测得平衡体系中
,测得平衡体系中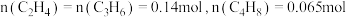 。
。①平衡时
 的物质的量分数
的物质的量分数 为
为②已知
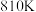 条件下,存在等式
条件下,存在等式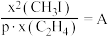 (常数)
(常数)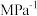 (对于气相反应,用某组分B的平衡压强
(对于气相反应,用某组分B的平衡压强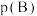 可代替物质的量浓度
可代替物质的量浓度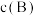 ,如
,如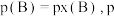 为平衡总压强,
为平衡总压强,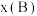 为平衡系统中B的物质的量分数)。保持其它条件不变,请在图3中画出
为平衡系统中B的物质的量分数)。保持其它条件不变,请在图3中画出 与压强
与压强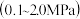 关系的曲线示意图
关系的曲线示意图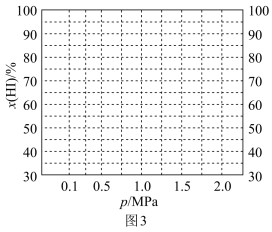
您最近一年使用:0次
名校
解题方法
8 . 甲苯是有机化工的重要原料,其衍生的一系列中间体,广泛用于合成材料工业。某研究小组以甲苯为主要原料,采用以下路线合成治疗面部疮疹的药品泛昔洛韦的中间体 和抗抑郁药物吗氯贝胺:
和抗抑郁药物吗氯贝胺: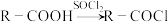 ;
;
(1) 的分子式为
的分子式为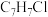 ,且核磁共振氢谱为3组峰,则
,且核磁共振氢谱为3组峰,则 的结构简式为
的结构简式为___________ ;B中所含官能团的名称为___________ 。
(2) 的反应类型是___________(填字母)。
的反应类型是___________(填字母)。
(3)F的结构简式为___________ 。
(4)写出在一定条件下反应 的化学方程式:
的化学方程式:___________ 。
(5) 有多种同分异构体,同时满足下列条件的同分异构体有
有多种同分异构体,同时满足下列条件的同分异构体有___________ 种。
①含有苯环且苯环上有三个取代基;
② 该物质最多能与
该物质最多能与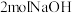 反应。
反应。
(6)根据上述信息,以1-丙醇和丙二酸二乙酯( )为主要原料合成
)为主要原料合成 ,写出合成路线:
,写出合成路线:___________ 。
 和抗抑郁药物吗氯贝胺:
和抗抑郁药物吗氯贝胺:
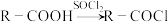 ;
;② 代表
代表 。
。 具有碱性,核磁共振氢谱峰面积之比为
具有碱性,核磁共振氢谱峰面积之比为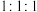 。
。
(1)
 的分子式为
的分子式为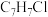 ,且核磁共振氢谱为3组峰,则
,且核磁共振氢谱为3组峰,则 的结构简式为
的结构简式为(2)
 的反应类型是___________(填字母)。
的反应类型是___________(填字母)。| A.聚合反应 | B.氧化反应 | C.取代反应 | D.还原反应 |
(3)F的结构简式为
(4)写出在一定条件下反应
 的化学方程式:
的化学方程式:(5)
 有多种同分异构体,同时满足下列条件的同分异构体有
有多种同分异构体,同时满足下列条件的同分异构体有①含有苯环且苯环上有三个取代基;
②
 该物质最多能与
该物质最多能与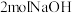 反应。
反应。(6)根据上述信息,以1-丙醇和丙二酸二乙酯(
 )为主要原料合成
)为主要原料合成 ,写出合成路线:
,写出合成路线:
您最近一年使用:0次
9 . 1-丁烯[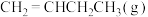 ]为重要的基础化工原料之一,可以利用正丁烷(
]为重要的基础化工原料之一,可以利用正丁烷( )催化脱氢制备,催化脱氢分为无氧催化脱氢和有氧催化脱氢。回答下列问题:
)催化脱氢制备,催化脱氢分为无氧催化脱氢和有氧催化脱氢。回答下列问题:
Ⅰ.无氧催化脱氢反应原理:

(1)已知 、
、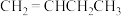 、
、 的燃烧热分别为2878
的燃烧热分别为2878 ,2720
,2720 ,286
,286 ,则
,则
___________  。
。
(2)一定温度下,向1L恒容密闭容器中充入1 mol ,发生上述无氧催化脱氢反应。正丁烷和1-丁烯在平衡时的体积分数与T、p的关系如图所示(图中的压强分别为
,发生上述无氧催化脱氢反应。正丁烷和1-丁烯在平衡时的体积分数与T、p的关系如图所示(图中的压强分别为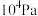 和
和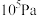 )。
)。___________ (填字母)。
A.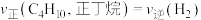 B.混合气体的平均相对分子质量不变
B.混合气体的平均相对分子质量不变
C.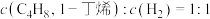 D.容器内气体的总质量保持不变
D.容器内气体的总质量保持不变
②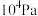 时,表示
时,表示 的曲线是
的曲线是___________ (填图中字母序号,下同),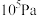 时,表示
时,表示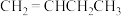 的曲线是
的曲线是___________ 。
Ⅱ.有氧催化脱氢通常选择 或
或 为氧化剂,反应原理如下:
为氧化剂,反应原理如下:
ⅰ.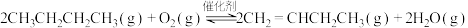
ⅱ.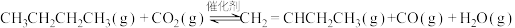
(3)其他条件相同,与无氧脱氢相比,有氧脱氢( 为氧化剂)时,
为氧化剂)时, 的平衡转化率要高一些的可能原因是
的平衡转化率要高一些的可能原因是___________ 。
(4)一定温度和压强下,向初始体积为2L的密闭容器中加入2 mol 、l mol
、l mol  、1 mol
、1 mol  ,同时仅发生反应ⅰ、ⅱ,测得平衡时
,同时仅发生反应ⅰ、ⅱ,测得平衡时 ,体积增大20%,则平衡时
,体积增大20%,则平衡时
①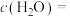
___________  ;
;
②该温度下,反应ⅰ的平衡常数
___________ 。
(5)有氧催化脱氢时,假设上述反应ⅰ和反应ⅱ均有副反应发生。已知 为氧化剂时,
为氧化剂时,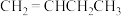 的选择性(生成
的选择性(生成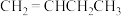 的物质的量与转化的
的物质的量与转化的 的物质的量之比)明显低于
的物质的量之比)明显低于 为氧化剂时的选择性,可能原因是
为氧化剂时的选择性,可能原因是___________ 。
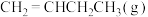 ]为重要的基础化工原料之一,可以利用正丁烷(
]为重要的基础化工原料之一,可以利用正丁烷( )催化脱氢制备,催化脱氢分为无氧催化脱氢和有氧催化脱氢。回答下列问题:
)催化脱氢制备,催化脱氢分为无氧催化脱氢和有氧催化脱氢。回答下列问题:Ⅰ.无氧催化脱氢反应原理:


(1)已知
 、
、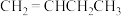 、
、 的燃烧热分别为2878
的燃烧热分别为2878 ,2720
,2720 ,286
,286 ,则
,则
 。
。(2)一定温度下,向1L恒容密闭容器中充入1 mol
 ,发生上述无氧催化脱氢反应。正丁烷和1-丁烯在平衡时的体积分数与T、p的关系如图所示(图中的压强分别为
,发生上述无氧催化脱氢反应。正丁烷和1-丁烯在平衡时的体积分数与T、p的关系如图所示(图中的压强分别为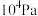 和
和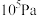 )。
)。
A.
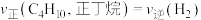 B.混合气体的平均相对分子质量不变
B.混合气体的平均相对分子质量不变C.
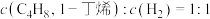 D.容器内气体的总质量保持不变
D.容器内气体的总质量保持不变②
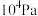 时,表示
时,表示 的曲线是
的曲线是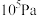 时,表示
时,表示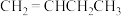 的曲线是
的曲线是Ⅱ.有氧催化脱氢通常选择
 或
或 为氧化剂,反应原理如下:
为氧化剂,反应原理如下:ⅰ.
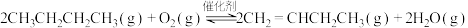
ⅱ.
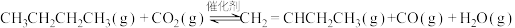
(3)其他条件相同,与无氧脱氢相比,有氧脱氢(
 为氧化剂)时,
为氧化剂)时, 的平衡转化率要高一些的可能原因是
的平衡转化率要高一些的可能原因是(4)一定温度和压强下,向初始体积为2L的密闭容器中加入2 mol
 、l mol
、l mol  、1 mol
、1 mol  ,同时仅发生反应ⅰ、ⅱ,测得平衡时
,同时仅发生反应ⅰ、ⅱ,测得平衡时 ,体积增大20%,则平衡时
,体积增大20%,则平衡时①
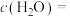
 ;
;②该温度下,反应ⅰ的平衡常数

(5)有氧催化脱氢时,假设上述反应ⅰ和反应ⅱ均有副反应发生。已知
 为氧化剂时,
为氧化剂时,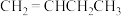 的选择性(生成
的选择性(生成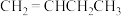 的物质的量与转化的
的物质的量与转化的 的物质的量之比)明显低于
的物质的量之比)明显低于 为氧化剂时的选择性,可能原因是
为氧化剂时的选择性,可能原因是
您最近一年使用:0次
名校
解题方法
10 . 短周期元素在自然界中比较常见,它们的化合物及其合金在社会生活中有着很重要的作用。请回答下列问题:
(1)硫代硫酸盐可用作浸金试剂。硫代硫酸根( )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。
①基态O原子电子占据最高能层符号是___________ 。
② 的空间构型是
的空间构型是___________ 。
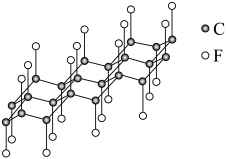
(2)一定条件下,将F原子插入石墨层间可得到具有润清性的层状结构化合物 ,其单层局部结构如图所示:
,其单层局部结构如图所示: 中C原子的杂化方式为
中C原子的杂化方式为___________ 。
(3)一种立方钙钛矿型晶体LaCrO3有两种晶胞结构,其俯视图如下(重叠处仅画出大的微粒),La的配位数均是12。___________ pm;图b晶胞中O的位置为___________ (填“体心”“顶点”“面心”“棱心”);两种晶胞中Cr的配位数是否相同___________ (填“是”或“否”)。
②晶胞经掺杂后能提高红外辐射效率。由图a晶胞堆叠形成的2×2×2超晶胞中一个La原子被Sr代替,则掺杂后晶体化学式___________ 。
(4)磷的含氧酸除了H3PO4以外,还有亚磷酸(H3PO3)等。H3PO3是二元酸,在水中O—H键能断裂解离出 而P—H键不能,从元素性质的角度解释其原因:
而P—H键不能,从元素性质的角度解释其原因:___________ 。
(1)硫代硫酸盐可用作浸金试剂。硫代硫酸根(
 )可看作是
)可看作是 中的一个O原子被S原子取代的产物。
中的一个O原子被S原子取代的产物。①基态O原子电子占据最高能层符号是
②
 的空间构型是
的空间构型是(2)一定条件下,将F原子插入石墨层间可得到具有润清性的层状结构化合物
 ,其单层局部结构如图所示:
,其单层局部结构如图所示: 中C原子的杂化方式为
中C原子的杂化方式为(3)一种立方钙钛矿型晶体LaCrO3有两种晶胞结构,其俯视图如下(重叠处仅画出大的微粒),La的配位数均是12。

②晶胞经掺杂后能提高红外辐射效率。由图a晶胞堆叠形成的2×2×2超晶胞中一个La原子被Sr代替,则掺杂后晶体化学式
(4)磷的含氧酸除了H3PO4以外,还有亚磷酸(H3PO3)等。H3PO3是二元酸,在水中O—H键能断裂解离出
 而P—H键不能,从元素性质的角度解释其原因:
而P—H键不能,从元素性质的角度解释其原因:
您最近一年使用:0次



