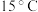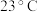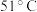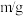名校
解题方法
1 . 现一烧杯中有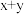 克均匀混合的样品(含x克物质F,y克杂质,杂质既不溶解也不发生任何反应),某化学实验小组对样品组成进行探究,往烧杯内加入一定量的水,下面是精确测量得到的物质F溶解度表与实验记录表(水的蒸发忽略不计),根据下表则下列说法正确的是
克均匀混合的样品(含x克物质F,y克杂质,杂质既不溶解也不发生任何反应),某化学实验小组对样品组成进行探究,往烧杯内加入一定量的水,下面是精确测量得到的物质F溶解度表与实验记录表(水的蒸发忽略不计),根据下表则下列说法正确的是
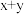 克均匀混合的样品(含x克物质F,y克杂质,杂质既不溶解也不发生任何反应),某化学实验小组对样品组成进行探究,往烧杯内加入一定量的水,下面是精确测量得到的物质F溶解度表与实验记录表(水的蒸发忽略不计),根据下表则下列说法正确的是
克均匀混合的样品(含x克物质F,y克杂质,杂质既不溶解也不发生任何反应),某化学实验小组对样品组成进行探究,往烧杯内加入一定量的水,下面是精确测量得到的物质F溶解度表与实验记录表(水的蒸发忽略不计),根据下表则下列说法正确的是项目/温度t |
|
|
|
|
|
溶解度 | 23.3 | 29.251 | 31.343 | 33.70 | 46.604 |
烧杯剩余固体质量 | 61.464 | 46.5865 | 41.3565 | 35.464 | 5.20 |
A.化学是一门严谨的学科,由于 时物质F是否完全溶解未知,不能严谨地求出x、y具体数值,应再进行 时物质F是否完全溶解未知,不能严谨地求出x、y具体数值,应再进行 的合理实验,若测得m仍为 的合理实验,若测得m仍为 ,才能严谨地求出x、y具体数值 ,才能严谨地求出x、y具体数值 |
B.若物质F是 ,另取 ,另取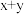 克同种样品与足量稀盐酸反应,生成 克同种样品与足量稀盐酸反应,生成 气体质量约为 气体质量约为 |
C.若用至少含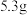 杂质的同种样品另实验,其余操作不变,则 杂质的同种样品另实验,其余操作不变,则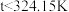 时物质F已完全溶解 时物质F已完全溶解 |
| D.观察上表,可得出物质F在水中的溶解度s随温度t的升高而增大,即s与t近似看成一次函数 |
您最近一年使用:0次
名校
2 . 将 铜镁合金完全溶解于
铜镁合金完全溶解于 某浓度的硝酸中,得到标准状况下
某浓度的硝酸中,得到标准状况下 和
和 的混合气体,向反应后的溶液中加入
的混合气体,向反应后的溶液中加入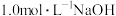 溶液
溶液 ,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为
,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为 。下列说法错误的是
。下列说法错误的是
 铜镁合金完全溶解于
铜镁合金完全溶解于 某浓度的硝酸中,得到标准状况下
某浓度的硝酸中,得到标准状况下 和
和 的混合气体,向反应后的溶液中加入
的混合气体,向反应后的溶液中加入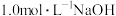 溶液
溶液 ,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为
,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为 。下列说法错误的是
。下列说法错误的是A.该硝酸的物质的量浓度为 |
B.合金中铜与镁的物质的量之比为 |
C.混合气体中 和 和 的体积之比为 的体积之比为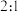 |
D.铜镁合金溶解后,溶液中剩余 的物质的量为 的物质的量为 |
您最近一年使用:0次
2024-01-30更新
|
431次组卷
|
2卷引用:山东省烟台市2023-2024学年高一上学期期末考试化学试题
名校
解题方法
3 . 甲、乙两烧杯中各盛有100mL2mol/L的盐酸和NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后,测得生成的 为n(甲)∶n(乙)=1∶2,则加入铝粉的质量为
为n(甲)∶n(乙)=1∶2,则加入铝粉的质量为
 为n(甲)∶n(乙)=1∶2,则加入铝粉的质量为
为n(甲)∶n(乙)=1∶2,则加入铝粉的质量为
| A.5.4g | B.3.6g | C.2.7g | D.1.8g |
您最近一年使用:0次
名校
解题方法
4 . 某工业废水仅含下表中的某些离子(不考虑水电离产生的 和
和 )。
)。
甲同学欲探究废水的组成,进行如下实验:
Ⅰ.取 溶液,滴加一滴氨水有沉淀生成,且离子种类不变。
溶液,滴加一滴氨水有沉淀生成,且离子种类不变。
Ⅱ.取 溶液加入过量盐酸,无气体和沉淀生成。
溶液加入过量盐酸,无气体和沉淀生成。
Ⅲ.取 溶液,滴加过量
溶液,滴加过量 后,过滤、洗涤、干燥得到
后,过滤、洗涤、干燥得到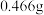 沉淀,滴加足量
沉淀,滴加足量 ,得
,得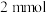 沉淀。
沉淀。
Ⅳ.取 溶液,加入过量
溶液,加入过量 溶液并加热,得到标准状况下
溶液并加热,得到标准状况下 气体。
气体。
请回答下列问题:
(1)以下物质属于电解质的是___________(填字母)。
(2)根据上述信息推断一定存在的阳离子有___________ ,阴离子有___________ 。
(3)实验Ⅰ的现象为___________ 。
(4)实验Ⅲ中发生反应的离子方程式有___________ 、___________ 。
(5)原溶液中浓度最大和最小的离子的物质的量浓度是_______  ,
,_________  。
。
(6)取 溶液,通入
溶液,通入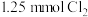 ,对应离子方程式为
,对应离子方程式为___________ 。
 和
和 )。
)。| 阳离子 |  |  |  |  |
| 阴离子 |  |  |  |  |
Ⅰ.取
 溶液,滴加一滴氨水有沉淀生成,且离子种类不变。
溶液,滴加一滴氨水有沉淀生成,且离子种类不变。Ⅱ.取
 溶液加入过量盐酸,无气体和沉淀生成。
溶液加入过量盐酸,无气体和沉淀生成。Ⅲ.取
 溶液,滴加过量
溶液,滴加过量 后,过滤、洗涤、干燥得到
后,过滤、洗涤、干燥得到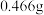 沉淀,滴加足量
沉淀,滴加足量 ,得
,得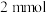 沉淀。
沉淀。Ⅳ.取
 溶液,加入过量
溶液,加入过量 溶液并加热,得到标准状况下
溶液并加热,得到标准状况下 气体。
气体。请回答下列问题:
(1)以下物质属于电解质的是___________(填字母)。
| A.氨气 | B.氨水 | C.液氨 | D.一水合氨 |
(3)实验Ⅰ的现象为
(4)实验Ⅲ中发生反应的离子方程式有
(5)原溶液中浓度最大和最小的离子的物质的量浓度是
 ,
, 。
。(6)取
 溶液,通入
溶液,通入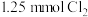 ,对应离子方程式为
,对应离子方程式为
您最近一年使用:0次
名校
解题方法
5 . 某小组通过实验探究氧化还原反应的规律。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
根据表中数据,回答下列问题:
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为_________ (填序号)。
甲. 乙.酸性
乙.酸性 丙.酸性
丙.酸性
(2)结合上述信息思考:对于 、
、 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入_________ ;②加入_________ 。
(3)向等浓度的 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为_________ 。
(4)已知下列四种氧化剂(均可氧化 )对应的还原产物情况如下:
)对应的还原产物情况如下:
请判断,等物质的量的四种氧化剂分别与足量 作用,得到
作用,得到 最多的是
最多的是___________ 。
(5)造纸、印刷等工业废水中含有大量的硫化物(主要成分为 ),可用如图转化方式除去。
),可用如图转化方式除去。
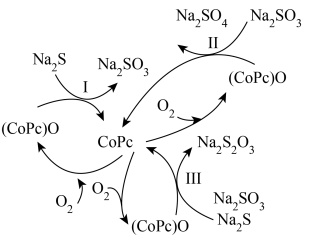
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为___________ 。
②在废水处理整个过程中,催化剂为___________ ,氧化剂为___________ 。
③反应Ⅲ中 与
与 等物质的量反应,写出反应的化学方程式
等物质的量反应,写出反应的化学方程式_________________ 。
已知:氧化还原反应电位传感器可以测量不同溶液的电位值,根据电位值大小可比较物质的氧化性/还原性强弱;数值越大,氧化性越强;数值越小,还原性越强。测得几种物质的电位值如表所示。(注:实验中进行酸化时均用稀硫酸)
| 物质 |  |  (酸化) (酸化) |  (酸化) (酸化) |  |  |  |
| 浓度 | 0.10M(M为物质的量浓度的单位) | |||||
电位值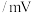 | 171 | 1130 | 603 | 662 | 116 | -361 |
(1)浓度相同的下列三种溶液,氧化性由强到弱的顺序为
甲.
 乙.酸性
乙.酸性 丙.酸性
丙.酸性
(2)结合上述信息思考:对于
 、
、 混合溶液,若控制性氧化
混合溶液,若控制性氧化 而不氧化
而不氧化 ,请提出两种合理的氧化方案:①加入
,请提出两种合理的氧化方案:①加入(3)向等浓度的
 和
和 混合溶液滴加少量酸性
混合溶液滴加少量酸性 溶液(对应还原产物为
溶液(对应还原产物为 ),发生反应的离子方程式为
),发生反应的离子方程式为(4)已知下列四种氧化剂(均可氧化
 )对应的还原产物情况如下:
)对应的还原产物情况如下:| 氧化剂 |  |  |  |  |
| 还原产物 |  |  |  |  |
 作用,得到
作用,得到 最多的是
最多的是(5)造纸、印刷等工业废水中含有大量的硫化物(主要成分为
 ),可用如图转化方式除去。
),可用如图转化方式除去。
①反应Ⅰ和Ⅱ的转移电子数相等时,还原剂物质的量之比为
②在废水处理整个过程中,催化剂为
③反应Ⅲ中
 与
与 等物质的量反应,写出反应的化学方程式
等物质的量反应,写出反应的化学方程式
您最近一年使用:0次
2023-12-04更新
|
404次组卷
|
2卷引用:山东省青岛市莱西市2023-2024学年高一上学期11月期中考试化学试题
6 . 向 和
和 的混合溶液中不断通入
的混合溶液中不断通入 ,溶液中n(含碘的某微粒)和n(含铁的某微粒)随
,溶液中n(含碘的某微粒)和n(含铁的某微粒)随 的变化曲线如图所示。(已知:①
的变化曲线如图所示。(已知:① 可将
可将 氧化成
氧化成 ;②
;②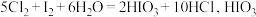 为强酸)下列说法中错误的是
为强酸)下列说法中错误的是

 和
和 的混合溶液中不断通入
的混合溶液中不断通入 ,溶液中n(含碘的某微粒)和n(含铁的某微粒)随
,溶液中n(含碘的某微粒)和n(含铁的某微粒)随 的变化曲线如图所示。(已知:①
的变化曲线如图所示。(已知:① 可将
可将 氧化成
氧化成 ;②
;②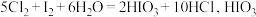 为强酸)下列说法中错误的是
为强酸)下列说法中错误的是
A.还原性: |
B.b点溶液中 |
C.a点时已通入标准状况下氯气的总体积为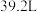 |
D.c点溶液中阴离子的个数为 |
您最近一年使用:0次
2023-12-01更新
|
934次组卷
|
4卷引用:广东省深圳市七校2023-2024学年高一上学期期中联考化学试题
名校
解题方法
7 . 虽然化学反应分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系,回答下列问题:
(1)如图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是______ (填字母)。
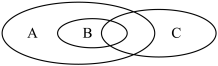
(2)配平化学方程式,并用单线桥法标出电子转移方向和数目________ 。
______H2O+_____Fe(NO3)3+_____SO2=___FeSO4+_____N2O+_____H2SO4
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是_______ (填写化学式)。
(4)配平化学方程式(化学计量数可含x)________ 。
_____Na2Sx+______NaClO+______NaOH=____Na2SO4+_____NaCl+_____H2O
(1)如图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(2)配平化学方程式,并用单线桥法标出电子转移方向和数目
______H2O+_____Fe(NO3)3+_____SO2=___FeSO4+_____N2O+_____H2SO4
(3)向FeCl3和BaCl2的酸性混合溶液中通入SO2气体,有白色沉淀生成,此沉淀是
(4)配平化学方程式(化学计量数可含x)
_____Na2Sx+______NaClO+______NaOH=____Na2SO4+_____NaCl+_____H2O
您最近一年使用:0次
名校
解题方法
8 . 五氧化二钒用作有机化工的催化剂。从废钒催化剂(主要成分为V2O5、V2O4、K2SO4、SiO2、Fe2O3和Al2O3)中回收V2O5,既避免污染环境又有利于资源综合利用,该工艺流程如下:
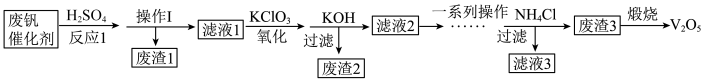
已知:金属钒的氧化物能与酸反应;SiO2不溶于水也不溶于初中常见的酸。回答下列问题:
(1)实验室进行操作Ⅰ时,需要用到的玻璃仪器有漏斗、烧杯和___________ 。
(2)加入KClO3的作用是将VO2+转化为VO ,则该转化过程中钒元素的化合价分别为
,则该转化过程中钒元素的化合价分别为___________ 。
(3)加入KOH的作用之一是保证钒存在于溶液中时,把Fe3+与Al3+转化为沉淀,则“废渣2”的主要成分是___________ 。
(4)滤渣3的成分是偏钒酸铵(NH4VO3)沉淀,煅烧偏钒酸铵(NH4VO3)还有氨气和水生成,写出“煅烧”过程中发生反应的化学方程式:___________ 。
(5)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间关系如下表:
结合上表,在实际生产中,加入氯化铵调节溶液的最佳pH范围为___________ 。

已知:金属钒的氧化物能与酸反应;SiO2不溶于水也不溶于初中常见的酸。回答下列问题:
(1)实验室进行操作Ⅰ时,需要用到的玻璃仪器有漏斗、烧杯和
(2)加入KClO3的作用是将VO2+转化为VO
 ,则该转化过程中钒元素的化合价分别为
,则该转化过程中钒元素的化合价分别为(3)加入KOH的作用之一是保证钒存在于溶液中时,把Fe3+与Al3+转化为沉淀,则“废渣2”的主要成分是
(4)滤渣3的成分是偏钒酸铵(NH4VO3)沉淀,煅烧偏钒酸铵(NH4VO3)还有氨气和水生成,写出“煅烧”过程中发生反应的化学方程式:
(5)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
您最近一年使用:0次
名校
9 . 电芬顿工艺被认为是一种很有应用前景的高级氧化技术,可用于降解去除废水中的持久性有机污染物,其工作原理如图a所示,工作10min时, 、
、 电极产生量(
电极产生量( )与电流强度关系如图b所示:
)与电流强度关系如图b所示:
 、
、 电极产生量(
电极产生量( )与电流强度关系如图b所示:
)与电流强度关系如图b所示: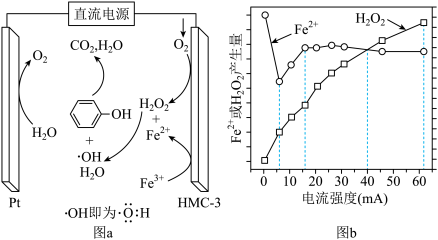
| A.电解一段时间后,Pt电极附近pH减小 |
B.阴极的电极反应有: 、 、 |
| C.根据图b可判断合适的电流强度约为40mA |
D.若处理0.1mol ,理论上HMC-3电极消耗标准状况下31.36LO2 ,理论上HMC-3电极消耗标准状况下31.36LO2 |
您最近一年使用:0次
2023-07-12更新
|
1389次组卷
|
4卷引用:山东省烟台市2022-2023学年高一下学期期末考试化学试题
山东省烟台市2022-2023学年高一下学期期末考试化学试题 福建省厦门双十中学2023-2024学年高二上学期期中考试化学试题浙江省绍兴市第一中学2023-2024学年高三首考模拟考试化学试题(已下线)压轴题06 电化学原理综合分析(方法总结+题型密押+压轴题速练)-2024年高考化学压轴题专项训练(浙江专用)
10 . 将1.95gNa2O2加入水中,反应后配成50mL溶液A,进行如下实验。下列说法错误的是
| 编号 | ① | ② | ③ | ④ |
| 操作 | 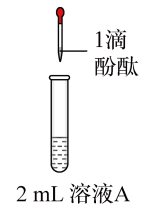 | 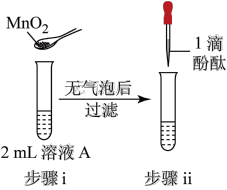 | 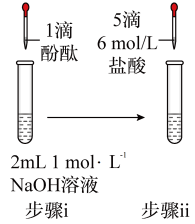 | 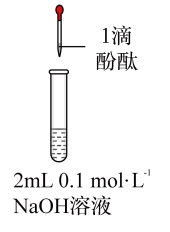 |
| 现象 | 溶液变红色,20秒后褪色 | ⅰ.产生大量使带火星的木条复燃的气体 ⅱ.溶液变红色,10分钟后褪色 | ⅰ.溶液变红色,10分钟后溶液褪色 ⅱ.溶液变红色 | 溶液变红色,2小时后无明显变化 |
| A.由实验可知,Na2O2与水反应有H2O2生成 |
B.②、③溶液褪色与 浓度较大有关 浓度较大有关 |
C.若向①褪色后的溶液中滴加5滴 盐酸,溶液将变红 盐酸,溶液将变红 |
D.若向④中继续滴加 盐酸或 盐酸或 溶液,溶液均可能褪色 溶液,溶液均可能褪色 |
您最近一年使用:0次
2023-07-07更新
|
1115次组卷
|
6卷引用:湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题