名校
解题方法
1 . 杭州支持“人文亚运”的一个重要的体现是坚决反对运动员服用兴奋剂,某种兴奋剂的结构简式如图,有关该物质的说法不正确的是
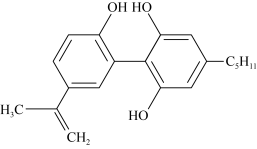
| A.滴入酸性KMnO4溶液,紫色褪去,不可以证明结构中存在碳碳双键 |
| B.1mol该物质与H2(一定条件下)反应时,最多消耗的物质的量为7mol |
| C.该分子中不可能存在手性碳 |
| D.该物质的化学式为C20H24O3 |
您最近一年使用:0次
2 . 就这样等到了傍晚,白风终于伸了个懒腰:“完工啦~”
此时你正趴在床上无所事事,听到这话你迫不及待地爬了起来:“好耶,终于可以出去玩啦~”
“不过,咱们上哪里玩呢?”
“要不……去学校的实验室?”
“好呀~刚好我想折腾药品惹~”
“对了,我们学校的实验室管理有个传统,进去之前要先证明自己的实力。”白风还没说完,他们就被负责的老师给拦在了门口。
“如果你们要进有机实验室,至少先把这个做了。”
(1)完成下列物质的系统命名:

___________ ,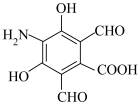
___________ 。
(2)“这瓶钠经历了什么……”看着瓶中已经变质的金属钠,白风皱了皱眉头:“怎么变黄色液体了……?”
实验室的药品摆放都是按照一定分类摆放的,白风在检查“酸”区的时候却意外发现了这样一瓶放错的金属钠:“这瓶钠不应该是单质区的吗?”
好奇之下,他用水稀释了一下黄色液体,然后滴了一滴在pH试纸上。
然后,他看着变红的pH试纸,沉默了……
“查了下资料,这个黄色液体的颜色看着和煤油在空气中变质的样子一样……”你上前戳了戳白风,说道。
白风皱着眉头,在那里思考了半天,忽然一拍脑袋:“我好像知道怎么回事了! ”
Ⅰ.据此推测实验室存放药品采用的分类方法是___________ 。
Ⅱ.试猜测产生这一现象的原因:______________________ 。
此时你正趴在床上无所事事,听到这话你迫不及待地爬了起来:“好耶,终于可以出去玩啦~”
“不过,咱们上哪里玩呢?”
“要不……去学校的实验室?”
“好呀~刚好我想折腾药品惹~”
“对了,我们学校的实验室管理有个传统,进去之前要先证明自己的实力。”白风还没说完,他们就被负责的老师给拦在了门口。
“如果你们要进有机实验室,至少先把这个做了。”
(1)完成下列物质的系统命名:


(2)“这瓶钠经历了什么……”看着瓶中已经变质的金属钠,白风皱了皱眉头:“怎么变黄色液体了……?”
实验室的药品摆放都是按照一定分类摆放的,白风在检查“酸”区的时候却意外发现了这样一瓶放错的金属钠:“这瓶钠不应该是单质区的吗?”
好奇之下,他用水稀释了一下黄色液体,然后滴了一滴在pH试纸上。
然后,他看着变红的pH试纸,沉默了……
“查了下资料,这个黄色液体的颜色看着和煤油在空气中变质的样子一样……”你上前戳了戳白风,说道。
白风皱着眉头,在那里思考了半天,忽然一拍脑袋:“我好像知道怎么回事了! ”
Ⅰ.据此推测实验室存放药品采用的分类方法是
Ⅱ.试猜测产生这一现象的原因:
您最近一年使用:0次
3 . MAX(M代表过渡金属元素,A代表主族元素,X代表碳或氮)相是一类备受关注的新型陶瓷材料。由于独特的层状晶体结构,其具有自润滑、高韧性、可导电等性能,可作为高温结构材料、电极材料和化学防腐材料。某MAX相材料含有Ti、Al、N 3种原子,属六方晶系,Ti原子的堆积方式为 …BACBBCABBACBBCAB…,其中A、B、C都是密置单层。N原子占据所有的正八面体空隙,而Al原子占据一半的三棱柱空隙。如果Ti原子层上下同时接触N和Al原子,则沿着晶胞c轴方向,Al和N原子的投影重合。。
(1)写出该化合物的化学式________ ,及每个正当晶胞中的原子种类和个数________ 。
(2)沿着晶胞c轴方向,画一条同时含有Al和N原子的直线,标出直线上的原子排列________ (无需考虑原子间距离,直线上总原子数不少于10个。Al、Ti、N分别用о, Δ,口表示)。
(3)已知Ti、N原子之间的平均键长为210.0 pm, Ti、Al原子之间的平均键长为281.8 pm,估算晶体的理论密度________ (原子量: Ti:47.87, Al:26.98, N: 14.01, NA=6.02 × 1023 mo-1)。
(4)晶粒尺寸会影响上述材料的性质,所以高温制备时一般通过延长保温时间来增加晶粒尺寸。 判断常温下晶粒生长过程的熵变、焓变和自由能变化的正负________ ,并从化学热力学角度判断常温下该晶粒生长过程是否自发________ 。
(5)以上描述均针对完美晶体。一般情况下,晶粒中会出现缺陷。从热力学角度证明:对于足够大的晶体,出现缺陷是自发的________ 。
(1)写出该化合物的化学式
(2)沿着晶胞c轴方向,画一条同时含有Al和N原子的直线,标出直线上的原子排列
(3)已知Ti、N原子之间的平均键长为210.0 pm, Ti、Al原子之间的平均键长为281.8 pm,估算晶体的理论密度
(4)晶粒尺寸会影响上述材料的性质,所以高温制备时一般通过延长保温时间来增加晶粒尺寸。 判断常温下晶粒生长过程的熵变、焓变和自由能变化的正负
(5)以上描述均针对完美晶体。一般情况下,晶粒中会出现缺陷。从热力学角度证明:对于足够大的晶体,出现缺陷是自发的
您最近一年使用:0次
4 . 血红蛋白(Hb,分子量64000)是运输O2 (g)的载体。每个血红蛋白分子含4个血红素亚基,血红蛋白与氧结合后,便成为氧合血红蛋白Hb(O2)x (x= 1,2,3,4)。 实验表明,1 个血红蛋白分子可结合4个氧分子,其结合常数差别很大,结合第1个氧分子的结合常数最小,结合常数Kc(293.15K) = [ HbO2(aq)]/[ Hb(aq)] [O2(aq)] =6.750×10 kg·mol-1,而结合第4个氧分子的结合常数最大。
293.15K下,O2(g)在血液中溶解的亨利常数k= 8.000×104kPa·kg·mol-1;氧气的摩尔熵 = 204.6 J·K·mol-1; CO2(aq) + H2O(1)= HCO
= 204.6 J·K·mol-1; CO2(aq) + H2O(1)= HCO (aq)+ H+(aq)
(aq)+ H+(aq)  =7.50 kJ·mol-1;CO2(aq)=CO2(g)
=7.50 kJ·mol-1;CO2(aq)=CO2(g)  = 19.40kJ·mol-1;设
= 19.40kJ·mol-1;设 、
、  不随温度变化。
不随温度变化。
(1)在293.15K下,将含有1.000 g Hb的溶液放入一总热容(Cp) 为93.70 J·K-1的等压绝热微量量热计中,当充入足够的氧气后,Hb全部氧合成Hb(O2)4,测得体系温度升高0.028 ℃。计算每摩尔氧的平均结合焓__________ 。
(2) 估算Hb(aq) + O2(g) = HbO2(aq)在293.15 K时的 [HbO2(aq)]-
[HbO2(aq)]-  [Hb(aq)], 简要说明估算误差的来源
[Hb(aq)], 简要说明估算误差的来源__________ 。
(3)为研制一种临床用的二氧化碳气敏电极( 由透气膜、1.0 × 10-2 mol·kg-1的NaHCO3溶液、pH电极和外参比电极组成),某研究人员从理论上探讨了二氧化碳的分压及温度变化对溶液pH的影响。
①计算298.15K下, CO2(g)平衡压力为6.00 kPa和6.66 kPa的电势差值__________ ;
②保持CO2(g)的分压不变,温度升高,写出有关公式并据此说明溶液pH如何变化__________ 。
(4)在肺部的呼吸作用中,氧合血红蛋白的生成速率为r = k[Hb(aq)][O2(aq)]
①计算在海拔6000m的高山上人体血液中氧合血红蛋白的生成速率与海平面的生成速率之比__________ 。设体温为310.15 K,气体均为理想气体。
②有人提出了氧合反应的两个机理请证明下述反应机理何者更合理__________ 。
293.15K下,O2(g)在血液中溶解的亨利常数k= 8.000×104kPa·kg·mol-1;氧气的摩尔熵
 = 204.6 J·K·mol-1; CO2(aq) + H2O(1)= HCO
= 204.6 J·K·mol-1; CO2(aq) + H2O(1)= HCO (aq)+ H+(aq)
(aq)+ H+(aq)  =7.50 kJ·mol-1;CO2(aq)=CO2(g)
=7.50 kJ·mol-1;CO2(aq)=CO2(g)  = 19.40kJ·mol-1;设
= 19.40kJ·mol-1;设 、
、  不随温度变化。
不随温度变化。(1)在293.15K下,将含有1.000 g Hb的溶液放入一总热容(Cp) 为93.70 J·K-1的等压绝热微量量热计中,当充入足够的氧气后,Hb全部氧合成Hb(O2)4,测得体系温度升高0.028 ℃。计算每摩尔氧的平均结合焓
(2) 估算Hb(aq) + O2(g) = HbO2(aq)在293.15 K时的
 [HbO2(aq)]-
[HbO2(aq)]-  [Hb(aq)], 简要说明估算误差的来源
[Hb(aq)], 简要说明估算误差的来源(3)为研制一种临床用的二氧化碳气敏电极( 由透气膜、1.0 × 10-2 mol·kg-1的NaHCO3溶液、pH电极和外参比电极组成),某研究人员从理论上探讨了二氧化碳的分压及温度变化对溶液pH的影响。
①计算298.15K下, CO2(g)平衡压力为6.00 kPa和6.66 kPa的电势差值
②保持CO2(g)的分压不变,温度升高,写出有关公式并据此说明溶液pH如何变化
(4)在肺部的呼吸作用中,氧合血红蛋白的生成速率为r = k[Hb(aq)][O2(aq)]
①计算在海拔6000m的高山上人体血液中氧合血红蛋白的生成速率与海平面的生成速率之比
②有人提出了氧合反应的两个机理请证明下述反应机理何者更合理
| A Hb(aq) + O2(aq)  HbO2 (aq)瞬间达平衡 HbO2 (aq)瞬间达平衡HbO2 (ag) + O2 (aq) 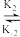 HbO4 (aq)瞬间达平衡 HbO4 (aq)瞬间达平衡HbO4 (aq) + O2(aq) 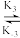 HbO6 (aq)瞬间达平衡 HbO6 (aq)瞬间达平衡HbO6 (aq) + O2 (aq)  HbO8 (aq) HbO8 (aq) |
| B Hb(aq)+O2(aq) 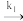 HbO2 (aq) HbO2 (aq)HbO2 (aq) + O2 (aq) 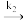 HbO4 (ag) HbO4 (ag)HbO4(aq) + O2 (aq) 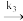 HbO6 (aq) HbO6 (aq)HbO6 (aq) + O2 (aq)  HbO8 (aq) HbO8 (aq) |
您最近一年使用:0次
5 . 化学反应一般是由若干基元反应构成的,所以原则上可由反应机理建立反应的速率方程。在科学研究工作中,往往根据实践经验先假设反应机理,然后再用各种实验方法和手段,检验所设反应机理的正确性。硝酰胺在水溶液中的分解反应为:NO2NH2→N2O(g)+H2O。实验测得其速率方程为: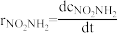 =k
=k
(1)有研究者提出下列3种反应机理,你认为何者是合理的_______ ?并写出k的表达式_______ 。
①NO2NH2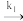 N2O(g)+H2O
N2O(g)+H2O
②NO2NH2+H3O+ NO2NH
NO2NH +H2(瞬间达到平衡)
+H2(瞬间达到平衡)
NO2NH
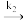 N2O(g)+H3O+(缓慢反应)
N2O(g)+H3O+(缓慢反应)
③NO2NH2+H2O NO2NH-+H3O+(瞬间达到平衡)
NO2NH-+H3O+(瞬间达到平衡)
NO2NH-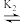 N2O(g)+OH-(缓慢反应)
N2O(g)+OH-(缓慢反应)
H3O++OH-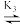 2H2O(快速反应)
2H2O(快速反应)
(2)在实验温度和pH恒定的缓冲介质中,将反应在密闭的容器中进行,测得N2O气体的压力p随时间的变化数据如下表
求NO2NH2分解反应的半衰期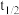
_______ ,并证明lg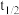 与缓冲介质的pH呈线性关系
与缓冲介质的pH呈线性关系_______ 。
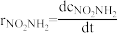 =k
=k
(1)有研究者提出下列3种反应机理,你认为何者是合理的
①NO2NH2
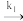 N2O(g)+H2O
N2O(g)+H2O②NO2NH2+H3O+
 NO2NH
NO2NH +H2(瞬间达到平衡)
+H2(瞬间达到平衡)NO2NH

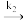 N2O(g)+H3O+(缓慢反应)
N2O(g)+H3O+(缓慢反应)③NO2NH2+H2O
 NO2NH-+H3O+(瞬间达到平衡)
NO2NH-+H3O+(瞬间达到平衡)NO2NH-
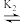 N2O(g)+OH-(缓慢反应)
N2O(g)+OH-(缓慢反应)H3O++OH-
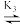 2H2O(快速反应)
2H2O(快速反应)(2)在实验温度和pH恒定的缓冲介质中,将反应在密闭的容器中进行,测得N2O气体的压力p随时间的变化数据如下表
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | ∞ |
| p/kPa | 0 | 6.80 | 12.40 | 17.20 | 20.80 | 24.00 | 40.00 |
求NO2NH2分解反应的半衰期
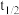
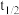 与缓冲介质的pH呈线性关系
与缓冲介质的pH呈线性关系
您最近一年使用:0次
6 . 将 与足量NaOH醇溶液共热,同时发生了两种反应。能证明发生了消去反应的操作与现象是( )
与足量NaOH醇溶液共热,同时发生了两种反应。能证明发生了消去反应的操作与现象是( )
 与足量NaOH醇溶液共热,同时发生了两种反应。能证明发生了消去反应的操作与现象是( )
与足量NaOH醇溶液共热,同时发生了两种反应。能证明发生了消去反应的操作与现象是( )A.反应混合物 溴的颜色褪去 溴的颜色褪去 |
B.反应混合物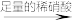 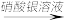 产生白色沉淀 产生白色沉淀 |
C.反应混合物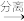 有机物 有机物 紫色褪去 紫色褪去 |
D.反应混合物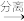 有机物 有机物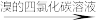 溴的颜色褪去 溴的颜色褪去 |
您最近一年使用:0次
2020-04-03更新
|
190次组卷
|
2卷引用:2018年上海市高中学生化学竞赛(“华理一化工杯”)初赛试题
7 . 实验室里用下图所示仪器和药品制取纯净的无水氯化铁。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长部分未画出,其中⑤、⑥所用为双孔塞,


根据要求回答下列问题:
(1)如果规定气体从左向右流动,上述各仪器装置的正确连接顺序是(填装置的序号):
③→______ →______ →_______ →_______ →_______ 。
(2)装置④的作用是_______________ 。
(3)实验开始时,应首先______________ ;实验结束时,应先熄灭装置__________ 处的酒精灯。该实验条件下生成的氯化铁呈烟状,且易水解,为便于收集,需要在__________ 和__________ (填装置序号)之间增加装置⑦,该装置中烧杯里的液体可以是___________ 。
(4)在装置⑤的烧瓶中,发生反应的化学方程式为__________________ 。
(5)可用离子交换和滴定的方法测定FeCl3的纯度:称取0.68g的FeCl3样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH―的阴离子交换柱,使Cl―和OH―发生交换。交换完成后,流出溶液中的OH―用0.4000 mol/L的盐酸滴定,滴至终点时消耗盐酸30.00 mL。则该样品中FeCl3的质量分数为___________ %。
(6)设计一个简单实验,证明装置①的硬质玻璃管中有少量的铁未能与Cl2发生反应(写出实验操作及相关实验现象)_________________ 。


根据要求回答下列问题:
(1)如果规定气体从左向右流动,上述各仪器装置的正确连接顺序是(填装置的序号):
③→
(2)装置④的作用是
(3)实验开始时,应首先
(4)在装置⑤的烧瓶中,发生反应的化学方程式为
(5)可用离子交换和滴定的方法测定FeCl3的纯度:称取0.68g的FeCl3样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH―的阴离子交换柱,使Cl―和OH―发生交换。交换完成后,流出溶液中的OH―用0.4000 mol/L的盐酸滴定,滴至终点时消耗盐酸30.00 mL。则该样品中FeCl3的质量分数为
(6)设计一个简单实验,证明装置①的硬质玻璃管中有少量的铁未能与Cl2发生反应(写出实验操作及相关实验现象)
您最近一年使用:0次
8 . 下列实验设计中不能达到实验目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 滴入酸性高锰酸钾溶液振荡 | 证明CH2=CH-CHO中含有碳碳双键 |
| B | 用pH剂测定0.1mol/L醋酸溶液的pH | 证明醋酸部分电离 |
| C | 向试管中加入相同体积的0.005mol/L的氯化铁溶液和0.01mol/L的KSCN ,再加入几滴饱和氯化铁溶液 | 证明增大反应物浓度,平衡正向移动 |
| D | 将氨水滴入H2S 溶液中,振荡 | 证明氯和硫的非金属性强弱 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 常温下,用Na2S沉淀 、
、 、
、 、
、 四种金属离子(M2+),所需
四种金属离子(M2+),所需 最低浓度的对数值
最低浓度的对数值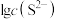 与
与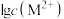 关系如下图所示,下列说法正确的是
关系如下图所示,下列说法正确的是

 、
、 、
、 、
、 四种金属离子(M2+),所需
四种金属离子(M2+),所需 最低浓度的对数值
最低浓度的对数值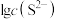 与
与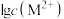 关系如下图所示,下列说法正确的是
关系如下图所示,下列说法正确的是
A.室温时,向ZnS悬浊液中加入ZnSO4固体,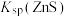 将随之减小 将随之减小 |
B.Na2S溶液中: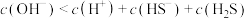 |
| C.为除去MnCl2溶液中混有的少量 CuCl2,可加入适量Na2S固体,充分搅拌后过滤 |
D.向100 mL浓度均为 的 的 、 、 混合溶液中逐滴加入 混合溶液中逐滴加入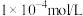 Na2S溶液, Na2S溶液, 先沉淀,证明 先沉淀,证明 |
您最近一年使用:0次
2017-02-17更新
|
586次组卷
|
2卷引用:2017届安徽省示范高中培优联盟高三冬季联赛化学试卷
2011高三·全国·竞赛
10 . NO2和N2O4混合气体的针管实验是高中化学的经典素材。理论估算和实测发现,混合气体体积由V压缩为V/2,温度由298K升至311K。已知这两个温度下N2O4(g) 2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
(1)通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了_______ 倍。
(2)动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?____________ 为什么?_______________
 2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。(1)通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了
(2)动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?
您最近一年使用:0次



