名校
解题方法
1 . 控制、治理氮氧化物对大气的污染是改善大气质量的证要方面。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物( ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
(2)在一密闭容器中发生反应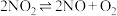 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
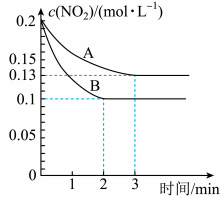
①依曲线A,反应在前3min内氧气的平均反应速率为___________ 。(保留三位有效数字)
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是___________ 。(填“浓度”、“压强”、“温度”或“催化剂”)
③曲线A、B分别对应的反应平衡常数的大小关系是
___________  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
(3)一定温度下,密闭容器中 可发生以下反应:
可发生以下反应:
 I
I
 Ⅱ
Ⅱ
那么反应I的平衡常数表达式为___________ 。假设达平衡时, ,
,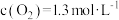 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为___________ , (g)的起始浓度不低于
(g)的起始浓度不低于___________  。
。
(1)火力发电厂的燃煤排烟中含大量的氮氧化物(
 ),可利用甲烷和
),可利用甲烷和 在一条件下反应消除其污染,那么
在一条件下反应消除其污染,那么 与
与 反应的化学方程式为
反应的化学方程式为(2)在一密闭容器中发生反应
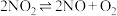 ,反应过程中
,反应过程中 的浓度随时间变化的情况如以下图所示。请回答:
的浓度随时间变化的情况如以下图所示。请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为
②假设曲线A、B分别表示的是该反应在某不同条件下的反应情况,那么此条件是
③曲线A、B分别对应的反应平衡常数的大小关系是

 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)(3)一定温度下,密闭容器中
 可发生以下反应:
可发生以下反应: I
I Ⅱ
Ⅱ那么反应I的平衡常数表达式为
 ,
,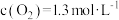 ,那么反应Ⅱ中
,那么反应Ⅱ中 的转化率为
的转化率为 (g)的起始浓度不低于
(g)的起始浓度不低于 。
。
您最近一年使用:0次
2024-04-05更新
|
69次组卷
|
2卷引用:黑龙江省鸡西市新兴实验学校2023-2024学年高三上学期11月期中考试化学试题
2 . 化学反应过程中伴随着能量变化。
(1)下列变化中属于吸热反应的是___________ 。
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③甲烷在氧气中的燃烧反应 ④ 固体溶于水 ⑤
固体溶于水 ⑤ 与
与 反应
反应
其中⑤中发生的化学方程式为___________ 。
(2)有机物M经过太阳光光照可转化成N,转化过程如下:
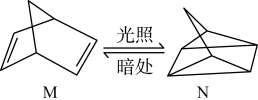
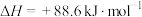 ,则M、N相比,较稳定的是
,则M、N相比,较稳定的是___________ 。
(3)在25℃、101kPa下。液态甲醇( )的燃烧热为726.5kJ/mol,已知:
)的燃烧热为726.5kJ/mol,已知:
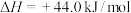 ,写出该条件下甲醇燃烧生成水蒸气的热化学方程式
,写出该条件下甲醇燃烧生成水蒸气的热化学方程式___________ 。
(1)下列变化中属于吸热反应的是
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③甲烷在氧气中的燃烧反应 ④
 固体溶于水 ⑤
固体溶于水 ⑤ 与
与 反应
反应其中⑤中发生的化学方程式为
(2)有机物M经过太阳光光照可转化成N,转化过程如下:

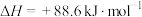 ,则M、N相比,较稳定的是
,则M、N相比,较稳定的是(3)在25℃、101kPa下。液态甲醇(
 )的燃烧热为726.5kJ/mol,已知:
)的燃烧热为726.5kJ/mol,已知:
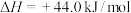 ,写出该条件下甲醇燃烧生成水蒸气的热化学方程式
,写出该条件下甲醇燃烧生成水蒸气的热化学方程式
您最近一年使用:0次
3 . 已知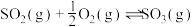 反应过程的能量变化如图所示:
反应过程的能量变化如图所示:

(1)由图可知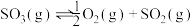 为
为_______ (填“吸热”或“放热”)反应。
(2)E所代表的能量是_______ ;E的大小对该反应的反应热_______ (填“有”或“无”)影响。
(3)请求出反应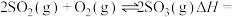
_______  。
。
(4)又知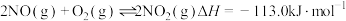 ,请根据题给条件求出反应
,请根据题给条件求出反应 的焓变
的焓变
_______  。
。
(5)25℃、101kP时,11g丙烷( )完全燃烧生成
)完全燃烧生成 和液态水时放出的热量是555.0kJ,则表示丙烷燃烧热的热化学方程式是
和液态水时放出的热量是555.0kJ,则表示丙烷燃烧热的热化学方程式是_______ 。
(6)已知:
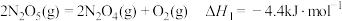 ①
①
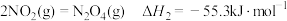 ②
②
则反应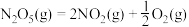 的
的
_______  。
。
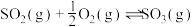 反应过程的能量变化如图所示:
反应过程的能量变化如图所示:
(1)由图可知
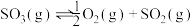 为
为(2)E所代表的能量是
(3)请求出反应
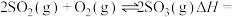
 。
。(4)又知
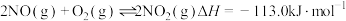 ,请根据题给条件求出反应
,请根据题给条件求出反应 的焓变
的焓变
 。
。(5)25℃、101kP时,11g丙烷(
 )完全燃烧生成
)完全燃烧生成 和液态水时放出的热量是555.0kJ,则表示丙烷燃烧热的热化学方程式是
和液态水时放出的热量是555.0kJ,则表示丙烷燃烧热的热化学方程式是(6)已知:
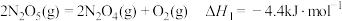 ①
①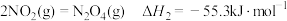 ②
②则反应
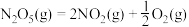 的
的
 。
。
您最近一年使用:0次
名校
4 . 铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,氧化产物为
6SO2+Fe3O4,氧化产物为___________ ,若有3 mol FeS2参加反应,转移___________ mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为___________ 。
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为___________ (用离子方程表示)。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2
 6SO2+Fe3O4,氧化产物为
6SO2+Fe3O4,氧化产物为(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
(3)与明矾相似,硫酸铁也可用作净水剂,其原理为
您最近一年使用:0次
5 . 铅及其化合物用途多样。查资料得知 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:
(1)铅是碳的同族元索,铅原子基态价电子排布式为___________ ,常见价态为_____ 和_____ 。
(2) 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为___________ 。
(3) 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为___________ ; 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为___________ 。
(4) 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即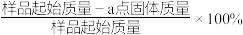 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为___________ 。 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:
①
②
上述过程中 的作用是
的作用是___________ ,请设计实验方案证明 的作用
的作用___________ 。
 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:(1)铅是碳的同族元索,铅原子基态价电子排布式为
(2)
 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为(3)
 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为(4)
 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即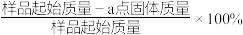 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为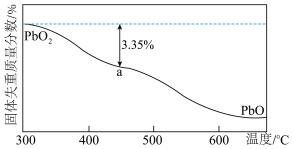
 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:①

②

上述过程中
 的作用是
的作用是 的作用
的作用
您最近一年使用:0次
解题方法
6 . 能量转化装置工作原理与电极材料、电解质溶液等有关。

(1)图甲中涉及反应的离子方程式为_______ ,其能量转化形式为_______ 。
(2)图乙中两电极现象为_______ , 移向
移向_______ (填“Zn”或“Cu”)极。
(3)乙、丙两装置的电池反应相同。丙中X的化学式为_______ ,左烧杯中电解质溶液质量_______ (填“增大”、“减小”或“不变”)。
(4)丁装置中,若电解质溶液为盐酸,则Mg为_______ 极;若电解质溶液为氢氧化钠溶液,则负极的电极反应式为_______ 。

(1)图甲中涉及反应的离子方程式为
(2)图乙中两电极现象为
 移向
移向(3)乙、丙两装置的电池反应相同。丙中X的化学式为
(4)丁装置中,若电解质溶液为盐酸,则Mg为
您最近一年使用:0次
名校
解题方法
7 . 元素化合物知识在化工生产和生活中发挥着重要作用,根据教材知识和题中所给资料完成下列各题
资料Ⅰ:铬元素的常见价态有+6、+3、+2价。在酸性介质中,+6价铬在酸性条件下以 存在,具有强氧化性,在碱性介质中以
存在,具有强氧化性,在碱性介质中以 存在。
存在。
资料Ⅱ:锰元素的常见价态有+7、+6、+4、+3、+2价,Mn2+在酸性溶液中的稳定性强于在碱性溶液中的稳定性。
①在酸性介质中, 具有强氧化性,本身被还原为Mn2+。
具有强氧化性,本身被还原为Mn2+。
②在碱性、中性或微弱酸性溶液中, 仍旧是氧化剂,本身被还原为MnO2。
仍旧是氧化剂,本身被还原为MnO2。
资料Ⅲ:硫代硫酸钠: 俗名海波或大苏打,易溶于水,溶于水后呈碱性。
俗名海波或大苏打,易溶于水,溶于水后呈碱性。
S元素的化合价为+2价,具有还原性,遇酸不稳定发生歧化反应。
过二硫酸钠Na2S2O8中S元素的化合价是+6价,Na2S2O8是一种强氧化剂。
(1)写出Cr3+在酸性环境中被强氧化剂PbO2氧化的离子反应方程式___________ ,写出在碱性溶液中, 可以被H2O2氧化为离子反应方程式
可以被H2O2氧化为离子反应方程式___________ 。
(2)写出向高锰酸钾溶液中滴加H2C2O4溶液的离子反应方程式___________ 。
(3)写出Na2S2O3与盐酸反应的化学方程式___________ 。
(4)1个Na2S2O8中化合价为-2价的氧原子有___________ 个,其阴离子 结构中含有
结构中含有___________ 个过氧键(—O—O—)。
资料Ⅰ:铬元素的常见价态有+6、+3、+2价。在酸性介质中,+6价铬在酸性条件下以
 存在,具有强氧化性,在碱性介质中以
存在,具有强氧化性,在碱性介质中以 存在。
存在。资料Ⅱ:锰元素的常见价态有+7、+6、+4、+3、+2价,Mn2+在酸性溶液中的稳定性强于在碱性溶液中的稳定性。
①在酸性介质中,
 具有强氧化性,本身被还原为Mn2+。
具有强氧化性,本身被还原为Mn2+。②在碱性、中性或微弱酸性溶液中,
 仍旧是氧化剂,本身被还原为MnO2。
仍旧是氧化剂,本身被还原为MnO2。资料Ⅲ:硫代硫酸钠:
 俗名海波或大苏打,易溶于水,溶于水后呈碱性。
俗名海波或大苏打,易溶于水,溶于水后呈碱性。S元素的化合价为+2价,具有还原性,遇酸不稳定发生歧化反应。
过二硫酸钠Na2S2O8中S元素的化合价是+6价,Na2S2O8是一种强氧化剂。
(1)写出Cr3+在酸性环境中被强氧化剂PbO2氧化的离子反应方程式
 可以被H2O2氧化为离子反应方程式
可以被H2O2氧化为离子反应方程式(2)写出向高锰酸钾溶液中滴加H2C2O4溶液的离子反应方程式
(3)写出Na2S2O3与盐酸反应的化学方程式
(4)1个Na2S2O8中化合价为-2价的氧原子有
 结构中含有
结构中含有
您最近一年使用:0次
名校
解题方法
8 . 金属钠及其化合物在人类生产生活中起着重要作用。回答下列问题:
(1)基态Na原子的原子结构示意图表示式为___________ ,在周期表中的位置是___________ 。
(2)Na2O2的电子式为___________ 。Na2O2可作供氧剂,写出Na2O2与CO2反应的化学方程式___________ 。若有1molNa2O2参加反应则转移电子的物质的量为___________ mol。
(3)采用空气和Na为原料可直接制备Na2O2。空气与熔融金属Na反应前需依次通过___________ 、___________ (填序号)。
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应: ___________MnO +___________H++___________Na2O2=___________Mn2++___________O2↑+___________H2O+___________Na+,配平该离子方程式
+___________H++___________Na2O2=___________Mn2++___________O2↑+___________H2O+___________Na+,配平该离子方程式_________ ;该反应说明Na2O2具有___________ 性(选填“氧化”,“还原”或“漂白”)。
(5)天然碱的主要成分为Na2CO3·NaHCO3·2H2O,1molNa2CO3·NaHCO3·2H2O经充分加热得到Na2CO3的质量为___________ g。
(1)基态Na原子的原子结构示意图表示式为
(2)Na2O2的电子式为
(3)采用空气和Na为原料可直接制备Na2O2。空气与熔融金属Na反应前需依次通过
a.浓硫酸 b.饱和食盐水 c.NaOH溶液 d.KMnO4溶液
(4)向酸性KMnO4溶液中加入Na2O2粉末,观察到溶液褪色,发生如下反应: ___________MnO
 +___________H++___________Na2O2=___________Mn2++___________O2↑+___________H2O+___________Na+,配平该离子方程式
+___________H++___________Na2O2=___________Mn2++___________O2↑+___________H2O+___________Na+,配平该离子方程式(5)天然碱的主要成分为Na2CO3·NaHCO3·2H2O,1molNa2CO3·NaHCO3·2H2O经充分加热得到Na2CO3的质量为
您最近一年使用:0次
2023-12-02更新
|
199次组卷
|
2卷引用:黑龙江省哈尔滨市第三十二中学校2023-2024学年高三上学期11月期中考试化学试题
名校
9 . 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入 和空气,其中固体电解质是掺杂了
和空气,其中固体电解质是掺杂了 的
的 固体,它在高温下能传导正极生成的
固体,它在高温下能传导正极生成的 离子(
离子( )。
)。
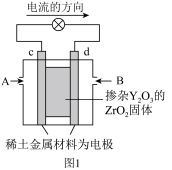
(1)c电极为___________ 极,c电极上的电极反应式为___________ 。
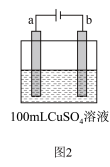
(2)如图2所示为用惰性电极电解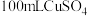 溶液,a电极上的电极反应式为
溶液,a电极上的电极反应式为___________ ;电解一段时间后,a电极产生气体,b电极不产生气体,则溶液的
___________ (填“减小”或“增大”)。
(3)在工业上,利用该电池电解 溶液生产
溶液生产 ,装置如图。
,装置如图。
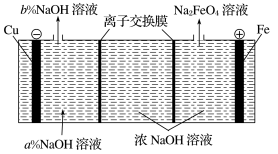
①阳极的电极反应式为___________ 。
②阴极产生的气体为___________ 。
③右侧的离子交换膜为___________ (填“阴”或“阳”)离子交换膜,阴极区a%___________ b%(填“>”“=”或“<”)。
 和空气,其中固体电解质是掺杂了
和空气,其中固体电解质是掺杂了 的
的 固体,它在高温下能传导正极生成的
固体,它在高温下能传导正极生成的 离子(
离子( )。
)。
(1)c电极为
(2)如图2所示为用惰性电极电解
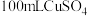 溶液,a电极上的电极反应式为
溶液,a电极上的电极反应式为

(3)在工业上,利用该电池电解
 溶液生产
溶液生产 ,装置如图。
,装置如图。
①阳极的电极反应式为
②阴极产生的气体为
③右侧的离子交换膜为
您最近一年使用:0次
2023-12-01更新
|
298次组卷
|
2卷引用:黑龙江省齐齐哈尔市普高联谊校2023-2024学年高三上学期11月月考化学试题
名校
解题方法
10 . 氮氧化物和硫氧化物的烟气处理关系到人们的身体健康,回答下列问题:
(1)NO用固态活性炭处理后可得到两种无污染的气体,请写出其化学方程式___________ 。
在压强为3.93MPa,200℃时,2L恒容密闭容器中加入0.10molNO和足量活性炭,达平衡时NO浓度为0.020mol/L,两种生成物均为0.030mol,则NO的转化率为___________ ,
___________ 。(保留小数点后两位)。
(2) 、
、 和熔融
和熔融 可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用,则Y为
可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用,则Y为___________ ,熔融 中
中 向
向___________ 极移动(填石墨I或石墨II)。

(3)若烟气主要成分为 、NO,可通过电解法除去,其原理如图所示。阴极的还原产物为
、NO,可通过电解法除去,其原理如图所示。阴极的还原产物为___________ ,阳极的电极反应式为___________ 。

(4)用间接电化学法去除烟气中NO的原理如图所示。

已知阴极室溶液呈酸性,则阴极的电极反应式为___________ 。反应过程中通过质子交换膜的 为2mol时,吸收塔中生成的气体在标准状况下的体积为
为2mol时,吸收塔中生成的气体在标准状况下的体积为___________ L。
(1)NO用固态活性炭处理后可得到两种无污染的气体,请写出其化学方程式
在压强为3.93MPa,200℃时,2L恒容密闭容器中加入0.10molNO和足量活性炭,达平衡时NO浓度为0.020mol/L,两种生成物均为0.030mol,则NO的转化率为

(2)
 、
、 和熔融
和熔融 可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用,则Y为
可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用,则Y为 中
中 向
向
(3)若烟气主要成分为
 、NO,可通过电解法除去,其原理如图所示。阴极的还原产物为
、NO,可通过电解法除去,其原理如图所示。阴极的还原产物为
(4)用间接电化学法去除烟气中NO的原理如图所示。

已知阴极室溶液呈酸性,则阴极的电极反应式为
 为2mol时,吸收塔中生成的气体在标准状况下的体积为
为2mol时,吸收塔中生成的气体在标准状况下的体积为
您最近一年使用:0次



