1 . 完成下列问题。
(1)如图表示在密闭容器中反应: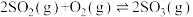 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b过程中改变的条件可能是
达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b过程中改变的条件可能是______ ;b→c过程中改变的条件可能是______ ;若增大压强时,反应速度变化情况画在c~d处______ 。 、4.5mol
、4.5mol ,经10min后反应达平衡时有3mol
,经10min后反应达平衡时有3mol 发生了反应。试填写下列空格:
发生了反应。试填写下列空格:
① 的转化率为
的转化率为______ 。
②平衡常数K为______ 。
(1)如图表示在密闭容器中反应:
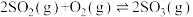 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b过程中改变的条件可能是
达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a→b过程中改变的条件可能是
 、4.5mol
、4.5mol ,经10min后反应达平衡时有3mol
,经10min后反应达平衡时有3mol 发生了反应。试填写下列空格:
发生了反应。试填写下列空格:①
 的转化率为
的转化率为②平衡常数K为
您最近一年使用:0次
2 . 根据短周期元素的性质回答下列问题。
I. 有较强的配位能力,许多金属离子都可以与
有较强的配位能力,许多金属离子都可以与 形成稳定的配合。反应
形成稳定的配合。反应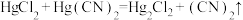 用于制备
用于制备 。
。
(1)上述反应的氧化剂是_______ 。
(2)写出 的结构简式
的结构简式_______ , 的空间构型是
的空间构型是_______ ;1mol 分子中
分子中 键为
键为_______ mol。
(3) 被称为拟卤素,性质与卤素相似,写出
被称为拟卤素,性质与卤素相似,写出 与氢氧化钠溶液反应的离子方程式
与氢氧化钠溶液反应的离子方程式_______ 。
(4)基态N价层电子排布式为_______ 。
Ⅱ.氟化镁( )晶胞是长方体,其结构如图所示
)晶胞是长方体,其结构如图所示 晶胞示意图中○表示
晶胞示意图中○表示_______ (填离子符号)。
(6)结合离子结构示意图,解释离子半径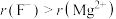 的原因
的原因_______ 。
(7) 晶胞中有
晶胞中有_______ 个 ;
;_______ 个 。
。
I.
 有较强的配位能力,许多金属离子都可以与
有较强的配位能力,许多金属离子都可以与 形成稳定的配合。反应
形成稳定的配合。反应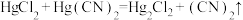 用于制备
用于制备 。
。(1)上述反应的氧化剂是
(2)写出
 的结构简式
的结构简式 的空间构型是
的空间构型是 分子中
分子中 键为
键为(3)
 被称为拟卤素,性质与卤素相似,写出
被称为拟卤素,性质与卤素相似,写出 与氢氧化钠溶液反应的离子方程式
与氢氧化钠溶液反应的离子方程式(4)基态N价层电子排布式为
Ⅱ.氟化镁(
 )晶胞是长方体,其结构如图所示
)晶胞是长方体,其结构如图所示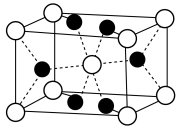
 晶胞示意图中○表示
晶胞示意图中○表示(6)结合离子结构示意图,解释离子半径
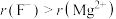 的原因
的原因(7)
 晶胞中有
晶胞中有 ;
; 。
。
您最近一年使用:0次
3 . 类别万千的酸碱溶液共同构筑了化学世界的丰富多彩。
(1)现有常温下pH=2的盐酸(甲)、pH=2的醋酸溶液(乙)和0.1mol/LNH3∙H2O(丙),请根据下列操作回答:
①常温下,将丙溶液加水稀释,下列数值一定变小的是_____ (填字母)。
A. B.
B. C.
C.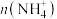 D.
D.
②常温下,取甲、乙各1mL分别稀释至100mL,稀释后,水的电离程度:乙_____ 甲(填“>”“<”或“=”)。
(2)①某温度时,测得0.01mol/LNaOH溶液pH为11,则该温度_____ 25℃。(填“>”“<”或“=”)
②相同条件下,取等体积、等pH的Ba(OH)2、NaOH和NH3∙H2O三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为 、
、 、
、 ,则三者的大小关系为
,则三者的大小关系为_____ 。
(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
①将SO2通入氨水中,当c(OH-)降至1.0×10-7mol∙L-1时,溶液中的 =
=_____ 。
②下列微粒在溶液中不能大量共存的是_____ 。
A. 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、
(1)现有常温下pH=2的盐酸(甲)、pH=2的醋酸溶液(乙)和0.1mol/LNH3∙H2O(丙),请根据下列操作回答:
①常温下,将丙溶液加水稀释,下列数值一定变小的是
A.
 B.
B. C.
C.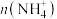 D.
D.
②常温下,取甲、乙各1mL分别稀释至100mL,稀释后,水的电离程度:乙
(2)①某温度时,测得0.01mol/LNaOH溶液pH为11,则该温度
②相同条件下,取等体积、等pH的Ba(OH)2、NaOH和NH3∙H2O三种碱溶液,分别滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为
 、
、 、
、 ,则三者的大小关系为
,则三者的大小关系为(3)已知:在25℃,有关弱电解质的电离平衡常数如下表有下表:
| 弱电解质 | H2SO3 | H2CO3 | HClO | NH3∙H2O |
| 电离平衡常数 | 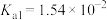  |   | 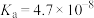 |  |
 =
=②下列微粒在溶液中不能大量共存的是
A.
 、
、 B.
B. 、
、 C.
C. 、
、 D.
D. 、
、
您最近一年使用:0次
4 . 完成下列问题。
(1)合成氨反应常使用铁触媒提高反应速率。如图为有、无铁触媒时,反应的能量变化示意图。写出该反应的热化学方程式
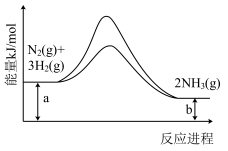
(2)已知
 与
与 、
、 的反应在溶液中存在以下平衡:
的反应在溶液中存在以下平衡: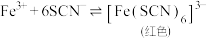 K1
K1
 K2
K2
向溶液Ⅱ中加入NaF后,溶液颜色由红色转变为无色。若该反应是可逆反应,其离子方程式为
(3)
 的除去
的除去方法1(双碱法):用NaOH吸收 ,并用CaO使NaOH再生:NaOH溶液
,并用CaO使NaOH再生:NaOH溶液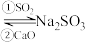 溶液。
溶液。
写出过程①的离子方程式:
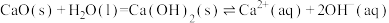 ,从平衡移动的角度,简述过程②NaOH再生的原理
,从平衡移动的角度,简述过程②NaOH再生的原理方法2:用氨水除去
已知25℃, 的
的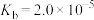 ,
, 的
的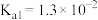 ,
,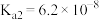 。若氨水的浓度为0.2
。若氨水的浓度为0.2 ,溶液中的
,溶液中的
 。将
。将 通入该氨水中,当
通入该氨水中,当 降至
降至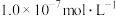 时,溶液中的
时,溶液中的
您最近一年使用:0次
解题方法
5 . 氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mo)为元素周期表中原子序数依次增大的同族元素。回答下列问题:
(1)砷在元素周期表中的位置
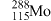 的中子数为
的中子数为已知:
P(s,白磷)=P(s,黑磷) 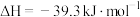 ;
;
P(s,白磷)=P(s,红磷) 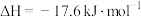 ;
;
由此推知,其中最稳定的磷单质是
(2)氮和磷氢化物性质的比较:
热稳定性:

沸点:
 。
。
(3)
 和
和 与卤化氢的反应相似,产物的结构和性质也相似。下列对
与卤化氢的反应相似,产物的结构和性质也相似。下列对 与HI反应产物的推断正确的是
与HI反应产物的推断正确的是a.不能与NaOH反应 b.含离子键、共价键 c.其溶液显碱性
(4)
 能发生较强烈的水解,生成难溶的SbOCl,因此,配制
能发生较强烈的水解,生成难溶的SbOCl,因此,配制 溶液应注意
溶液应注意(5)解释碳酸钠溶液显碱性的原因
您最近一年使用:0次
6 . 海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是_______ (填序号)。
(2)海带中含有碘元素。实验室提取碘的步骤如图所示:

①海带灰中含有硫酸镁、碳酸钠等,在实验步骤_______ (填序号)中实现与碘分离。
②写出步骤④反应的离子方程式_______ 。提取碘的过程中,不能选择乙醇代替CCl4提取碘单质的原因_______ 。
(1)无需经过化学变化就能从海水中获得的物质是
| A.食盐 | B.溴 | C.烧碱 | D.纯碱 |

①海带灰中含有硫酸镁、碳酸钠等,在实验步骤
②写出步骤④反应的离子方程式
您最近一年使用:0次
解题方法
7 . 回答下列问题:
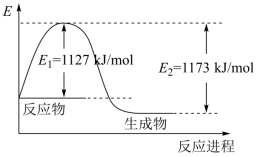
(1)已知A2(g)和B2(g)反应生成1molAB3(g)过程中能量变化如图所示。根据下列已知键能数据计算A-B键键能为_______ kJ/mol。
(2)在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和反应的反应热。
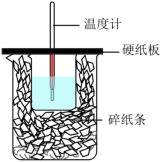
①甲同学用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过计算得到△H=-54.8kJ•mol-1,该结果与△H=-57.3kJ•mol-1有偏差,产生此偏差的原因可能是_______ (填字母)。
A.用温度计测量盐酸起始温度后直接测量NaOH溶液的温度
B.一次性把NaOH溶液倒入盛有盐酸的小烧杯中
C.实验装置保温、隔热效果差
②若改用60mL0.50mol•L-1盐酸与60mL0.55mol•L-1NaOH溶液进行反应,与②中实验相比,所放出的热量_______ (填“相等”或“不相等”);若用50mL0.50mol•L-1CH3COOH溶液代替盐酸进行②中实验,测得反应前后温度的变化值_______ (填“偏大”“偏小”或“不受影响”)。
(1)已知A2(g)和B2(g)反应生成1molAB3(g)过程中能量变化如图所示。根据下列已知键能数据计算A-B键键能为

| 化学键 | A-A | B-B |
| 键能(kJ/mol) | 946 | 436 |

①甲同学用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液进行中和反应,通过计算得到△H=-54.8kJ•mol-1,该结果与△H=-57.3kJ•mol-1有偏差,产生此偏差的原因可能是
A.用温度计测量盐酸起始温度后直接测量NaOH溶液的温度
B.一次性把NaOH溶液倒入盛有盐酸的小烧杯中
C.实验装置保温、隔热效果差
②若改用60mL0.50mol•L-1盐酸与60mL0.55mol•L-1NaOH溶液进行反应,与②中实验相比,所放出的热量
您最近一年使用:0次
解题方法
8 . 铁及其化合物与生产、生活关系密切
(1)生铁(以赤铁矿为例)是通过高炉冶炼而得,用化学方程式表示其原理为__________
(2)在钢铁厂的生产中,炽热的铁水注入模具之前,必须对模具进行充分的干燥处理,不得留有水,原因是__________ (用化学方程式表示)
(3)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
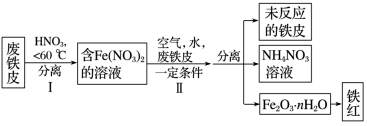
①步骤Ⅰ若要检验是否有Fe3+生成,方法是__________
②步骤Ⅱ中发生反应: ,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,能体现“绿色化学”思想的是
,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,能体现“绿色化学”思想的是__________ (任写一项)。
(4) Fe2O3可制取新型、高效水处理剂高铁酸钾K2FeO4
______ Fe2O3+______NaClO+______KOH ______ K2FeO4(高铁酸钾)+ _____NaCl+_____H2O
______ K2FeO4(高铁酸钾)+ _____NaCl+_____H2O
①K2FeO4中铁元素的化合价__________ ;配平上述反应__________ 。此过程中氧化剂是__________ (填化学式)。
②高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中反应生成氢氧化铁胶体。高铁酸钾作为水处理剂的作用是__________ 、__________ 。
(1)生铁(以赤铁矿为例)是通过高炉冶炼而得,用化学方程式表示其原理为
(2)在钢铁厂的生产中,炽热的铁水注入模具之前,必须对模具进行充分的干燥处理,不得留有水,原因是
(3)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:

①步骤Ⅰ若要检验是否有Fe3+生成,方法是
②步骤Ⅱ中发生反应:
 ,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,能体现“绿色化学”思想的是
,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,能体现“绿色化学”思想的是(4) Fe2O3可制取新型、高效水处理剂高铁酸钾K2FeO4
______ Fe2O3+______NaClO+______KOH
 ______ K2FeO4(高铁酸钾)+ _____NaCl+_____H2O
______ K2FeO4(高铁酸钾)+ _____NaCl+_____H2O①K2FeO4中铁元素的化合价
②高铁酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,在水中反应生成氢氧化铁胶体。高铁酸钾作为水处理剂的作用是
您最近一年使用:0次
9 . 25℃时, 的
的 和
和 各
各 分别加水稀释,
分别加水稀释, 随溶液体积变化如图所示。
随溶液体积变化如图所示。
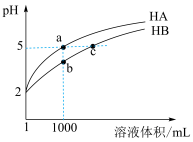
(1)属于强酸的是___________ 。
(2)溶液中的总酸量:a点___________ b点(填“>”或“<”)。
(3) 的电离程度:b点
的电离程度:b点___________ c点(填“>”或“<”)。
(4)将a点与b点两溶液同时升高温度,则 的值将
的值将___________ (填“增大”或“减小”)。
(5)常温下,若将HB溶液加水稀释则 的值将
的值将___________ (填“增大”“减小”或“无法判断”);若向
 的
的 溶液中逐滴滴入
溶液中逐滴滴入 的
的 溶液,所得溶液
溶液,所得溶液 及导电能力变化如图,则
及导电能力变化如图,则 两点水的电离程度:b
两点水的电离程度:b___________ c(填“>”“<”或“=”)。

(6)往 溶液中滴加
溶液中滴加 溶液至混合溶液显中性,则溶液中
溶液至混合溶液显中性,则溶液中
___________ 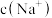 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(7)若已知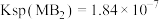 ,当
,当 离子完全沉淀时(即
离子完全沉淀时(即 离子浓度
离子浓度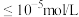 ),至少需要的
),至少需要的 离子浓度是
离子浓度是___________  (结果保留三位有效数字)。(已知
(结果保留三位有效数字)。(已知 )
)
 的
的 和
和 各
各 分别加水稀释,
分别加水稀释, 随溶液体积变化如图所示。
随溶液体积变化如图所示。
(1)属于强酸的是
(2)溶液中的总酸量:a点
(3)
 的电离程度:b点
的电离程度:b点(4)将a点与b点两溶液同时升高温度,则
 的值将
的值将(5)常温下,若将HB溶液加水稀释则
 的值将
的值将
 的
的 溶液中逐滴滴入
溶液中逐滴滴入 的
的 溶液,所得溶液
溶液,所得溶液 及导电能力变化如图,则
及导电能力变化如图,则 两点水的电离程度:b
两点水的电离程度:b
(6)往
 溶液中滴加
溶液中滴加 溶液至混合溶液显中性,则溶液中
溶液至混合溶液显中性,则溶液中
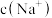 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(7)若已知
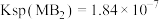 ,当
,当 离子完全沉淀时(即
离子完全沉淀时(即 离子浓度
离子浓度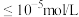 ),至少需要的
),至少需要的 离子浓度是
离子浓度是 (结果保留三位有效数字)。(已知
(结果保留三位有效数字)。(已知 )
)
您最近一年使用:0次
解题方法
10 . 研究 对节能减排有重要意义,回答下列问题:
对节能减排有重要意义,回答下列问题:
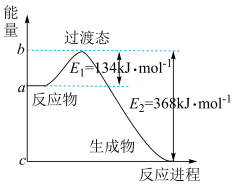
(1)如图是 和
和 反应生成
反应生成 和
和 过程中能量变化示意图,请写出
过程中能量变化示意图,请写出 和
和 反应的热化学方程式:
反应的热化学方程式:___________ ,若反应中转移了 ,则参加反应的
,则参加反应的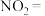
___________ g。
(2)已知反应: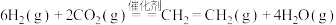 ,温度对
,温度对 的平衡转化率和催化剂催化效率的影响如图所示:
的平衡转化率和催化剂催化效率的影响如图所示:
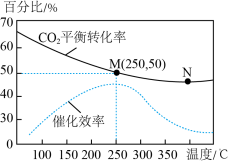
①此反应正反应为___________ 反应。
②化学平衡常数: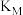
___________  (填“>”或“<”)。
(填“>”或“<”)。
③若初始投料比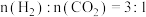 ,则图中
,则图中 点的乙烯体积分数约为
点的乙烯体积分数约为___________ 。
④ 时,
时,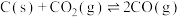 的平衡常数
的平衡常数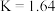 ,此反应的
,此反应的
___________ 0(填“>”或“<”),相同条件下测得高炉内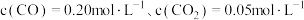 ,此时反应向
,此时反应向___________ (填“正”或“逆”)方向进行。
 对节能减排有重要意义,回答下列问题:
对节能减排有重要意义,回答下列问题:
(1)如图是
 和
和 反应生成
反应生成 和
和 过程中能量变化示意图,请写出
过程中能量变化示意图,请写出 和
和 反应的热化学方程式:
反应的热化学方程式: ,则参加反应的
,则参加反应的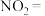
(2)已知反应:
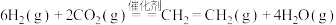 ,温度对
,温度对 的平衡转化率和催化剂催化效率的影响如图所示:
的平衡转化率和催化剂催化效率的影响如图所示:
①此反应正反应为
②化学平衡常数:
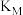
 (填“>”或“<”)。
(填“>”或“<”)。③若初始投料比
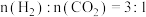 ,则图中
,则图中 点的乙烯体积分数约为
点的乙烯体积分数约为④
 时,
时,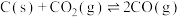 的平衡常数
的平衡常数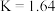 ,此反应的
,此反应的
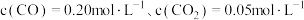 ,此时反应向
,此时反应向
您最近一年使用:0次



