名校
解题方法
1 . 我国科学家使用双功能催化剂催化水煤气变换反应:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH<0,在低温下获得高转化率与高反应速率,反应过程示意图如下,下列说法正确的是


| A.过程Ⅰ、过程Ⅱ均为放热过程 |
| B.图中显示:起始时的2个H2O都参与了反应过程 |
| C.过程Ⅲ只生成了极性共价键 |
| D.使用催化剂降低了水煤气变换反应的ΔH |
您最近一年使用:0次
2022-05-16更新
|
371次组卷
|
15卷引用:【市级联考】四川省攀枝花市2019届高三下学期第三次统考理科综合化学试题
【市级联考】四川省攀枝花市2019届高三下学期第三次统考理科综合化学试题(已下线)专题07 化学反应中的能量变化——2019年高考真题和模拟题化学分项汇编2019年湖南省郴州市高三第一次教学质量监测化学试题2020届高三《新题速递·化学》1月第02期(考点01-06)北京市通州区2020届高三上学期期末摸底考试化学试题北京市2020届高三下学期周末测试化学试题河南省顶级名校2021届高三年级上学期期中考试化学试题第34届(2021年)高中化学奥林匹克竞赛浙江省预赛试题广东省佛山市第一中学2019-2020学年高一下学期第一次段考化学试题甘肃省嘉峪关市第一中学2021届高三下学期六模考试理综化学试题山西省潞城第一中学2020-2021学年高二下学期3月月考化学试卷题福建省莆田第一中学2020-2021学年高二下学期期中考试化学试题宁夏银川市第二中学2021-2022学年高二下学期期中考试化学试题天津市第二南开学校2022-2023学年度高二上学期期中质量调查化学试题上海财经大学附属中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
2 . 把一块镁铝合金(质量为m g)投入到50 mL 1 mol/L的HCl溶液里,待合金完全溶解后,再往溶液里加入1 mol/L的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积变化的关系如图所示。下列说法中正确的是
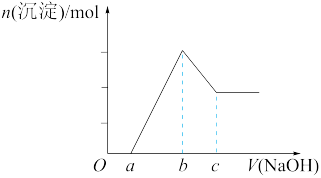

| A.整个反应过程中,主要发生了6个离子反应 |
| B.c值越大,合金中Mg的含量越高 |
| C.b值越大,合金中Al的含量越高 |
| D.根据图象判断,镁铝合金与50 mL 1 mol/L的HCl溶液恰好完全反应 |
您最近一年使用:0次
2021-12-04更新
|
751次组卷
|
8卷引用:江西省南昌市第二中学2018届高三上学期第三次月考化学试题
3 . 硫酸及其化合物在生产生活中有重要的应用,而硫氧化物是常见的大气污染物。
(1)已知: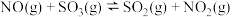
 ,一种可同时脱除
,一种可同时脱除 和
和 的工艺涉及的反应原理及能量变化如下:
的工艺涉及的反应原理及能量变化如下:
Ⅰ: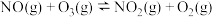
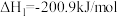
Ⅱ: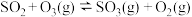
 ,
,
_______ 。
(2)接触法制H2SO4生产中的关键工序是SO2的催化氧化,回答下列问题:
①在V2O5作催化剂条件下SO2(g)与O2(g)反应历程如下:
Ⅰ:_______;
Ⅱ: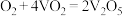
写出第Ⅰ步反应的化学方程式_______ 。
②一定温度下,在2 L的恒容密闭容器中通入4 molSO2(g)和2 mol O2(g)发生反应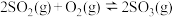 ,5 min后达平衡状态,压强为原来的
,5 min后达平衡状态,压强为原来的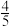 ,从开始到平衡,用SO3(g)表示化学反应速率为
,从开始到平衡,用SO3(g)表示化学反应速率为_______ ,O2的平衡转化率为_______ 。
③若保持反应温度和容器容积不变,对于2SO2(g)+O2(g) 2SO3(g)
2SO3(g)  ,下列可以作为该反应达到平衡判据的有
,下列可以作为该反应达到平衡判据的有_______ (填标号)。
A.气体的压强保持不变
B.2v正(SO2)=v逆(O2)
C. 保持不变
保持不变
D.容器内气体的密度保持不变
E.容器内气体的平均相对分子质量保持不变
④在 时,起始压强为
时,起始压强为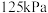 的恒温恒压条件下,平衡时SO3(g)的体积分数随起始投料
的恒温恒压条件下,平衡时SO3(g)的体积分数随起始投料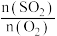 的变化如下图所示,则
的变化如下图所示,则
_______ ,用平衡压强(该物质的体积分数×总压强)代替平衡浓度,则500℃时,该反应的Kp=_______ 。

(1)已知:
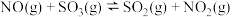
 ,一种可同时脱除
,一种可同时脱除 和
和 的工艺涉及的反应原理及能量变化如下:
的工艺涉及的反应原理及能量变化如下:Ⅰ:
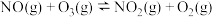
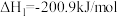
Ⅱ:
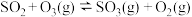
 ,
,
(2)接触法制H2SO4生产中的关键工序是SO2的催化氧化,回答下列问题:
①在V2O5作催化剂条件下SO2(g)与O2(g)反应历程如下:
Ⅰ:_______;
Ⅱ:
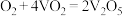
写出第Ⅰ步反应的化学方程式
②一定温度下,在2 L的恒容密闭容器中通入4 molSO2(g)和2 mol O2(g)发生反应
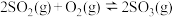 ,5 min后达平衡状态,压强为原来的
,5 min后达平衡状态,压强为原来的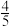 ,从开始到平衡,用SO3(g)表示化学反应速率为
,从开始到平衡,用SO3(g)表示化学反应速率为③若保持反应温度和容器容积不变,对于2SO2(g)+O2(g)
 2SO3(g)
2SO3(g)  ,下列可以作为该反应达到平衡判据的有
,下列可以作为该反应达到平衡判据的有A.气体的压强保持不变
B.2v正(SO2)=v逆(O2)
C.
 保持不变
保持不变D.容器内气体的密度保持不变
E.容器内气体的平均相对分子质量保持不变
④在
 时,起始压强为
时,起始压强为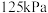 的恒温恒压条件下,平衡时SO3(g)的体积分数随起始投料
的恒温恒压条件下,平衡时SO3(g)的体积分数随起始投料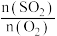 的变化如下图所示,则
的变化如下图所示,则

您最近一年使用:0次
2021-10-10更新
|
398次组卷
|
7卷引用:湖北省荆州市2021届高三上学期第一次质量检查化学试题
湖北省荆州市2021届高三上学期第一次质量检查化学试题江西省赣州市赣县第三中学2022-2023学年高三上学期(奥赛班)强化训练化学试题(已下线)重点8 化学反应原理的综合应用-2021年高考化学专练【热点·重点·难点】(已下线)押山东卷第18题 化学反应原理综合题-备战2021年高考化学临考题号押题(山东卷)广西名校大联考2022届高三上学期第一次大联考(入学摸底考试)化学试题江西省景德镇市景德镇一中2022届高三10月月考化学试题河南省驻马店市第一高级中学2021-2022学年高二上学期期中考试化学试题
名校
4 . 下面三个晶体结构示意图中,具有相同点阵型式的是
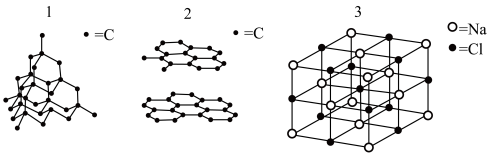
| A.1与2 | B.2与3 | C.1与3 | D.1,2与3 |
您最近一年使用:0次
2021-08-13更新
|
163次组卷
|
2卷引用:第27届(2013年)全国高中学生化学竞赛(安徽赛区)初赛试题
5 . 下列表述中正确的是
| A.在恒压下,凡是自发的过程一定是放热的 |
| B.因为焓是状态函数,而恒压反应的焓变等于恒压反应热,所以热也是状态函数 |
C.单质的 和 和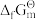 都为零 都为零 |
| D.在恒温恒压条件下,封闭体系自由能减少的过程是自发过程 |
您最近一年使用:0次
2021-08-13更新
|
256次组卷
|
2卷引用:第30届( 2016年)全国中学生化学竞赛(安徽赛区)初赛试题
名校
6 . 氨硼烷(NH3BH3)是一种储氢量较高的储氢材料,室温下是一种无色分子晶体,可与水发生催化脱氢反应生成NH4BO2和H2.少量氨硼烷可以由硼烷(B2H6)和NH3合成。下列有关说法不正确的是
| A.元素N的第一电离能高于同周期相邻元素的第一电离能 |
| B.催化脱氢反应中,H2既是还原产物、又是氧化产物 |
| C.0.1 mol NH3BH3发生催化脱氢反应,可生成6.72L H2 (标准状况) |
| D.B2H6和NH3合成NH3BH3的反应为氧化还原反应,NH3 是还原剂 |
您最近一年使用:0次
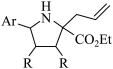
7 . 某生物碱M的立体选择性合成方法如图:
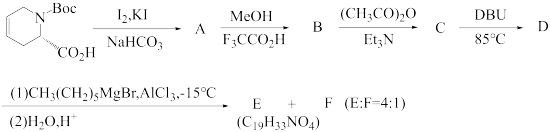

(1)画出上述合成路线中化合物A-M的立体结构式_____ 。
(2)请说明产物E比F多的原因______ 。
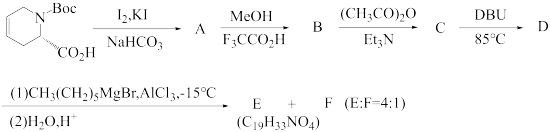

(1)画出上述合成路线中化合物A-M的立体结构式
(2)请说明产物E比F多的原因
您最近一年使用:0次
解题方法
8 . 丙烯与过量的乙醛在酸催化及低于70°C条件下反应生成化合物1,如果丙烯与乙醛的摩尔比为1:1且反应温度高于70°C,则主要产物为2,4-戊二醇(化合物3)和3-戊烯-2-醇(化合物4)。进一步研究表明,化合物1,3,4的生成经过相同的关键中间体2(|C5H11O|+)。
CH3CH=CH2 + CH3CHO(过量)

(1)请用反应机理解释产物1,3,4 的生成过程______ ;并指出关键中间体2的构造式______ 。
(2)化合物5在Lewis酸O3ReOSiPh3催化下与苯甲醛反应得到化合物6:
 + Ph-CHO
+ Ph-CHO

在O3ReOSiPh3催化下化合物7转化为8(C14H18O2),而7的异构体9则转化为10(C28H36O4)。

请画出6、8和10的构造式________ 。
(3)化合物11经下列反应生成14:
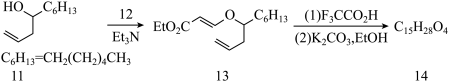
①请画出化合物12,14的构造式_____ 及构型为(2S,4S,6S)-14的最稳定构象式______ 。
② 化合物13如用TiCl4处理,则得到含氯的产物15(C15H27ClO3), 请画出15的构造式_______ 。
(4)画出下列反应的主要产物16的构造式_______ 。
 +R'CHO
+R'CHO 16
16
CH3CH=CH2 + CH3CHO(过量)


(1)请用反应机理解释产物1,3,4 的生成过程
(2)化合物5在Lewis酸O3ReOSiPh3催化下与苯甲醛反应得到化合物6:
 + Ph-CHO
+ Ph-CHO

在O3ReOSiPh3催化下化合物7转化为8(C14H18O2),而7的异构体9则转化为10(C28H36O4)。

请画出6、8和10的构造式
(3)化合物11经下列反应生成14:

①请画出化合物12,14的构造式
② 化合物13如用TiCl4处理,则得到含氯的产物15(C15H27ClO3), 请画出15的构造式
(4)画出下列反应的主要产物16的构造式
 +R'CHO
+R'CHO 16
16
您最近一年使用:0次
9 . 六亚甲基四胺(HMTA)是一个与金刚烷的结构类似的杂环多面体化合物。广泛应用于有机合成,染料和医药等工业中。HMTA晶体是一、种电光材料,其折射率可被外电场改变,在激光技术中具有广泛应用。该晶体属于立方晶系,正当晶胞参数a=7.02 × l02pm。晶体结构的正视图分别如图A和图B所示,其中图B是沿a方向的投影。

(1)画出HMTA分子的结构图_____ ,说明其最高对称轴的名称、方位和数目_____ 。
(2)①指出HMTA晶体中作周期性重复的最小结构单元_____ ;说明1个正当晶胞中有多少个这样的结构单元______ 。
②写出该晶体最高对称轴的名称或记号、方向,以及特征对称元素的名称和取向_______ 。
(3)晶体的宏观对称性与构成该晶体的分子的对称性是否完全相同?从下列物质中选择实例说明:_____ HMTA、CO2、 (NH2)2CO、 Fe(C5H5)2、 C6H6、 C60
(4)①指出HMTA晶体的点阵型式_____ ;说明该点阵的轴次最高的对称轴及其方向_____ 。
②假设图6-A所示的正当晶胞中心的分子取向不同于顶点的分子,晶体的点阵型式是什么_____
③计算每个正当晶胞中C- H…N氢键的数目______ 。
④从结构化学角度简述该晶体格外稳定的原因______ 。
(5)计算HMTA晶体的密度ρ______ 。

(1)画出HMTA分子的结构图
(2)①指出HMTA晶体中作周期性重复的最小结构单元
②写出该晶体最高对称轴的名称或记号、方向,以及特征对称元素的名称和取向
(3)晶体的宏观对称性与构成该晶体的分子的对称性是否完全相同?从下列物质中选择实例说明:
(4)①指出HMTA晶体的点阵型式
②假设图6-A所示的正当晶胞中心的分子取向不同于顶点的分子,晶体的点阵型式是什么
③计算每个正当晶胞中C- H…N氢键的数目
④从结构化学角度简述该晶体格外稳定的原因
(5)计算HMTA晶体的密度ρ
您最近一年使用:0次
10 . 酸性溶液中Ce(IV)是一种强氧化剂,被用于定量分析和有机合成等领域。
(1)尽管水溶液中Ce4+强烈水解,但在高酸度溶液([HClO4]>6.05 mol·kg-1)中Ce4+仍然会发生反应: Ce4++e-⇌Ce3+。高氯酸溶液中Ce4+与OH-形成4种配合物的累积生成常数的对数分别为lgβ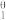 = 14.76、lgβ
= 14.76、lgβ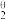 = 28.04、lgβ
= 28.04、lgβ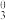 = 40.53、lgβ
= 40.53、lgβ = 51.86,有关物质的标准摩尔生成吉布斯自由能
= 51.86,有关物质的标准摩尔生成吉布斯自由能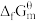 列于表5-1。
列于表5-1。
表5-1物质的标准摩尔生成吉布斯自由能(298.15K)
①写出Ce4+水解反应的一般表达式______ 、 标准水解平衡常数的一般表达式_____ 。
②写出Ce4+与OH-形成配合物反应的一般表达式_____ 、标准累计生成常数β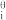 的一般表达式
的一般表达式______ 。
③求Ce4+水解反应生成的4种氢氧化物的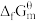
______ 。
④当pH<8, Ce3+不水解。当HClO4浓度<6.05 mol·kg-1时,Ce4+/Ce3+电对的电位是溶液的pH、Ce(IV)配合物的β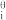 、有关物种浓度的函数,试导出这一函数关系
、有关物种浓度的函数,试导出这一函数关系________ 。
(2)在HClO4溶液中,Ce4+/Cc3 电对的电位与温度的关系如图所示。

根据图示指出,当HClO4浓度大于或小于1.85 m时,Ce4+被还原成Ce3+的反应的熵变ΔS大于0、等于0或小于0______ ,并说明反应焓变ΔH的相应变化情况______ 。
(3)采用分光光度法研究了高氯酸中Ce(IV)对有机物ATF的氧化反应。所有动力学测试都在准一级条件下进行,即ATF的浓度大大过量于[Ce(IV)]。研究发现,Ce(IV)氧化ATF的反应对Ce(IV)的分级数为一级,求得的表观一级速率常数k 表列于表5-2.该反应的化学计量反应式为:
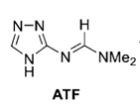 +2Ce(IV)+2H2O。→
+2Ce(IV)+2H2O。→ + CO2 + HNMe2 + 2C(III) + 2H+
+ CO2 + HNMe2 + 2C(III) + 2H+
表5-2 [ATF]和[H+]对Ce(IV)氧化ATF的反应的k 表的影响(293.3 K,[Ce(IV)]=2.0 × 10-4mol·dm-3)
结果表明,Ce(IV)氧化 ATF的反应是自由基反应。在题给酸度条件下,Ce(III)不水解,于是提出如下反应机理:
Ce4++ H2O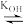 Ce(OH)3+ + H+ (1)
Ce(OH)3+ + H+ (1)
 + Ce(OH)3+
+ Ce(OH)3+ 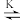
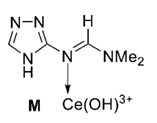 (2)
(2)
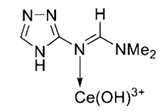
 +Ce3++H2O (3)
+Ce3++H2O (3)
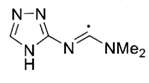 +3 Ce(OH)3+
+3 Ce(OH)3+
 +Ce3+(4)
+Ce3+(4)
 +H2O
+H2O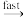
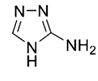 +
+ (5)
(5)

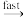 CO2+HNMe2 (6)
CO2+HNMe2 (6)
已知:KOH=0.27 mol·dm-3, K=120 dm3·mol-1
①请根据以上反应机理,导出Ce(IV)氧化ATF反应的速率方程_____ ,并给出k 表的表达式_____ 。
②根据k表的表达式,结合表5-2,讨论[ATF]对k表的影响_____ ,指出反应对ATF的级数大于1或小于1_____ 。
③根据k 表的表达式,结合表5-2,讨论[H+]对k 表的影响______ 。
(1)尽管水溶液中Ce4+强烈水解,但在高酸度溶液([HClO4]>6.05 mol·kg-1)中Ce4+仍然会发生反应: Ce4++e-⇌Ce3+。高氯酸溶液中Ce4+与OH-形成4种配合物的累积生成常数的对数分别为lgβ
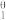 = 14.76、lgβ
= 14.76、lgβ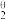 = 28.04、lgβ
= 28.04、lgβ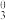 = 40.53、lgβ
= 40.53、lgβ = 51.86,有关物质的标准摩尔生成吉布斯自由能
= 51.86,有关物质的标准摩尔生成吉布斯自由能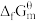 列于表5-1。
列于表5-1。表5-1物质的标准摩尔生成吉布斯自由能(298.15K)
| 物质 | 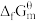 /kJ·mol-1 /kJ·mol-1 |
| H2O(1) | -237.10 |
| OH-(aq) | -157.20 |
| H+(aq) | 0 |
| Ce4+(aq) | -503.80 |
①写出Ce4+水解反应的一般表达式
②写出Ce4+与OH-形成配合物反应的一般表达式
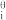 的一般表达式
的一般表达式③求Ce4+水解反应生成的4种氢氧化物的
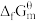
④当pH<8, Ce3+不水解。当HClO4浓度<6.05 mol·kg-1时,Ce4+/Ce3+电对的电位是溶液的pH、Ce(IV)配合物的β
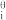 、有关物种浓度的函数,试导出这一函数关系
、有关物种浓度的函数,试导出这一函数关系(2)在HClO4溶液中,Ce4+/Cc3 电对的电位与温度的关系如图所示。

根据图示指出,当HClO4浓度大于或小于1.85 m时,Ce4+被还原成Ce3+的反应的熵变ΔS大于0、等于0或小于0
(3)采用分光光度法研究了高氯酸中Ce(IV)对有机物ATF的氧化反应。所有动力学测试都在准一级条件下进行,即ATF的浓度大大过量于[Ce(IV)]。研究发现,Ce(IV)氧化ATF的反应对Ce(IV)的分级数为一级,求得的表观一级速率常数k 表列于表5-2.该反应的化学计量反应式为:
 +2Ce(IV)+2H2O。→
+2Ce(IV)+2H2O。→ + CO2 + HNMe2 + 2C(III) + 2H+
+ CO2 + HNMe2 + 2C(III) + 2H+表5-2 [ATF]和[H+]对Ce(IV)氧化ATF的反应的k 表的影响(293.3 K,[Ce(IV)]=2.0 × 10-4mol·dm-3)
| [ATF]/10-3mol·dm-3 | [H+]/ mol·dm-3 | k 表/10-4s-1 |
| 3.0 | 0.5 | 16.2 |
| 4.0 | 0.5 | 19.4 |
| 5.0 | 0.5 | 24.3 |
| 7.0 | 0.5 | 32.5 |
| 9.0 | 0.5 | 40.9 |
| 6.0 | 0.2 | 46.1 |
| 6.0 | 0.3 | 39.9 |
| 6.0 | 0.4 | 34.2 |
| 6.0 | 0.6 | 24.9 |
| 6.0 | 0.8 | 18.5 |
结果表明,Ce(IV)氧化 ATF的反应是自由基反应。在题给酸度条件下,Ce(III)不水解,于是提出如下反应机理:
Ce4++ H2O
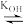 Ce(OH)3+ + H+ (1)
Ce(OH)3+ + H+ (1) + Ce(OH)3+
+ Ce(OH)3+ 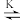
 (2)
(2)
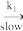
 +Ce3++H2O (3)
+Ce3++H2O (3) +3 Ce(OH)3+
+3 Ce(OH)3+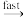
 +Ce3+(4)
+Ce3+(4) +H2O
+H2O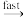
 +
+ (5)
(5)
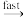 CO2+HNMe2 (6)
CO2+HNMe2 (6)已知:KOH=0.27 mol·dm-3, K=120 dm3·mol-1
①请根据以上反应机理,导出Ce(IV)氧化ATF反应的速率方程
②根据k表的表达式,结合表5-2,讨论[ATF]对k表的影响
③根据k 表的表达式,结合表5-2,讨论[H+]对k 表的影响
您最近一年使用:0次



