名校
解题方法
1 . 下列实验方案设计、现象和结论都正确的是
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 探究反应物浓度对化学反应速率的影响 | 分别取10mL 0.1mol·Lˉ1Na2S2O3溶液和5mL 0.1mol·Lˉ1Na2S2O3溶液、5mL蒸馏水于两支试管中,然后同时加入10mL 0.1mol·Lˉ1H2SO4溶液 | 前者出现浑浊的时间更短,说明增大Na2S2O3浓度,可以加快反应速率 |
| B | 探究压强对化学反应速率的影响 | 在容积不变的密闭容器中发生反应:N2(g)+3H2(g) 2NH3(g),向其中通入氩气,反应速率不变 2NH3(g),向其中通入氩气,反应速率不变 | 化学反应速率不受压强影响 |
| C | 检验Fe(NO3)2晶体是否氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 若溶液变红,则Fe(NO3)2晶体已氧化变质 |
| D | 研究淀粉的水解程度 | 取0.5g淀粉于试管中,加入适量20%的硫酸溶液后沸水浴加热5min,再滴加过量氢氧化钠溶液,再加入适量碘水 | 若溶液没有变成蓝色,则淀粉已经水解完全 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-03-14更新
|
415次组卷
|
3卷引用:浙江省北斗联盟2021-2022学年高二上学期期中联考化学试题
2 . 某研究小组根据文献模拟利用氨浸法从某钢铁厂烟灰(主要成分为ZnO,并含有少量的CuO、Fe2O3等)中制备碱式碳酸锌,并测定其组成的流程如下:
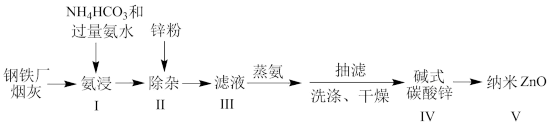
已知:a、碱式碳酸锌白色粉末,难溶于水和乙醇,微溶于氨;
纳米氧化锌具有极强的吸附性,空气中久置容易变质。
b、ZnO+2NH3+2 →Zn(NH3)
→Zn(NH3) +H2O
+H2O
Zn(NH3) →Zn2++4NH3
→Zn2++4NH3
Zn2++2OH-→Zn(OH)2↓
Zn2++ →ZnCO3↓
→ZnCO3↓
(1)“氨浸”时加入过量氨水的目的:
①使HCO 转化为
转化为 :
:
②_______ 。
(2)下列说法不正确的是_______。
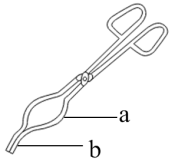
(3)I、该研究小组利用步骤V对碱式碳酸锌[Zn3(OH)m(CO3)n(其中m。n为整数)]组成进行测定,从下列选项中选出合理的操作并排序:坩埚预处理后将样品放入坩埚中称量,再置于高温炉中加热→_______→_______→_______→_______→_______。_______
①放在石棉网上
②放在干燥器中
③冷却至室温
④用如图坩埚钳a处夹取坩埚
⑤用如图坩埚钳b处夹取坩埚⑥放入电子天平中称量
⑦重复以上操作,确认最后两次称量值差≦0.001g
II、电子天平记录的部分数据如下表所示
①根据数据计算该碱式碳酸锌的化学式_______ 。
②写出蒸氨步骤制得该碱式碳酸锌的离子方程式_______ 。

已知:a、碱式碳酸锌白色粉末,难溶于水和乙醇,微溶于氨;
纳米氧化锌具有极强的吸附性,空气中久置容易变质。
b、ZnO+2NH3+2
 →Zn(NH3)
→Zn(NH3) +H2O
+H2OZn(NH3)
 →Zn2++4NH3
→Zn2++4NH3Zn2++2OH-→Zn(OH)2↓
Zn2++
 →ZnCO3↓
→ZnCO3↓(1)“氨浸”时加入过量氨水的目的:
①使HCO
 转化为
转化为 :
:②
(2)下列说法不正确的是_______。
| A.步骤I可以采用加热方式来加快浸出速率,提高浸出量 |
| B.步骤II过滤得到的滤渣中含有Cu、Fe、Zn |
| C.步骤III蒸氨过程产生气体除了氨气还有CO2,冷凝后得到的碳化氨水循环用于氨浸 |
| D.步骤IV洗涤时可先用浓氨水洗涤,减少固体溶解,再用无水乙醇洗涤 |

①放在石棉网上
②放在干燥器中
③冷却至室温
④用如图坩埚钳a处夹取坩埚
⑤用如图坩埚钳b处夹取坩埚⑥放入电子天平中称量
⑦重复以上操作,确认最后两次称量值差≦0.001g
II、电子天平记录的部分数据如下表所示
| 电子天平视数/g | |
| 空坩埚 | 19.2500 |
| 空坩埚+样品 | 25.7100 |
| 第一次灼烧后称量 | 24.3251 |
| 第二次灼烧后称量 | 24.1414 |
| 第三次灼烧后称量 | 24.1101 |
| 第四次灼烧后称量 | 24.1100 |
| 第五次灼烧后称量 | 24.1099 |
②写出蒸氨步骤制得该碱式碳酸锌的离子方程式
您最近一年使用:0次
2021-09-17更新
|
709次组卷
|
4卷引用:浙江省名校新高考研究联盟(Z20联盟)2022届高三上学期第一次联考化学试题
浙江省名校新高考研究联盟(Z20联盟)2022届高三上学期第一次联考化学试题2021年湖北高考化学试题变式题11-19(已下线)解密13 实验化学(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)2020年全国卷Ⅰ理综化学高考真题变式题
3 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 探究乙醇消去反应的产物 | 取 乙醇,加入 乙醇,加入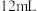 浓硫酸、少量沸石,迅速升温至140℃,将产生的气体通入 浓硫酸、少量沸石,迅速升温至140℃,将产生的气体通入 溴水中 溴水中 | 若溴水褪色,则乙醇消去反应的产物为乙烯 |
| B | 探究乙酰水杨酸样品中是否含有水杨酸 | 取少量样品,加入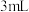 蒸馏水和少量乙醇,振荡,再加入1-2滴 蒸馏水和少量乙醇,振荡,再加入1-2滴 溶液 溶液 | 若有紫色沉淀生成,则该产品中含有水杨酸 |
| C | 探究金属钠在氧气中燃烧所得固体粉末的成分 | 取少量固体粉末,加入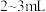 蒸馏水 蒸馏水 | 若无气体生成,则固体粉末为 ;若有气体生成,则固体粉末为 ;若有气体生成,则固体粉末为 |
| D | 探究 固体样品是否变质 固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量 溶液 溶液 | 若有白色沉淀产生,则样品已经变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-06-15更新
|
6962次组卷
|
15卷引用:2021年6月新高考浙江化学高考真题
2021年6月新高考浙江化学高考真题(已下线)考点35 化学实验方案的设计与评价-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题17.基础实验设计与评价-十年(2012-2021)高考化学真题分项汇编(浙江专用)(已下线)2021年6月浙江高考化学试题变式题21-25(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)解密11 化学实验基础(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密11 化学实验(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题16 基础化学实验-2022年高考化学二轮复习重点专题常考点突破练(已下线)秘籍05 微型实验方案设计与评价-备战2022年高考化学抢分秘籍(全国通用)(已下线)第27讲 物质的制备与性质实验(练)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)易错点33 物质的制备-备战2023年高考化学考试易错题(已下线)专题05 化学实验基础-2023年高考化学真题题源解密(全国通用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)题型07 化学实验基础(选择题)-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
4 . 下列设计的实验方案能达到实验目的的是
| A.提纯含有少量苯的苯酚:向含有少量苯的苯酚中加入过量氢氧化钠溶液,振荡后静置分液,除去有机相 |
| B.探究温度对化学平衡移动的影响:将盛有NO2和N2O4混合气体的平衡球,分别置于冷水和热水中,观察气体颜色的变化 |
| C.将硝酸亚铁样品溶于稀硫酸,滴加硫氰化钾溶液,溶液变为血红色,可推知该样品已经氧化变质 |
| D.实验室常用浓硫酸与NaCl共热制取少量HCl,也可以用浓硫酸与KI共热制取HI |
您最近一年使用:0次
解题方法
5 . 鱼浮灵主要成分为过碳酸钠(2Na2CO3•3H2O2)是水产养殖的速效增氧剂信息:
①过碳酸钠具有Na2CO3和H2O2的双重性质,50℃开始分解
②2Na2CO3(aq)+3H2O2(aq)=2Na2CO3•3H2O2(aq)△H<0
③过碳酸钠在异丙醇中的溶解度较低
实验室用Na2CO3与稳定剂的混合液和H2O2化合制备过碳酸钠,制备装置如图。
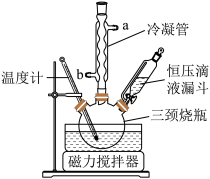
(1)冷凝管中冷凝水的进口是___ (填“a”或“b”),恒压滴液漏斗中盛装的药品是___ 。
(2)实验测定反应温度对产物的影响如表所示,根据表中数据可以得知最佳的反应温度为15—20℃,请说明选择该温度的理由是___ 。
(3)反应结束后,停止搅拌,( ),( ),( ),( ),干燥得到产品,从下列选项中选出合理的操作(操作不能重复使用)并排序___ 。
a.蒸发溶剂至100℃,冷却结晶
b.蒸发至大量晶体析出,用余热蒸干
c.加入异丙醇
d.用异丙醇溶液洗涤
e.用饱和碳酸钠溶液洗涤
f.抽滤
g.加入氯化钠晶体
h.静置
(4)过碳酸钠成分的测定:
①取适量过氧碳酸钠样品,用蒸馏水溶解后转移至250mL容量瓶中,定容,摇匀
②用移液管移取25.00mL于锥形瓶中,加入2-3滴甲基橙,用0.2000mol•L-1硫酸标准溶液滴定至终点。重复操作2-3次,记录数据。
③用移液管移取12.50mL于锥形瓶中,加入足量稀硫酸,用0.0200mol•L-1KMnO4标准溶液滴定至终点。重复操作2-3次,记录数据。
经计算发现过氧碳酸钠中碳酸钠与双氧水的比例大于2:3,引起上述结果可能的原因有___ 。
A.干燥产品时采用了加热烘干的方式
B.上述步骤②操作过程中,滴定完成后,俯视滴定管
C.上述步骤③滴定操作前润洗了滴定管和锥形瓶
D.上述步骤③滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡
(5)某小组在常温下进行H2O2在不同pH下,相同时间内溶解氧含量测定的实验,数据记录如表:
结合以上数据分析“鱼浮灵”溶于水后在水产养殖中速效增氧的原理是___ 。
①过碳酸钠具有Na2CO3和H2O2的双重性质,50℃开始分解
②2Na2CO3(aq)+3H2O2(aq)=2Na2CO3•3H2O2(aq)△H<0
③过碳酸钠在异丙醇中的溶解度较低
实验室用Na2CO3与稳定剂的混合液和H2O2化合制备过碳酸钠,制备装置如图。

(1)冷凝管中冷凝水的进口是
(2)实验测定反应温度对产物的影响如表所示,根据表中数据可以得知最佳的反应温度为15—20℃,请说明选择该温度的理由是
| t/℃ | 活性氧百分含量/% | 产率/% |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
a.蒸发溶剂至100℃,冷却结晶
b.蒸发至大量晶体析出,用余热蒸干
c.加入异丙醇
d.用异丙醇溶液洗涤
e.用饱和碳酸钠溶液洗涤
f.抽滤
g.加入氯化钠晶体
h.静置
(4)过碳酸钠成分的测定:
①取适量过氧碳酸钠样品,用蒸馏水溶解后转移至250mL容量瓶中,定容,摇匀
②用移液管移取25.00mL于锥形瓶中,加入2-3滴甲基橙,用0.2000mol•L-1硫酸标准溶液滴定至终点。重复操作2-3次,记录数据。
③用移液管移取12.50mL于锥形瓶中,加入足量稀硫酸,用0.0200mol•L-1KMnO4标准溶液滴定至终点。重复操作2-3次,记录数据。
经计算发现过氧碳酸钠中碳酸钠与双氧水的比例大于2:3,引起上述结果可能的原因有
A.干燥产品时采用了加热烘干的方式
B.上述步骤②操作过程中,滴定完成后,俯视滴定管
C.上述步骤③滴定操作前润洗了滴定管和锥形瓶
D.上述步骤③滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡
(5)某小组在常温下进行H2O2在不同pH下,相同时间内溶解氧含量测定的实验,数据记录如表:
| 试剂 | H2O2 | H2O2+NaCl | H2O2+Na2CO3 | H2O2+NaOH | H2O2+NaOH |
| pH | 6.01 | 5.97 | 8.14 | 8.15 | 9.26 |
| 溶解氧 | 6.44 | 6.48 | 9.11 | 9.12 | 10.97 |
您最近一年使用:0次
2021-04-30更新
|
343次组卷
|
3卷引用:浙江省平湖市2021届高三4月适应性考试化学试题
浙江省平湖市2021届高三4月适应性考试化学试题(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)新疆维吾尔自治区疏附县第一中学2021-2022学年高三上学期期中考试化学试题
解题方法
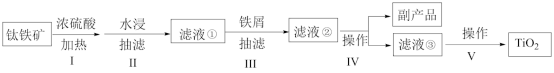
6 . 钛白粉(主要成分是 ),广泛用于油漆、塑料、造纸等行业。下图是以钛铁矿[主要成分偏钛酸亚铁
),广泛用于油漆、塑料、造纸等行业。下图是以钛铁矿[主要成分偏钛酸亚铁 ,含
,含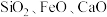 杂质]为主要原料生产钛白粉并获得副产品
杂质]为主要原料生产钛白粉并获得副产品 的工艺流程图。
的工艺流程图。
已知:发生的主要反应方程式如下:
①
②
③
(1)为加快钛铁矿在硫酸中的溶解,可采取的措施有______ 。
(2)下列说法正确的是_______ 。
A.步骤Ⅱ抽滤得到的滤渣是
B.步骤Ⅱ水浸时温度不宜过高,否则会导致 产率降低
产率降低
C.步骤Ⅱ、Ⅲ抽滤时选用的滤纸要小于布氏漏斗内径,但必须盖住所有小孔
D.步骤Ⅲ加铁屑的作用是将 还原为
还原为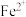 ,以获得较纯净的副产品
,以获得较纯净的副产品
(3)步骤V包括钛盐的水解、产物的分离和物质的转化。操作步骤如下:_____→_____→____→____→将滤渣在坩埚中充分灼烧得到二氧化钛(TiO2),_____ 。
①将下列操作按合理顺序填入以上空格。
a.用滤液淋洗锥形瓶,直到所有的沉淀被收集到布氏漏斗中,继续抽滤;
b.将滤液③加到盛有沸水的锥形瓶中,搅拌、煮沸;
c.用水洗涤沉淀2-3次,再抽干水分;
d.将悬浊液转移到布氏漏斗中抽滤;
②关于上述灼烧操作,下列相关说法正确的是_______
A.坩埚洗净擦干后,即可加入固体灼烧
B.将盛有固体的坩埚放在三脚架的石棉网上加热
C.灼烧固体过程中,需要不断搅拌
D.判断固体是否完全分解,可以重复灼烧、冷却、称量至恒重
(4)测定样品中TiO2纯度的方法是:
步骤一:精确称取0.2000g样品放入锥形瓶中,一定条件下,将TiO2溶解并还原为Ti3+。
步骤二:称取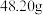 硫酸铁铵
硫酸铁铵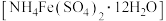 配制成
配制成 硫酸铁铵标准溶液。
硫酸铁铵标准溶液。
步骤三:滴加 溶液作指示剂,用配制的硫酸铁铵标准溶液滴定至终点。重复操作2次,消耗硫酸铁铵标准溶液的体积平均值为20.00mL (已知:
溶液作指示剂,用配制的硫酸铁铵标准溶液滴定至终点。重复操作2次,消耗硫酸铁铵标准溶液的体积平均值为20.00mL (已知: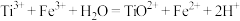 )。
)。
请回答:
①样品中TiO2的质量分数为_____ 。
②步骤三滴定过程中速度过慢,将导致测定结果_ (填“偏高”“偏低”或“无影响”)。请说明理由_ 。
 ),广泛用于油漆、塑料、造纸等行业。下图是以钛铁矿[主要成分偏钛酸亚铁
),广泛用于油漆、塑料、造纸等行业。下图是以钛铁矿[主要成分偏钛酸亚铁 ,含
,含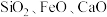 杂质]为主要原料生产钛白粉并获得副产品
杂质]为主要原料生产钛白粉并获得副产品 的工艺流程图。
的工艺流程图。
已知:发生的主要反应方程式如下:
①

②

③

(1)为加快钛铁矿在硫酸中的溶解,可采取的措施有
(2)下列说法正确的是
A.步骤Ⅱ抽滤得到的滤渣是

B.步骤Ⅱ水浸时温度不宜过高,否则会导致
 产率降低
产率降低C.步骤Ⅱ、Ⅲ抽滤时选用的滤纸要小于布氏漏斗内径,但必须盖住所有小孔
D.步骤Ⅲ加铁屑的作用是将
 还原为
还原为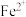 ,以获得较纯净的副产品
,以获得较纯净的副产品
(3)步骤V包括钛盐的水解、产物的分离和物质的转化。操作步骤如下:_____→_____→____→____→将滤渣在坩埚中充分灼烧得到二氧化钛(TiO2),
①将下列操作按合理顺序填入以上空格。
a.用滤液淋洗锥形瓶,直到所有的沉淀被收集到布氏漏斗中,继续抽滤;
b.将滤液③加到盛有沸水的锥形瓶中,搅拌、煮沸;
c.用水洗涤沉淀2-3次,再抽干水分;
d.将悬浊液转移到布氏漏斗中抽滤;
②关于上述灼烧操作,下列相关说法正确的是
A.坩埚洗净擦干后,即可加入固体灼烧
B.将盛有固体的坩埚放在三脚架的石棉网上加热
C.灼烧固体过程中,需要不断搅拌
D.判断固体是否完全分解,可以重复灼烧、冷却、称量至恒重
(4)测定样品中TiO2纯度的方法是:
步骤一:精确称取0.2000g样品放入锥形瓶中,一定条件下,将TiO2溶解并还原为Ti3+。
步骤二:称取
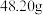 硫酸铁铵
硫酸铁铵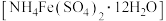 配制成
配制成 硫酸铁铵标准溶液。
硫酸铁铵标准溶液。步骤三:滴加
 溶液作指示剂,用配制的硫酸铁铵标准溶液滴定至终点。重复操作2次,消耗硫酸铁铵标准溶液的体积平均值为20.00mL (已知:
溶液作指示剂,用配制的硫酸铁铵标准溶液滴定至终点。重复操作2次,消耗硫酸铁铵标准溶液的体积平均值为20.00mL (已知: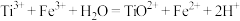 )。
)。请回答:
①样品中TiO2的质量分数为
②步骤三滴定过程中速度过慢,将导致测定结果
您最近一年使用:0次



