名校
1 . 下列有关材料的结构或性质与用途不具有对应关系的是
| A.硅橡胶具有无毒、无味、耐高温的性质,用作压力锅的密封圈 |
| B.分子筛(铝硅酸盐)具有微孔结构,用作计算机芯片 |
| C.Ti-Fe合金储氢量大、吸放氢速率快,用于氢燃料汽车 |
| D.高温结构陶瓷具有耐高温、耐氧化、耐磨蚀的特性,用于发动机 |
您最近一年使用:0次
2021-04-23更新
|
1040次组卷
|
13卷引用:考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)河北省2021届高三普通高中学业水平选择性模拟考试化学试题(已下线)课时20 碳、硅与无机非金属材料-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题10 无机非金属材料的主角——硅 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练陕西省西安市铁一中学2022届高三第二次月考化学试题(已下线)2020年江苏卷化学高考真题变式题1-10湖南省衡阳市2022届高三下学期联考 (三模)化学试题辽宁省大连市第一〇三中学2022届高三第八次考试化学试题(已下线)河北省石家庄市2022届高三毕业班教学质量检测二(一模)(选择题1-5)(已下线)江苏省南京市盐城市2023届高三3月第二次模拟考试化学试题变式题(选择题1-5)(已下线)选择题1-5(已下线)选择题1-5
解题方法
2 . 下列实验操作、现象与结论对应关系正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向苯酚浊液中加Na2CO3溶液 | 浊液变澄清 | 酸性:苯酚比H2CO3强 |
| B | 无水Na2CO3固体加无水乙醇的酚酞溶液,再滴加水 | 加水前无现象,加水后溶液显红色 | 碳酸钠与水发生反应生成了能使酚酞变红的物质 |
| C | 硅酸钠溶液中滴加盐酸 | 出现白色胶状沉淀 | 非金属性Cl>Si |
| D | 饱和苯酚溶液中滴加稀溴水 | 无明显现象 | 苯酚与稀溴水不反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 化合物X在工业、农业生产中都有重要用途,X由4种常见元素组成,某兴趣小组展开如下实验(气体的体积均在标准状况下测得):

已知:①X的摩尔质量为454g·mol-1;②化合物B常温下是常见的液体;③混合气体C能使品红溶液褪色,气体E能使带火星的木条复燃。
请回答:
(1)白色沉淀F的化学式是___________ ,化合物X的化学式是___________ 。
(2)混合气体C与足量氯水反应的离子方程式为___________ 。
(3)化合物X高温分解的化学方程式为___________ 。
(4)蓝色溶液G 与NaOH溶液发生非氧化还原反应可制得X,化学方程式为___________ 。

已知:①X的摩尔质量为454g·mol-1;②化合物B常温下是常见的液体;③混合气体C能使品红溶液褪色,气体E能使带火星的木条复燃。
请回答:
(1)白色沉淀F的化学式是
(2)混合气体C与足量氯水反应的离子方程式为
(3)化合物X高温分解的化学方程式为
(4)蓝色溶液G 与NaOH溶液发生非氧化还原反应可制得X,化学方程式为
您最近一年使用:0次
2021-11-20更新
|
220次组卷
|
2卷引用:浙江省衢温市“5+1”联盟2021-2022学年高二上学期期中联考化学试题
解题方法
4 . 二氧化硫在工业上和生活中有广泛的用途。
工业用SO2和O2反应合成SO3反应的反应热(ΔH)、活化能(Ea正)为:SO2(g)+ O2(g)
O2(g) SO3(g)ΔH=-98.0kJ·mol-1Ea正=125.5kJ·mol-1
SO3(g)ΔH=-98.0kJ·mol-1Ea正=125.5kJ·mol-1
(1)三氧化硫的分解反应SO3(g) SO2(g)+
SO2(g)+ O2(g)的活化能Ea正=
O2(g)的活化能Ea正=___________ 。
(2)下列关于工业用SO2和O2反应合成SO3反应的理解正确的是___________。
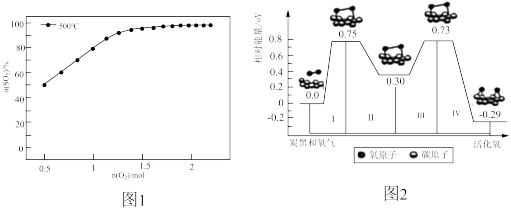
(3)在1L体积可变的密闭容器,维持温度为500°C,压强为1×105Pa和初始n(SO2)=2mol,充入一定量的O2,发生可逆反应:2SO2(g)+O2(g) 2SO3(g)ΔH=-196kJ·mol-1,SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
2SO3(g)ΔH=-196kJ·mol-1,SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
①在500°C时,SO2平衡转化率随着O2物质的量的增大而升高,解释其原因___________ 。
②其他条件不变,若改为在1L体积不变的密闭容器中发生上述可逆反应,请在下图中画出SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系图___________ 。
(4)已知活化氧可以把SO2快速氧化为SO3.根据计算机模拟结果,在炭黑表面上O2转化为活化氧的反应历程与能量变化如图2所示。下列说法不正确的是___________。
(5)已知标准状况下,1L水能溶解VL二氧化硫气体,且饱和溶液中的SO2有 与水反应生成H2SO3,测得c(H+)=0.2mol·L-1.计算该条件下的V=
与水反应生成H2SO3,测得c(H+)=0.2mol·L-1.计算该条件下的V=___________ (已知H2SO3的第一步电离平衡常数Ka1=0.02,忽略第二步电离和溶液体积的变化,保留小数点后2位)。
工业用SO2和O2反应合成SO3反应的反应热(ΔH)、活化能(Ea正)为:SO2(g)+
 O2(g)
O2(g) SO3(g)ΔH=-98.0kJ·mol-1Ea正=125.5kJ·mol-1
SO3(g)ΔH=-98.0kJ·mol-1Ea正=125.5kJ·mol-1(1)三氧化硫的分解反应SO3(g)
 SO2(g)+
SO2(g)+ O2(g)的活化能Ea正=
O2(g)的活化能Ea正=(2)下列关于工业用SO2和O2反应合成SO3反应的理解正确的是___________。
| A.增大氧气浓度,活化分子百分数增大,有效碰撞频率增大,反应速率加快 |
| B.该反应的实际工业生产条件是高温、高压、合适的催化剂 |
| C.当温度、压强一定时,在原料气(SO2和O2的比例不变)中添加少量惰性气体,会使平衡转化率减小 |
| D.反应过程中,可将SO3液化,并不断将液态SO3移去,有利于提高正反应速率 |
 2SO3(g)ΔH=-196kJ·mol-1,SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:
2SO3(g)ΔH=-196kJ·mol-1,SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系如图1所示:①在500°C时,SO2平衡转化率随着O2物质的量的增大而升高,解释其原因
②其他条件不变,若改为在1L体积不变的密闭容器中发生上述可逆反应,请在下图中画出SO2平衡转化率α(SO2)随O2物质的量n(O2)的变化关系图

(4)已知活化氧可以把SO2快速氧化为SO3.根据计算机模拟结果,在炭黑表面上O2转化为活化氧的反应历程与能量变化如图2所示。下列说法不正确的是___________。
| A.O2转化为活化氧是氧氧键的断裂与碳氧键的生成过程 |
| B.每活化一个O2吸收0.29eV的能量 |
| C.该过程中的最大能垒(活化能)Ea正=1.02eV |
| D.该催化反应的反应物在一定条件下达到相对能量为0.75eV的过渡态后,无需加热就能发生后续反应II、III和IV |
 与水反应生成H2SO3,测得c(H+)=0.2mol·L-1.计算该条件下的V=
与水反应生成H2SO3,测得c(H+)=0.2mol·L-1.计算该条件下的V=
您最近一年使用:0次
2021-09-17更新
|
985次组卷
|
2卷引用:浙江省名校新高考研究联盟(Z20联盟)2022届高三上学期第一次联考化学试题
5 . Ⅰ.电解法制取有广泛用途的Na2FeO4,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

(1)电解过程中,阳极电极反应式___ 。
(2)c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c(Na2FeO4)低于最高值的原因:___ 。
(3)有实验表明用铁粉末压制的“粉末铁”做阳极比用纯铁块做阳极能够获得更高的浓度和产量,试分析原因:___ 。
Ⅱ.在酸性介质中HNO2参加的氧化还原反应速率相当快。实验表明HNO2加入酸性NaI溶液,HNO2将I-氧化成I2的过程由3步反应组成:
①HNO2(aq)+H+((aq)=NO+(aq)+H2O(1)②___;③2ONI(aq)=I2(aq)+2NO↑
(1)写出第②步反应的离子方程式___ 。
(2)在溶液中存在化学平衡:I2(aq)+NaI(aq) NaI3(aq),其平衡常数表达式为
NaI3(aq),其平衡常数表达式为___ 。
Ⅲ.合成氨工业中的原料气H2可以利用如下反应获取CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.4kJ•mol-1Ea=240.1kJ•mol-1
(1)一定可以提高平衡体系中H2百分含量,又能加快反应速率的是___ 。
A.升高温度 B.增大水蒸气浓度
C.选择性能优良的催化剂 D.投料比不变,增大反应物浓度
(2)该反应的逆反应活化能Ea′=___ kJ•mol-1。
 ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
(1)电解过程中,阳极电极反应式
(2)c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c(Na2FeO4)低于最高值的原因:
(3)有实验表明用铁粉末压制的“粉末铁”做阳极比用纯铁块做阳极能够获得更高的浓度和产量,试分析原因:
Ⅱ.在酸性介质中HNO2参加的氧化还原反应速率相当快。实验表明HNO2加入酸性NaI溶液,HNO2将I-氧化成I2的过程由3步反应组成:
①HNO2(aq)+H+((aq)=NO+(aq)+H2O(1)②___;③2ONI(aq)=I2(aq)+2NO↑
(1)写出第②步反应的离子方程式
(2)在溶液中存在化学平衡:I2(aq)+NaI(aq)
 NaI3(aq),其平衡常数表达式为
NaI3(aq),其平衡常数表达式为Ⅲ.合成氨工业中的原料气H2可以利用如下反应获取CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.4kJ•mol-1Ea=240.1kJ•mol-1
(1)一定可以提高平衡体系中H2百分含量,又能加快反应速率的是
A.升高温度 B.增大水蒸气浓度
C.选择性能优良的催化剂 D.投料比不变,增大反应物浓度
(2)该反应的逆反应活化能Ea′=
您最近一年使用:0次
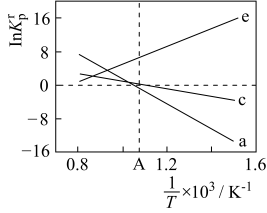
6 . 氯化亚铜(CuCl)可用作有机合成催化剂、杀菌剂、媒染剂、脱色剂等,用途广泛。微溶于水,溶于浓盐酸生成氯化亚铜酸(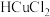 强酸),溶于氨水生成氯化二氨合亚铜,不溶于乙醇。实验室按如图所示装置和方案制备氯化亚铜。
强酸),溶于氨水生成氯化二氨合亚铜,不溶于乙醇。实验室按如图所示装置和方案制备氯化亚铜。
已知:①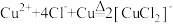 ;②
;②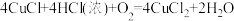

实验步骤:
①加热至50℃,铜丝表面产生无色气泡,液面上方有红棕色气体产生;
②通入O2并调节O2的量保持三颈烧瓶内压强不变,停止加热,反应继续进行,且越来越剧烈;
③反应停止后冷却至室温,待气囊变瘪,三颈烧瓶内红棕色气体消失时关闭K;
④将液体(含 )转移至烧杯中用蒸馏水稀释,产生白色沉淀,过滤得氯化亚铜粗品;
)转移至烧杯中用蒸馏水稀释,产生白色沉淀,过滤得氯化亚铜粗品;
⑤氯化亚铜粗品经洗涤、烘干,得到氯化亚铜。
⑥产品纯度测定:准确称取所制备的氯化亚铜样品mg,将其置于过量的 溶液中,待样品完全溶解后,加入适量稀硫酸,用
溶液中,待样品完全溶解后,加入适量稀硫酸,用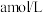 的
的 标准溶液滴定到终点,消耗
标准溶液滴定到终点,消耗 溶液
溶液 ,反应中
,反应中 被还原为
被还原为 。
。
回答下列问题:
(1)实验中通入氧气的作用是___________ (结合化学方程式回答)。
(2)步骤④中产生白色沉淀的反应的离子方程是___________ 。
(3)将CuCl沉淀先用___________ (填字母)洗涤3~5次,再用乙醇边洗涤边进行减压过滤,用乙醇作洗涤剂的目的是___________ 。
a.H2O b.稀盐酸 c.浓盐酸
(4)步骤⑤中用蒸馏水洗涤氯化亚铜粗品时,表面会产生浅黄色固体CuOH,用化学平衡移动原理解释白色固体变黄的原因:___________ 。
(5)实验过程中需要进行多次滴定,在滴定步骤前要进行一系列操作,请选择合适编号,按正确顺序排列 ,
,___________ 。
a.向酸式滴定管中装入标准液至“0”刻度以上;
b.向碱式滴定管中装入标准液至“0”刻度以上
c.用蒸馏水洗涤滴定管;
d.用标准液润洗滴定管;
e.将活塞旋转 后,再次观察
后,再次观察
f.调整标准液液面低于“0”刻度;
g.将滴定管内装满水,直立于滴定管夹上约2min;
h.右手拿住滴定管使其倾斜 ,左手迅速打开活塞;
,左手迅速打开活塞;
i.将滴定管直立于滴定管夹上,静置1分钟左右读数。
(6)样品中CuCl的质量分数为_____ [杂质不参与反应;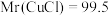 ,列出计算式即可]
,列出计算式即可]
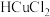 强酸),溶于氨水生成氯化二氨合亚铜,不溶于乙醇。实验室按如图所示装置和方案制备氯化亚铜。
强酸),溶于氨水生成氯化二氨合亚铜,不溶于乙醇。实验室按如图所示装置和方案制备氯化亚铜。已知:①
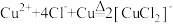 ;②
;②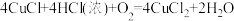

实验步骤:
①加热至50℃,铜丝表面产生无色气泡,液面上方有红棕色气体产生;
②通入O2并调节O2的量保持三颈烧瓶内压强不变,停止加热,反应继续进行,且越来越剧烈;
③反应停止后冷却至室温,待气囊变瘪,三颈烧瓶内红棕色气体消失时关闭K;
④将液体(含
 )转移至烧杯中用蒸馏水稀释,产生白色沉淀,过滤得氯化亚铜粗品;
)转移至烧杯中用蒸馏水稀释,产生白色沉淀,过滤得氯化亚铜粗品;⑤氯化亚铜粗品经洗涤、烘干,得到氯化亚铜。
⑥产品纯度测定:准确称取所制备的氯化亚铜样品mg,将其置于过量的
 溶液中,待样品完全溶解后,加入适量稀硫酸,用
溶液中,待样品完全溶解后,加入适量稀硫酸,用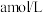 的
的 标准溶液滴定到终点,消耗
标准溶液滴定到终点,消耗 溶液
溶液 ,反应中
,反应中 被还原为
被还原为 。
。回答下列问题:
(1)实验中通入氧气的作用是
(2)步骤④中产生白色沉淀的反应的离子方程是
(3)将CuCl沉淀先用
a.H2O b.稀盐酸 c.浓盐酸
(4)步骤⑤中用蒸馏水洗涤氯化亚铜粗品时,表面会产生浅黄色固体CuOH,用化学平衡移动原理解释白色固体变黄的原因:
(5)实验过程中需要进行多次滴定,在滴定步骤前要进行一系列操作,请选择合适编号,按正确顺序排列
 ,
,a.向酸式滴定管中装入标准液至“0”刻度以上;
b.向碱式滴定管中装入标准液至“0”刻度以上
c.用蒸馏水洗涤滴定管;
d.用标准液润洗滴定管;
e.将活塞旋转
 后,再次观察
后,再次观察f.调整标准液液面低于“0”刻度;
g.将滴定管内装满水,直立于滴定管夹上约2min;
h.右手拿住滴定管使其倾斜
 ,左手迅速打开活塞;
,左手迅速打开活塞;i.将滴定管直立于滴定管夹上,静置1分钟左右读数。
(6)样品中CuCl的质量分数为
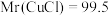 ,列出计算式即可]
,列出计算式即可]
您最近一年使用:0次
真题
解题方法
7 . 我国力争于2030年前做到碳达峰,2060年前实现碳中和。CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
a)CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1
b)CO2(g)+H2(g) CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2
c)CH4(g) C(s)+2H2(g) ∆H3
C(s)+2H2(g) ∆H3
d)2CO(g) CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4
e)CO(g)+H2(g) H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5
(1)根据盖斯定律,反应a的∆H1=_______ (写出一个代数式即可)。
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有_______ 。
A. 增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B. 移去部分C(s),反应c、d、e的平衡均向右移动
C. 加入反应a的催化剂,可提高CH4的平衡转化率
D. 降低反应温度,反应a~e的正、逆反应速率都减小
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分_______ 步进行,其中,第_______ 步的正反应活化能最大。
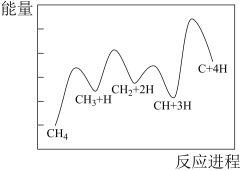
(4)设K 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
①反应a、c、e中,属于吸热反应的有_______ (填字母)。
②反应c的相对压力平衡常数表达式为K =
=_______ 。
③在图中A点对应温度下、原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程_______ 。
(5)CO2用途广泛,写出基于其物理性质的一种用途:_______ 。
a)CH4(g)+CO2(g)
 2CO(g)+2H2(g) ∆H1
2CO(g)+2H2(g) ∆H1b)CO2(g)+H2(g)
 CO(g)+H2O(g) ∆H2
CO(g)+H2O(g) ∆H2c)CH4(g)
 C(s)+2H2(g) ∆H3
C(s)+2H2(g) ∆H3d)2CO(g)
 CO2(g)+C(s) ∆H4
CO2(g)+C(s) ∆H4e)CO(g)+H2(g)
 H2O(g)+C(s) ∆H5
H2O(g)+C(s) ∆H5(1)根据盖斯定律,反应a的∆H1=
(2)上述反应体系在一定条件下建立平衡后,下列说法正确的有
A. 增大CO2与CH4的浓度,反应a、b、c的正反应速率都增加
B. 移去部分C(s),反应c、d、e的平衡均向右移动
C. 加入反应a的催化剂,可提高CH4的平衡转化率
D. 降低反应温度,反应a~e的正、逆反应速率都减小
(3)一定条件下,CH4分解形成碳的反应历程如图所示。该历程分

(4)设K
 为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K
为相对压力平衡常数,其表达式写法:在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为kPa)除以p0(p0=100kPa)。反应a、c、e的ln K 随
随 (温度的倒数)的变化如图所示。
(温度的倒数)的变化如图所示。
①反应a、c、e中,属于吸热反应的有
②反应c的相对压力平衡常数表达式为K
 =
=③在图中A点对应温度下、原料组成为n(CO2):n(CH4)=1:1、初始总压为100kPa的恒容密闭容器中进行反应,体系达到平衡时H2的分压为40kPa。计算CH4的平衡转化率,写出计算过程
(5)CO2用途广泛,写出基于其物理性质的一种用途:
您最近一年使用:0次
2021-06-11更新
|
13568次组卷
|
11卷引用:考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(浙江专用)2021年新高考广东化学高考真题(已下线)考点19 化学平衡常数 化学反应进行的方向-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考向18 化学反应与能量变化-备战2022年高考化学一轮复习考点微专题2021年广东省高考化学试卷变式题11-21(已下线)专题12 化学反应原理综合题—2022年高考化学二轮复习讲练测(全国版)-讲义(已下线)回归教材重难点09 化学反应原理综合-【查漏补缺】2022年高考化学三轮冲刺过关(新高考专用)(已下线)专题15 化学反应原理综合题-三年(2020-2022)高考真题分项汇编(已下线)考点23 化学平衡常数-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题17 原理综合题(已下线)专题17 原理综合题
名校
8 . 材料是人类赖以生存和发展的物质基础。下列有关物质的说法正确的是
| A.石英玻璃、碳化硅陶瓷、水泥、石墨烯都是新型无机非金属材料 |
| B.晶体硅的主要用途是制造光导纤维 |
| C.汽车中小摆件“苹果花”的动力是以Si为原料制作的太阳能电池 |
| D.普通玻璃的主要成分为纯碱、石灰石、石英砂 |
您最近一年使用:0次
2021-05-22更新
|
468次组卷
|
9卷引用:考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(浙江专用)黑龙江省双鸭山市第一中学2020-2021学年高一下学期期中考试化学试题(已下线)课时20 碳、硅与无机非金属材料-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点10 碳、硅及其无机非金属材料-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)专题07 常见非金属及其化合物-备战2022年高考化学学霸纠错(全国通用)山西省榆次第一中学校2021-2022学年高一下学期期中线上测试化学试题湖南省怀化市第五中学2022-2023学年高一下学期期中考试化学试题广东省深圳科学高中2021-2022学年高一下学期在线学习检测化学试题安徽省安庆市第九中学2022-2023学年高一下学期期中考试化学试题
9 . 过氧乙酸是具有重要用途的有机合成氧化剂和化工原料,实验室拟合成过氧乙酸并测定其含量。
(1)浓缩
在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30% 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
冷凝管1、冷凝管2中进水接口依次为___________ 、___________ (填字母)。
②加热温度不宜超过60℃的原因是___________ 。
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68% 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
(已知:CH3COOH+H2O2
 +H2O)
+H2O)
①用浓缩的68% 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是___________ 。
②充分搅拌的目的是___________ 。
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。
步骤c:向滴定后的溶液中再加1.0gKI( ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。
①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要___________
②设计步骤b的目的是___________
③过氧乙酸的质量分数为___________ %。
(1)浓缩

在图示装置(加热装置已省略)中,由分液漏斗向冷凝管1中滴加30%
 溶液,最终得到质量分数约68%的
溶液,最终得到质量分数约68%的 溶液。
溶液。
冷凝管1、冷凝管2中进水接口依次为
②加热温度不宜超过60℃的原因是
(2)合成过氧乙酸
向带有搅拌装置及温度计的500mL三口烧瓶中先加入16g冰醋酸,在搅拌下滴加90g68%
 溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。
溶液,最后加入4.1mL浓硫酸,搅拌5h,静置20h。(已知:CH3COOH+H2O2
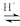
 +H2O)
+H2O)①用浓缩的68%
 溶液代替常见的30%
溶液代替常见的30% 溶液的目的是
溶液的目的是②充分搅拌的目的是
(3)过氧乙酸含量的测定
步骤a:称取5.0g过氧乙酸试样(液体),配制成100mL溶液A。
步骤b:在碘量瓶中加入5.0mL
 溶液、3滴
溶液、3滴 溶液、5.0mL溶液A,摇匀,用0.01mol/L的
溶液、5.0mL溶液A,摇匀,用0.01mol/L的 溶液滴定至溶液呈微红色。
溶液滴定至溶液呈微红色。步骤c:向滴定后的溶液中再加1.0gKI(
 ),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的
),摇匀,置于暗处5min,用蒸馏水冲洗瓶盖及四周,加钼酸铵催化剂20mL,摇匀,用淀粉溶液作指示剂,用0.05mol/L的 标准溶液滴定至蓝色刚好褪去(
标准溶液滴定至蓝色刚好褪去( )。重复步骤b,步骤c三次,测得平均消耗
)。重复步骤b,步骤c三次,测得平均消耗 标准溶液的体积为20.00mL。
标准溶液的体积为20.00mL。①步骤a中配制溶液A时,需要用到的玻璃仪器除烧杯、100mL容量瓶,玻璃棒和量筒外,还需要
②设计步骤b的目的是
③过氧乙酸的质量分数为
您最近一年使用:0次
名校
10 . 钒元素用途广泛,如图是一种钒的化合物催化某反应的反应机理。下列叙述错误的是
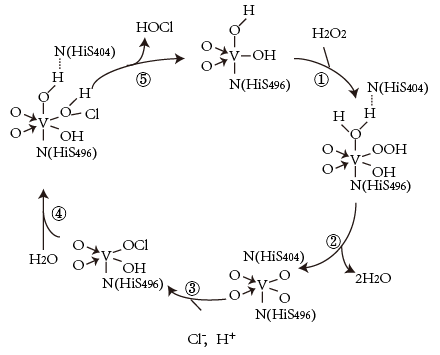

| A.H2O参与了该催化反应 |
| B.过程①中反应的原子利用率为100% |
| C.该催化循环过程中有氢氧键的断裂和形成 |
| D.每次循环的净反应为H2O2+2C1-=2HOCl+2e- |
您最近一年使用:0次
2021-04-24更新
|
1614次组卷
|
16卷引用:考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(浙江专用)
(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)2022年1月浙江省普通高校招生选考科目考试化学仿真模拟试卷B安徽省皖南八校2021届高三4月第三次联考理综化学试题(已下线)押山东卷第13题 陌生反应机理选择题-备战2021年高考化学临考题号押题(山东卷)(已下线)2021年高考化学押题预测卷(山东卷)03(含考试版、答题卡、参考答案、全解全析)(已下线)考点01 物质的组成、性质和分类-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点01 物质的组成、分类及转化-备战2022年高考化学学霸纠错(全国通用)新疆石河子第一中学2021-2022学年高三上学期8月月考(A卷)化学试题(已下线)押新高考卷11题 反应机理分析-备战2022年高考化学临考题号押题(新高考通版)(已下线)考点01 物质的分类和转化-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)2022年辽宁省高考真题变式题(16-19)江西省宜春市上高二中2021-2022学年高三下学期第十次月考(5月)理综化学试题(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)2022年辽宁高考真题化学试题变式题(选择题6-10)(已下线)考点01 物质的分类和转化(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江西省南昌十九中2023-2024学年高三上学期第一次月考化学试卷



