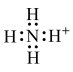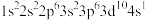名校
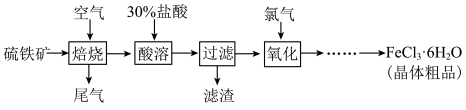
1 . 以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:___________ ,检验氧化生成的阳离子的试剂是___________ 。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气VL测定SO2含量:
方案一:让尾气缓慢通过以下装置。___________ ,该装置的作用是___________ 。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理___________ (填“是”或“否”)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①加入过量氯化钡溶液的目的是___________ 。
②进行沉淀洗涤的方法是___________ 。
③SO2含量的表达式是___________ (用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3·6H2O晶体的操作包括___________ 、冷却结晶、过滤,该过程需保持盐酸过量,抑制Fe3+水解。
(2)尾气中主要含N2、O2、SO2和少量的CO2、H2O,取标准状况下的尾气VL测定SO2含量:
方案一:让尾气缓慢通过以下装置。
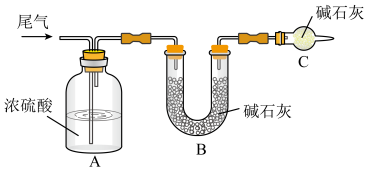
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①加入过量氯化钡溶液的目的是
②进行沉淀洗涤的方法是
③SO2含量的表达式是
(3)从FeCl3溶液中得到FeCl3·6H2O晶体的操作包括
您最近一年使用:0次
解题方法
2 . 化学是一门以实验为基础的学科,请根据下列实验回答相应问题。
Ⅰ.对重铬酸铵[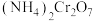 ,摩尔质量为252
,摩尔质量为252 ]的分解产物进行探究,按如图连接好装置,在A中加入2.52g样品进行实验。已知:铬元素常见化合价为+3和+6价。
]的分解产物进行探究,按如图连接好装置,在A中加入2.52g样品进行实验。已知:铬元素常见化合价为+3和+6价。_________ ,装置C的作用是______________________ 。
(2)加热A至恒重,观察到D中有无色气泡产生但溶液不变色,同时测得A、B中质量变化量分别为1.00g,0.72g,写出重铬酸铵加热分解反应的化学方程式:______________________ 。
Ⅱ.对含铬( )酸性工业废水的处理及检测进行如下探究。
)酸性工业废水的处理及检测进行如下探究。
(3)探究一:用铁电极电解处理含铬( )酸性工业废水。取水样500mL,加入适量的氯化钠,以铁为电极进行电解。电解一段时间后,铁电极质量减少了1.68g,此时废水中的
)酸性工业废水。取水样500mL,加入适量的氯化钠,以铁为电极进行电解。电解一段时间后,铁电极质量减少了1.68g,此时废水中的 刚好被除尽,[已知:电解过程中,电解池阳极区域发生的反应为
刚好被除尽,[已知:电解过程中,电解池阳极区域发生的反应为 (未配平)]并伴有
(未配平)]并伴有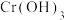 和
和 沉淀生成。
沉淀生成。
①铁作电极的目的为_______________________ 。
②水样中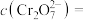
_________  。
。
③用平衡移动原理解释最终产生沉淀的原因:__________________ 。
(4)探究二:用 处理已知浓度含铬(
处理已知浓度含铬( )酸性工业废水。
)酸性工业废水。


 。
。
[已知 ]
]
①该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是_______ (填标号)。 将
将 转化并沉淀,调节溶液的pH=2时,确定
转化并沉淀,调节溶液的pH=2时,确定 刚好被除尽,此时
刚好被除尽,此时
____ (填“是”或“否”)沉淀完全,说明理由:______________________ 。(已知:溶液中离子浓度小于 时,可以认为该离子沉淀完全)
时,可以认为该离子沉淀完全)
Ⅰ.对重铬酸铵[
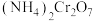 ,摩尔质量为252
,摩尔质量为252 ]的分解产物进行探究,按如图连接好装置,在A中加入2.52g样品进行实验。已知:铬元素常见化合价为+3和+6价。
]的分解产物进行探究,按如图连接好装置,在A中加入2.52g样品进行实验。已知:铬元素常见化合价为+3和+6价。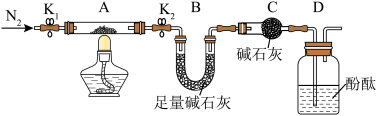
(2)加热A至恒重,观察到D中有无色气泡产生但溶液不变色,同时测得A、B中质量变化量分别为1.00g,0.72g,写出重铬酸铵加热分解反应的化学方程式:
Ⅱ.对含铬(
 )酸性工业废水的处理及检测进行如下探究。
)酸性工业废水的处理及检测进行如下探究。(3)探究一:用铁电极电解处理含铬(
 )酸性工业废水。取水样500mL,加入适量的氯化钠,以铁为电极进行电解。电解一段时间后,铁电极质量减少了1.68g,此时废水中的
)酸性工业废水。取水样500mL,加入适量的氯化钠,以铁为电极进行电解。电解一段时间后,铁电极质量减少了1.68g,此时废水中的 刚好被除尽,[已知:电解过程中,电解池阳极区域发生的反应为
刚好被除尽,[已知:电解过程中,电解池阳极区域发生的反应为 (未配平)]并伴有
(未配平)]并伴有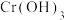 和
和 沉淀生成。
沉淀生成。①铁作电极的目的为
②水样中
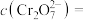
 。
。③用平衡移动原理解释最终产生沉淀的原因:
(4)探究二:用
 处理已知浓度含铬(
处理已知浓度含铬( )酸性工业废水。
)酸性工业废水。

 。
。[已知
 ]
]①该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是
A. 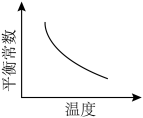 B.
B. 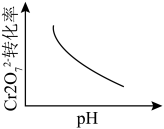 C.
C. 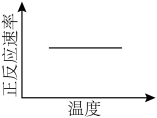 D.
D.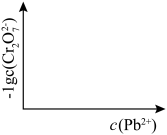
 将
将 转化并沉淀,调节溶液的pH=2时,确定
转化并沉淀,调节溶液的pH=2时,确定 刚好被除尽,此时
刚好被除尽,此时
 时,可以认为该离子沉淀完全)
时,可以认为该离子沉淀完全)
您最近一年使用:0次
解题方法
3 . 以 为原料制备甲烷、氢气等能源物质具有较好的发展前景。
为原料制备甲烷、氢气等能源物质具有较好的发展前景。
(1) 和
和 联合催化重整能减少温室气体的排放。其主要反应如下:
联合催化重整能减少温室气体的排放。其主要反应如下:
Ⅰ.

Ⅱ.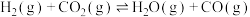
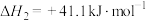
Ⅲ.

①
___________ 。
②其他条件相同,投料比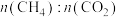 为1∶1.3时,不同温度下
为1∶1.3时,不同温度下 和
和 的转化率及
的转化率及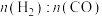 变化如图1。
变化如图1。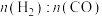 始终低于1.0的原因是
始终低于1.0的原因是___________________ 。 分解形成C的反应历程如图2所示。该历程分
分解形成C的反应历程如图2所示。该历程分________ 步进行,其中第__________ 步的正反应活化能最大。 和12mol
和12mol  ,在催化剂表面发生
,在催化剂表面发生 催化重整制
催化重整制 的主反应
的主反应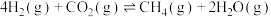 ,同时有副反应
,同时有副反应
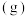 发生。初始压强为p,20min时反应都达到平衡状态,测得
发生。初始压强为p,20min时反应都达到平衡状态,测得 ,体系压强为
,体系压强为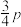 。
。
①0~20min内
_______  ,平衡时
,平衡时 选择性=
选择性=___________ (保留三位有效数字)。( 选择性
选择性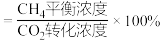 )
)
②副反应的平衡常数
__________ 。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
③催化剂上的反应过程如图3所示。其他条件不变时, 的转化率和
的转化率和 的选择性随温度变化如图4所示。
的选择性随温度变化如图4所示。 催化加氢制
催化加氢制 的最适合温度为
的最适合温度为_________ ,除提高反应速率外,该催化剂的最大优点是____________ 。
 为原料制备甲烷、氢气等能源物质具有较好的发展前景。
为原料制备甲烷、氢气等能源物质具有较好的发展前景。(1)
 和
和 联合催化重整能减少温室气体的排放。其主要反应如下:
联合催化重整能减少温室气体的排放。其主要反应如下:Ⅰ.


Ⅱ.
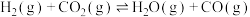
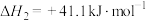
Ⅲ.


①

②其他条件相同,投料比
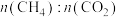 为1∶1.3时,不同温度下
为1∶1.3时,不同温度下 和
和 的转化率及
的转化率及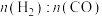 变化如图1。
变化如图1。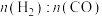 始终低于1.0的原因是
始终低于1.0的原因是
 分解形成C的反应历程如图2所示。该历程分
分解形成C的反应历程如图2所示。该历程分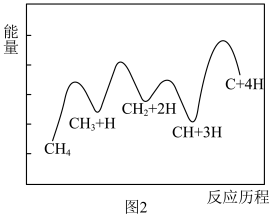
 和12mol
和12mol  ,在催化剂表面发生
,在催化剂表面发生 催化重整制
催化重整制 的主反应
的主反应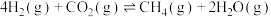 ,同时有副反应
,同时有副反应
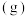 发生。初始压强为p,20min时反应都达到平衡状态,测得
发生。初始压强为p,20min时反应都达到平衡状态,测得 ,体系压强为
,体系压强为 。
。①0~20min内

 ,平衡时
,平衡时 选择性=
选择性= 选择性
选择性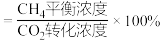 )
)②副反应的平衡常数

③催化剂上的反应过程如图3所示。其他条件不变时,
 的转化率和
的转化率和 的选择性随温度变化如图4所示。
的选择性随温度变化如图4所示。 催化加氢制
催化加氢制 的最适合温度为
的最适合温度为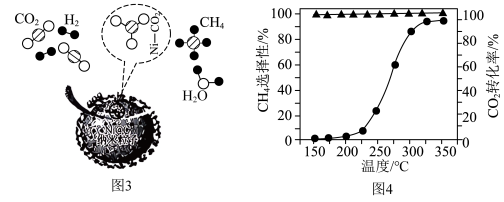
您最近一年使用:0次
4 . 某品牌净水器净水原理如图所示,当接通电源打开开关时,发现装自来水的烧杯中一电极附近迅速出现大量气泡,同时有绿色和红褐色浑浊物产生,而装纯净水的烧杯中没有任何变化。已知:常温下三种水样的电导率数据如表。
下列说法中正确的是

水样 | 自来水 | 蒸馏水 | 纯净水 |
电导率( | 639 | 44 | 2.2 |
| A.两烧杯中Al片作阳极,Fe片作阴极 |
| B.纯净水中加入食盐不会出现同样的产生浑浊和气泡的现象 |
C.自来水中出现的浑浊物可能含有 |
| D.如果水质电解器的电极都换成石墨电极,一定会出现同样的现象 |
您最近一年使用:0次
解题方法
5 . 冬季燃煤排放的大量活性溴化合物BrCl能通过光解释放溴自由基(用Br表示)和氯自由基(用Cl表示),从而影响大气中自由基(OH、 )的浓度,其循环原理如图所示。下列说法错误的是
)的浓度,其循环原理如图所示。下列说法错误的是
 )的浓度,其循环原理如图所示。下列说法错误的是
)的浓度,其循环原理如图所示。下列说法错误的是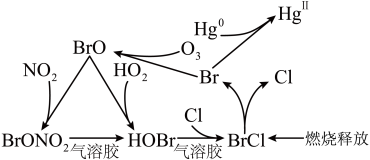
| A.BrCl可以与水反应生成HCl和HBrO | B.HOBr分子中中心原子采用 杂化 杂化 |
| C.溴自由基和氯自由基均具有强氧化性 | D.BrCl的排放会造成臭氧空洞、水中汞含量超标等 |
您最近一年使用:0次
6 . 合成伯胺的重要方法之一是Gabriel合成法,反应原理如图。下列有关说法正确的是

| A.Q和R都是手性分子 |
| B.物质S的同分异构体数目最多为4种 |
| C.物质P在NaOH的乙醇溶液中加热可以生成两种不同有机产物 |
| D.物质Q在酸性和碱性条件下水解的产物相同 |
您最近一年使用:0次
名校
7 . 回答下列问题
(1)现有以下物质:a.NaOH溶液,b.液氨,c.Ba(OH)2固体,d.NaHSO4,e.Fe(OH)3胶体,f.铜,g.CO2,h.CH3COOH。
①以上物质中属于电解质的是___________ (填字母)。
②写出d在熔融时的电离方程式:___________ 。
③在d的水溶液中加入过量c的水溶液,发生反应的离子方程式为___________ 。
(2)高锰酸钾(硫酸酸化)溶液和草酸溶液的反应可用于测定血钙的含量。方法是取2mL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体[化学式为(NH4)2C2O4],反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解后得到H2C2O4,再用KMnO4溶液滴定。
①高锰酸钾(硫酸酸化)溶液和草酸溶液的反应的化学方程式为:___________ ;
②用KMnO4溶液滴定H2C2O4时,判断滴定终点的方法是___________ 。
(3)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为___________ 。
(4)①钢铁在自然界中发生电化学腐蚀时的负极反应式为___________ ;
②碱性条件下,甲醇空气燃料电池的负极反应式为___________ 。
(1)现有以下物质:a.NaOH溶液,b.液氨,c.Ba(OH)2固体,d.NaHSO4,e.Fe(OH)3胶体,f.铜,g.CO2,h.CH3COOH。
①以上物质中属于电解质的是
②写出d在熔融时的电离方程式:
③在d的水溶液中加入过量c的水溶液,发生反应的离子方程式为
(2)高锰酸钾(硫酸酸化)溶液和草酸溶液的反应可用于测定血钙的含量。方法是取2mL血液用蒸馏水稀释后,向其中加入足量草酸铵晶体[化学式为(NH4)2C2O4],反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解后得到H2C2O4,再用KMnO4溶液滴定。
①高锰酸钾(硫酸酸化)溶液和草酸溶液的反应的化学方程式为:
②用KMnO4溶液滴定H2C2O4时,判断滴定终点的方法是
(3)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为
(4)①钢铁在自然界中发生电化学腐蚀时的负极反应式为
②碱性条件下,甲醇空气燃料电池的负极反应式为
您最近一年使用:0次
名校
8 . 化学与人类生产、生活密切相关,下列有关说法不正确的是
| A.氮化硅陶瓷和光导纤维都是无机非金属材料 |
| B.为测定熔融氢氧化钠导电性,常将氢氧化钠固体放在石英坩埚中加热熔化 |
| C.绚丽缤纷的烟花中添加了含钾、钠、钙、铜等金属元素的化合物 |
| D.燃料的脱硫脱氮、SO2的回收利用和NOx催化转化都是减少酸雨产生的措施 |
您最近一年使用:0次
解题方法
9 . 一种除草剂的结构如图,X、Y、Z、W、R为原子序数依次增大的短周期元素,Z与R同主族。下列有关说法正确的是
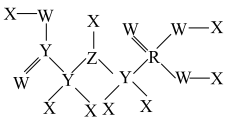
| A.Y、Z、W的电负性由大到小的顺序为W>Z>Y | B.最简单氢化物的稳定性:Z<R |
| C.X与W形成的化合物为非极性分子 | D.该分子不能与碱反应 |
您最近一年使用:0次

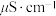 )
)