名校
解题方法
1 . 某化学兴趣小组用下图装置(部分夹持装置已略去)制取氨气并探究其性质。___________ 。
(2)装置B中物质是___________ ,气体通过装置C、D时,试纸颜色会发生变化的是___________ (填字母)。当装置E集满氨气时,挤压胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是___________ 。
(3)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。___________ ,证明氨气具有___________ (填“氧化性”或“还原性)。
若向a中通入标准状况下 的氨气,理论上会得到铜的质量为
的氨气,理论上会得到铜的质量为___________ g。
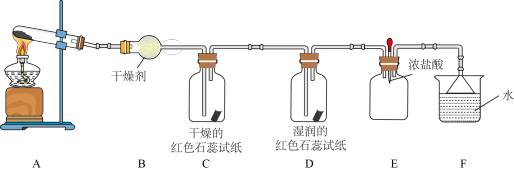
(2)装置B中物质是
(3)用下图装置探究氨气与氧化铜的反应,验证氨气的性质及部分反应产物。
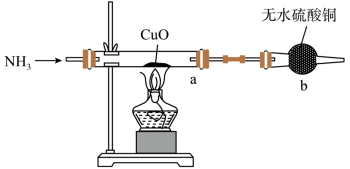
若向a中通入标准状况下
 的氨气,理论上会得到铜的质量为
的氨气,理论上会得到铜的质量为
您最近一年使用:0次
2 . 某小组用淀粉水解液和浓 (作催化剂)、
(作催化剂)、 为原料制取草酸晶体
为原料制取草酸晶体 ,进而制备纳米草酸钙
,进而制备纳米草酸钙 ,按如下流程开展实验(夹持仪器略):
,按如下流程开展实验(夹持仪器略):
①草酸能溶于水,易溶于乙醇;
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式: 。
。
请回答下列问题:
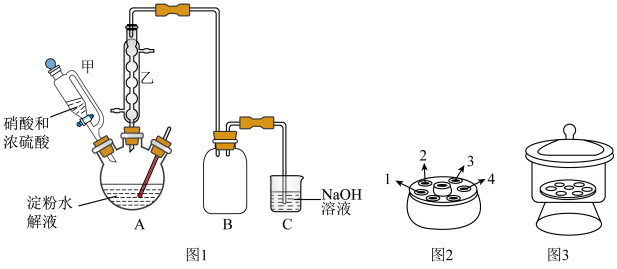
(1)仪器甲相比普通分液漏斗的优点是___________ ,步骤Ⅱ的操作名称是___________ 。
(2)NO不与 反应,但在本实验中可以完全被吸收,请用离子方程式表示NO被完全吸收的原因
反应,但在本实验中可以完全被吸收,请用离子方程式表示NO被完全吸收的原因___________ 。
(3)催化剂浓硫酸用量过多,会导致草酸产率减少,原因是___________ 。
(4)下列有关操作说法正确的是___________。
(5)草酸晶体 含有结晶水。
含有结晶水。
Ⅰ.甲同学通过如下实验测定其组成:
①配制标准氢氧化钠溶液。
②标定氢氧化钠溶液的浓度。
③滴定:准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用上述 标准溶液滴定。若草酸晶体中混有
标准溶液滴定。若草酸晶体中混有 ,则该滴定法测得产品中x的值
,则该滴定法测得产品中x的值___________ (填“偏大”“偏小”“无影响”)。
Ⅱ.乙同学取产品 ,加蒸馏水定容至
,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、 、
、 。假设其他杂质不干扰结果,产品中结晶水x为
。假设其他杂质不干扰结果,产品中结晶水x为___________ 。
 (作催化剂)、
(作催化剂)、 为原料制取草酸晶体
为原料制取草酸晶体 ,进而制备纳米草酸钙
,进而制备纳米草酸钙 ,按如下流程开展实验(夹持仪器略):
,按如下流程开展实验(夹持仪器略):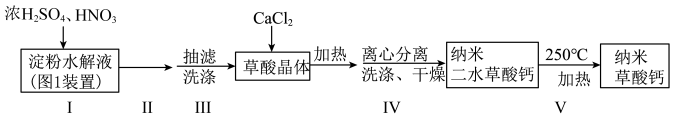
①草酸能溶于水,易溶于乙醇;
②纳米草酸钙难溶于水,高温易分解;
③淀粉水解液与混酸反应的方程式:
 。
。请回答下列问题:
(1)仪器甲相比普通分液漏斗的优点是
(2)NO不与
 反应,但在本实验中可以完全被吸收,请用离子方程式表示NO被完全吸收的原因
反应,但在本实验中可以完全被吸收,请用离子方程式表示NO被完全吸收的原因(3)催化剂浓硫酸用量过多,会导致草酸产率减少,原因是
(4)下列有关操作说法正确的是___________。
| A.步骤Ⅲ洗涤可用乙醇水溶液,步骤Ⅳ洗涤可用蒸馏水 |
| B.步骤Ⅳ采用离心分离,装置如图2所示,操作时应将两支离心管放置于1、4处 |
| C.步骤Ⅳ检验纳米二水草酸钙是否洗涤干净可用硝酸银溶液和稀硝酸 |
| D.步骤Ⅴ为提高反应速率,也可采用更高温度加热 |
(5)草酸晶体
 含有结晶水。
含有结晶水。Ⅰ.甲同学通过如下实验测定其组成:
①配制标准氢氧化钠溶液。
②标定氢氧化钠溶液的浓度。
③滴定:准确称取一定质量草酸晶体于锥形瓶中,用蒸馏水溶解,以酚酞作指示剂,用上述
 标准溶液滴定。若草酸晶体中混有
标准溶液滴定。若草酸晶体中混有 ,则该滴定法测得产品中x的值
,则该滴定法测得产品中x的值Ⅱ.乙同学取产品
 ,加蒸馏水定容至
,加蒸馏水定容至 摇匀,取
摇匀,取 于锥形瓶中,用
于锥形瓶中,用 酸性
酸性 标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为
标准溶液滴定。平行滴定三次,消耗标准溶液体积分别为 、
、 、
、 。假设其他杂质不干扰结果,产品中结晶水x为
。假设其他杂质不干扰结果,产品中结晶水x为
您最近一年使用:0次
名校
解题方法
3 . 为除去粗盐中的Ca2+、Mg2+、 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)______ 。
(2)第③步中,加入的试剂是______ (填化学式),判断该试剂已过量的方法是______ 。
(3)第③步和第②步______ (填“能”或“不能”)交换,原因是______ 。
(4)第④步中涉及反应的离子方程式______ 。
(5)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是______ 。
 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:(用于沉淀的试剂稍过量)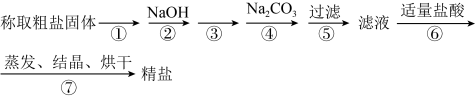
(2)第③步中,加入的试剂是
(3)第③步和第②步
(4)第④步中涉及反应的离子方程式
(5)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
您最近一年使用:0次
4 . 宏观辨识与微观探析是化学学科重要的学科素养。回答下列问题:
Ⅰ.已知某无色水样中只含有 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种。某化学研究性学习小组对该水样的成分进行检验:
中的若干种。某化学研究性学习小组对该水样的成分进行检验:
①取部分水样;
②向水样中滴加足量硝酸钡溶液,产生白色沉淀;
③向步骤②所得沉淀中滴加足量稀盐酸,沉淀部分溶解;
④向步骤③所得溶液中滴加硝酸银溶液,又产生白色沉淀。
(1)该水样中一定存在的离子是__________ (填离子符号,下同),可能存在的离子是__________ ,一定不存在的离子是__________ 。
(2)若要确定可能存在的离子是否存在,还需进行的实验操作是__________ 。
Ⅱ.现有 、
、 、
、 、
、 四种溶液,该小组同学设计如下实验步骤进行鉴别:
四种溶液,该小组同学设计如下实验步骤进行鉴别:
①取等体积的上述四种溶液A、B、C、D分别置于四支试管中,对四支试管均进行下列操作:加入过量的 溶液、加热,将湿润的红色石蕊试纸靠近试管口。观察到盛装B、D溶液的试管口的试纸变蓝。
溶液、加热,将湿润的红色石蕊试纸靠近试管口。观察到盛装B、D溶液的试管口的试纸变蓝。
②向①中反应后的四支试管中,分别依次加入足量 溶液,观察到盛装B、C溶液的试管内产生白色沉淀。
溶液,观察到盛装B、C溶液的试管内产生白色沉淀。
(3)溶液A、B、C、D中的溶质依次为__________ 、__________ 、__________ 、__________ (填化学式)。
(4)有同学提出用一种试剂即可将四种溶液鉴别出来,该试剂为__________ (填化学式)。
Ⅰ.已知某无色水样中只含有
 、
、 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的若干种。某化学研究性学习小组对该水样的成分进行检验:
中的若干种。某化学研究性学习小组对该水样的成分进行检验:①取部分水样;
②向水样中滴加足量硝酸钡溶液,产生白色沉淀;
③向步骤②所得沉淀中滴加足量稀盐酸,沉淀部分溶解;
④向步骤③所得溶液中滴加硝酸银溶液,又产生白色沉淀。
(1)该水样中一定存在的离子是
(2)若要确定可能存在的离子是否存在,还需进行的实验操作是
Ⅱ.现有
 、
、 、
、 、
、 四种溶液,该小组同学设计如下实验步骤进行鉴别:
四种溶液,该小组同学设计如下实验步骤进行鉴别:①取等体积的上述四种溶液A、B、C、D分别置于四支试管中,对四支试管均进行下列操作:加入过量的
 溶液、加热,将湿润的红色石蕊试纸靠近试管口。观察到盛装B、D溶液的试管口的试纸变蓝。
溶液、加热,将湿润的红色石蕊试纸靠近试管口。观察到盛装B、D溶液的试管口的试纸变蓝。②向①中反应后的四支试管中,分别依次加入足量
 溶液,观察到盛装B、C溶液的试管内产生白色沉淀。
溶液,观察到盛装B、C溶液的试管内产生白色沉淀。(3)溶液A、B、C、D中的溶质依次为
(4)有同学提出用一种试剂即可将四种溶液鉴别出来,该试剂为
您最近一年使用:0次
解题方法
5 . 硫酸四氨合铜晶体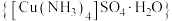 常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。
常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。
实验(一)制备 ,装置如图所示。
,装置如图所示。___________ 。该反应中浓硫酸表现出的性质有___________ 。
(2)持续反应一段时间后C装置中的现象为___________ 。
(3)将A装置中混合物缓慢倒入装有水的烧杯中,再加入过量的 ,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到
,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到 晶体。
晶体。
①不能向A装置的混合物中加入水,其原因是___________ 。
② 的作用是
的作用是___________ 。
实验(二)制备硫酸四氨合铜晶体。
 中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是
中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是___________ (写出离子方程式)。
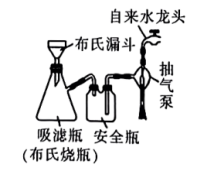
(5)相对普通过滤,利用图2装置分离晶体,其突出优点有___________ (答一条即可)。
实验(三)测定硫酸四氨合铜晶体纯度。
取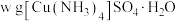 样品溶于蒸馏水配制成
样品溶于蒸馏水配制成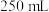 溶液,准确量取
溶液,准确量取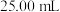 配制溶液,滴加适量的稀硫酸,充分反应。加入过量
配制溶液,滴加适量的稀硫酸,充分反应。加入过量 溶液,滴加3滴淀粉溶液,用
溶液,滴加3滴淀粉溶液,用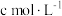
 溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗
溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗 溶液
溶液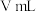 。相关反应:
。相关反应: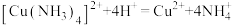 ,
, ,
,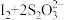
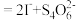 。
。
(6)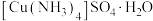 产品的纯度为
产品的纯度为___________ 。若①摇动锥形瓶时间过长,空气进入较多;②滴加稀硫酸过多,则上述两种情况可能会导致测得结果___________ (填字母)。(已知: 在酸性条件下不稳定,会发生歧化反应)
在酸性条件下不稳定,会发生歧化反应)
A.①偏高 ②偏低 B.①偏低 ②偏高 C.①偏高 ②偏高 D.①偏低 ②偏低
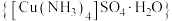 常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。
常作杀虫剂、媒染剂。某小组设计实验制备硫酸四氨合铜晶体并测定其纯度。实验(一)制备
 ,装置如图所示。
,装置如图所示。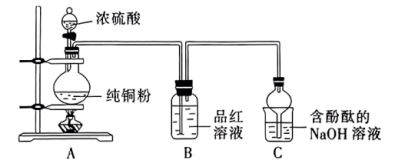
(2)持续反应一段时间后C装置中的现象为
(3)将A装置中混合物缓慢倒入装有水的烧杯中,再加入过量的
 ,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到
,充分反应后,过滤。将滤液蒸发浓缩、降温结晶、过滤,得到 晶体。
晶体。①不能向A装置的混合物中加入水,其原因是
②
 的作用是
的作用是实验(二)制备硫酸四氨合铜晶体。
| 步骤 | 实验操作及主要现象 |
 | 取一定量 晶体溶于蒸馏水得到 晶体溶于蒸馏水得到 溶液 溶液 |
 | 向步骤 溶液中滴加一定量的氨水,产生蓝色沉淀;继续滴加氨水,蓝色沉淀逐渐溶解,最终得到深蓝色的透明溶液 溶液中滴加一定量的氨水,产生蓝色沉淀;继续滴加氨水,蓝色沉淀逐渐溶解,最终得到深蓝色的透明溶液 |
 | 向步骤 所得溶液中滴加 所得溶液中滴加 的乙醇,静置析出深蓝色晶体,用下图装置过滤 的乙醇,静置析出深蓝色晶体,用下图装置过滤 |
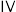 | 取步骤 中晶体,用乙醇与浓氨水的混合液洗涤,再用乙醇与乙醚的混合液淋洗,然后将其在 中晶体,用乙醇与浓氨水的混合液洗涤,再用乙醇与乙醚的混合液淋洗,然后将其在 左右小心烘干,得到 左右小心烘干,得到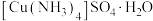 |
 中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是
中蓝色沉淀溶解得到深蓝色的透明溶液,其原因是(5)相对普通过滤,利用图2装置分离晶体,其突出优点有
实验(三)测定硫酸四氨合铜晶体纯度。
取
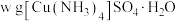 样品溶于蒸馏水配制成
样品溶于蒸馏水配制成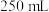 溶液,准确量取
溶液,准确量取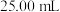 配制溶液,滴加适量的稀硫酸,充分反应。加入过量
配制溶液,滴加适量的稀硫酸,充分反应。加入过量 溶液,滴加3滴淀粉溶液,用
溶液,滴加3滴淀粉溶液,用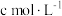
 溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗
溶液滴定,边滴边摇动锥形瓶至滴定终点,消耗 溶液
溶液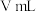 。相关反应:
。相关反应: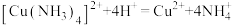 ,
, ,
,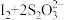
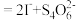 。
。(6)
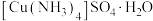 产品的纯度为
产品的纯度为 在酸性条件下不稳定,会发生歧化反应)
在酸性条件下不稳定,会发生歧化反应)A.①偏高 ②偏低 B.①偏低 ②偏高 C.①偏高 ②偏高 D.①偏低 ②偏低
您最近一年使用:0次
6 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:___________ 性。从硫元素化合价变化的角度分析,图中只有还原性的物质有___________ (填化学式)。
(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小明认为可能是___________ 。小王觉得可以设计实验验证这一推论,具体操作是___________ 。
(3)配平下列反应:___________ 。
___________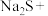 ___________
___________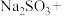 ___________
___________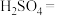 ___________
___________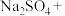 ___________
___________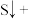 ___________
___________
(4)一种铁基脱硫剂脱除硫化氢( )的方法包括吸收和再生两个阶段,其工艺流程原理如下:
)的方法包括吸收和再生两个阶段,其工艺流程原理如下:___________ 写出“再生”的反应的离子方程式:___________ 。
②当吸收224 mL(标准状况) 时,若要保持脱硫液中
时,若要保持脱硫液中 的物质的量不变,则所通入的氧气的体积为
的物质的量不变,则所通入的氧气的体积为___________ mL。

(2)收集了一些含有S元素的酸雨,放置一段时间后,pH变小,小明认为可能是
(3)配平下列反应:
___________
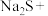 ___________
___________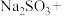 ___________
___________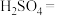 ___________
___________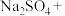 ___________
___________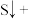 ___________
___________
(4)一种铁基脱硫剂脱除硫化氢(
 )的方法包括吸收和再生两个阶段,其工艺流程原理如下:
)的方法包括吸收和再生两个阶段,其工艺流程原理如下:
②当吸收224 mL(标准状况)
 时,若要保持脱硫液中
时,若要保持脱硫液中 的物质的量不变,则所通入的氧气的体积为
的物质的量不变,则所通入的氧气的体积为
您最近一年使用:0次
解题方法
7 . 海洋资源的利用具有非常广阔的前景。回答下列问题:
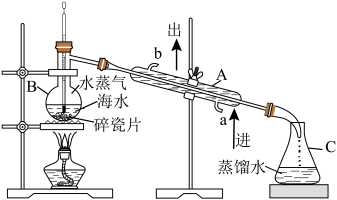
(1)实验室模拟蒸馏法淡化海水如图所示,应向蒸馏烧瓶中加入沸石,目的是___________ 。下述装置图中有___________ 处错误。 、
、 、
、 ,要除去这些杂质离子得到精盐水,加入以下试剂的顺序可为
,要除去这些杂质离子得到精盐水,加入以下试剂的顺序可为___________ (填字母,可重复选用)。
a.NaOH溶液 b. 溶液 c.
溶液 c. 溶液 d.盐酸
溶液 d.盐酸
(3)根据以下数据分析,为什么冶炼镁时选择氯化镁,而冶炼铝时却选择氧化铝?
理由:___________ 。
(4)从海水中提取溴的工业过程如下图所示: .写出步骤②中苦卤(NaBr)被氯气氧化的化学反应方程式
.写出步骤②中苦卤(NaBr)被氯气氧化的化学反应方程式___________ 。
 .请写出步骤④反应的离子方程式:
.请写出步骤④反应的离子方程式:___________ 。
 .上述过程中步骤③④⑤的目的是
.上述过程中步骤③④⑤的目的是___________ 。
(1)实验室模拟蒸馏法淡化海水如图所示,应向蒸馏烧瓶中加入沸石,目的是
 、
、 、
、 ,要除去这些杂质离子得到精盐水,加入以下试剂的顺序可为
,要除去这些杂质离子得到精盐水,加入以下试剂的顺序可为a.NaOH溶液 b.
 溶液 c.
溶液 c. 溶液 d.盐酸
溶液 d.盐酸(3)根据以下数据分析,为什么冶炼镁时选择氯化镁,而冶炼铝时却选择氧化铝?
| 物质 | MgO |  |  |  |
| 熔点/℃ | 2852 | 2054 | 714 | 190 |
(4)从海水中提取溴的工业过程如下图所示:

 .写出步骤②中苦卤(NaBr)被氯气氧化的化学反应方程式
.写出步骤②中苦卤(NaBr)被氯气氧化的化学反应方程式 .请写出步骤④反应的离子方程式:
.请写出步骤④反应的离子方程式: .上述过程中步骤③④⑤的目的是
.上述过程中步骤③④⑤的目的是
您最近一年使用:0次
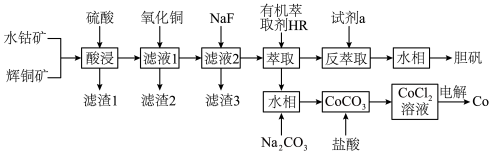
8 . 以水钴矿(Co2O3·H2O,含Fe2O3、MgO、CaO)和辉铜矿(Cu2S,含SiO2、Fe2O3)为原料制取胆矾和单质钴。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
③萃取Cu2+的反应原理;Cu2++2HR CuR2+2H+;
CuR2+2H+;
④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于___________ 。
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为___________ g(忽略溶液体积的变化)。
(5)“反萃取”步骤中加入的“试剂a”为___________ 。
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是___________ 。
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶1∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为___________ 。
①常温下,Ksp(MgF2)=6.25×10-9,Ksp(CaSO4)=7.1×10-7,Ksp(CoCO3)=2.4×10-7;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Cu2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 2.7 | 7.5 | 7.6 | 4.7 |
| 完全沉淀时(c=10-5mol/L)的pH | 3.7 | 9.0 | 9.1 | 6.2 |
 CuR2+2H+;
CuR2+2H+;④Mg、Ca、Fe、Co均能与强酸反应产生H2。
回答下列问题:
(1)“酸浸”过程硫元素价态变为+6价,写出“酸浸”过程中主要反应的化学方程式:
(2)“滤渣1”的主要成分为
(3)常温下,“滤液1”中(Fe元素都以Fe3+形式存在)加“氧化铜”调pH不小于
(4)常温下,若“滤液2”中c(Mg2+)=0.015mol/L(忽略溶液中极少量的Ca2+),除去2L“滤液2”中的Mg2+,至少需加入NaF固体的质量为
(5)“反萃取”步骤中加入的“试剂a”为
(6)采用惰性电极电解CoCl2溶液﹑在无离子交换膜的条件下,不能用CoSO4溶液代替CoCl2溶液的理由是
(7)将制得的胆矾配成溶液,先加入足量氨水,得到深蓝色溶液,再通入SO2至弱酸性,生成白色沉淀。经仪器分析:白色沉淀含H、N,O、S、Cu五种元素,且Cu∶N∶S=1∶1∶l;所含Cu离子中无单电子;晶体的部分组成微粒的空间构型分别为三角锥形和正四面体形。则白色沉淀的化学式为
您最近一年使用:0次
解题方法
9 . 四氯化锡( )是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
)是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
回答下列问题:
(1)“仪器a”的名称是___________ ,A中反应的离子方程式为___________ 。
(2)实验前应进行的操作是___________ ,实验开始时,应先点燃___________ (填“A”或“D”)处的酒精灯。
(3)若无“洗气瓶B”,可能会导致的问题是___________ 。
(4)实验结束后,“小试管b”内收集到的液体呈淡黄色,其原因是___________ 。
(5)“洗气瓶F”中所盛放的药品是___________ 。
 )是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。
)是一种重要的化工原料,主要用于有机锡化合物的制造,可由锡单质与氯气在加热时化合生成,某实验小组用如下装置对其进行制备。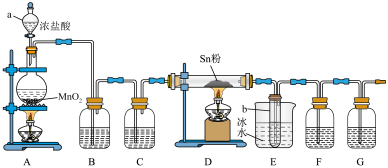
| 药品 | 颜色、状态 | 熔点(℃) | 沸点(℃) | 其他性质 |
| Sn | 银白色固体 | 231 | 2260 | 较活泼金属能与 、HCl等气体发生反应 、HCl等气体发生反应 |
 | 无色液体 | ﹣33 | 114 | 极易与水反应产生 溶胶 溶胶 |
(1)“仪器a”的名称是
(2)实验前应进行的操作是
(3)若无“洗气瓶B”,可能会导致的问题是
(4)实验结束后,“小试管b”内收集到的液体呈淡黄色,其原因是
(5)“洗气瓶F”中所盛放的药品是
您最近一年使用:0次
名校
解题方法
10 . 探究配制不同金属离子—氨配体溶液的差异性,实验操作及现象如下:
资料:①饱和氨水的浓度约为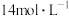
② 为浅青色沉淀
为浅青色沉淀
③ 溶液为红色,在活性炭催化下转化为橙黄色的
溶液为红色,在活性炭催化下转化为橙黄色的 溶液
溶液
(1)实验i-a中生成蓝色沉淀的离子方程式为___________ 。
(2)有研究认为蓝色沉淀中还有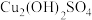 成分,其可以溶于稀酸。检验蓝色沉淀中不止含
成分,其可以溶于稀酸。检验蓝色沉淀中不止含 的实验操作为:将蓝色沉淀过滤,充分洗涤后,
的实验操作为:将蓝色沉淀过滤,充分洗涤后,___________ 。(填后续操作和现象)
(3)对比实验i-a和实验i-b,从平衡移动角度,结合化学用语解释 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因___________ 。
(4)对比实验i-a和实验i-c中再加入过量氨水前的反应,推测 对
对 生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。
生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。___________ ,c=___________ 。
②实验现象是___________ 。
(5)从平衡移动角度,结合化学用语,解释 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因___________ 。
(6)针对实验ii未能成功配制 溶液,结合以上分析,提出改进方案:
溶液,结合以上分析,提出改进方案:
①在实验ii-a的基础上继续加入___________ ,即可成功配制。
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为:___________ 。
(7)综合以上分析,配制不同金属离子—氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、___________ 。
| 实验序号 | 操作 | 现象 | |
实验i: 的配制 的配制 | 实验i-a | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的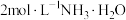 | 产生蓝色沉淀,加入 后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 后沉淀少部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 |
| 实验i-b | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的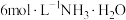 | 产生蓝色沉淀,加入 后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 后沉淀大部分溶解,溶液变浑浊,静置后上层为深蓝色溶液。 | |
| 实验i-c | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的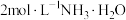 | 产生蓝色沉淀,加入 后沉淀完全溶解,得到澄清的深蓝色溶液。 后沉淀完全溶解,得到澄清的深蓝色溶液。 | |
实验ii: 的配制 的配制 | 实验ii-a | 在试管内混合 溶液和过量 溶液和过量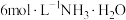 | 得到浅青色沉淀,沉淀未见明显溶解。 |
| 实验ii-b | 在试管内混合 溶液和过量 溶液和过量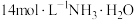 | 得到浅青色沉淀,沉淀未见明显溶解。 | |
实验iii: 的配制 的配制 | 实验iii | 在试管内混合 溶液和 溶液和 溶液,再加入过量的 溶液,再加入过量的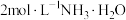 | 产生白色沉淀,加入 后沉淀完全溶解,得到无色溶液。 后沉淀完全溶解,得到无色溶液。 |
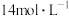
②
 为浅青色沉淀
为浅青色沉淀③
 溶液为红色,在活性炭催化下转化为橙黄色的
溶液为红色,在活性炭催化下转化为橙黄色的 溶液
溶液(1)实验i-a中生成蓝色沉淀的离子方程式为
(2)有研究认为蓝色沉淀中还有
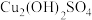 成分,其可以溶于稀酸。检验蓝色沉淀中不止含
成分,其可以溶于稀酸。检验蓝色沉淀中不止含 的实验操作为:将蓝色沉淀过滤,充分洗涤后,
的实验操作为:将蓝色沉淀过滤,充分洗涤后,(3)对比实验i-a和实验i-b,从平衡移动角度,结合化学用语解释
 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因(4)对比实验i-a和实验i-c中再加入过量氨水前的反应,推测
 对
对 生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。
生成有一定促进作用。设计下图所示实验:在1、2试管内分别完成对实验i-a的重复,再分别加入不同试剂。实验现象证实了预测。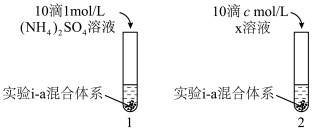
②实验现象是
(5)从平衡移动角度,结合化学用语,解释
 对
对 生成有一定促进作用的原因
生成有一定促进作用的原因(6)针对实验ii未能成功配制
 溶液,结合以上分析,提出改进方案:
溶液,结合以上分析,提出改进方案:①在实验ii-a的基础上继续加入
②验证配制成功的操作及实验现象是:取①的上层红色清液,加入少许活性炭振荡试管,溶液转为橙黄色,反应的离子方程式为:
(7)综合以上分析,配制不同金属离子—氨配体溶液的难易程度存在差异性,推测可能与以下因素有关:配位数、
您最近一年使用:0次
昨日更新
|
207次组卷
|
2卷引用:北京市昌平区2023-2024学年高三下学期二模化学试题



