名校
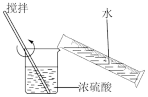
1 . 实验装置不能达到实验目的的是
| A | B | C | D |
|
|
|
|
| 稀释浓硫酸 | 制备并检验 气体 气体 | 用该装置制备少量白色的 沉淀 沉淀 | 吸收NO中的 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2021-12-30更新
|
887次组卷
|
12卷引用:湖南省绥宁县第一中学2022-2023学年高一下学期学科知识竞赛化学试题
湖南省绥宁县第一中学2022-2023学年高一下学期学科知识竞赛化学试题(已下线)仿真卷02-【小题小卷】冲刺2023年高考化学小题限时集训(新高考专用)(已下线)化学(人教版2019B卷)-学易金卷:2022-2023学年高一下学期期中考前必刷卷河南省驻马店市2022-2023学年高一下学期4月期中考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期5月期中考试化学试题安徽省安庆市第九中学2022-2023学年高一下学期期中考试化学试题福建省厦门第一中学2021-2022学年高一上学期12月月考化学试题(已下线)解密11 化学实验(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)湖北省襄阳市第一中学2021-2022学年高一下学期3月月考化学试题山西省榆次第一中学校2021-2022学年高一下学期期中线上测试化学试题辽宁省东北师范大学连山实验高中2021-2022学年高一下学期第一次线上考试化学试题陕西省咸阳市三原县北城中学2023-2024学年高一下学期第一次月考化学试题
2 . 研究性学习小组设计了如下图所示实验装置(部分夹持装置已省略)制备NO,并进行NO的检验和性质探究实验。

已知:NO在 溶液中发生反应
溶液中发生反应 (棕色),该反应可以用于检验NO。
(棕色),该反应可以用于检验NO。
(1)仪器a的名称是_______ 。装置A内发生主要反应的离子方程式为_______ 。
(2)实验开始前,向装置中通入一段时间 的目的是
的目的是_______ 。
(3)装置B、C中蒸馏水和无水 的作用分别是
的作用分别是_______ 、_______ 。
(4)装置D中Fe粉与NO以物质的量之比 发生反应,生成
发生反应,生成 和另一种固体产物。该固体产物的化学式为
和另一种固体产物。该固体产物的化学式为_______ 。
(5)进行实验时,装置E中的实验现象为_______ 。

已知:NO在
 溶液中发生反应
溶液中发生反应 (棕色),该反应可以用于检验NO。
(棕色),该反应可以用于检验NO。(1)仪器a的名称是
(2)实验开始前,向装置中通入一段时间
 的目的是
的目的是(3)装置B、C中蒸馏水和无水
 的作用分别是
的作用分别是(4)装置D中Fe粉与NO以物质的量之比
 发生反应,生成
发生反应,生成 和另一种固体产物。该固体产物的化学式为
和另一种固体产物。该固体产物的化学式为(5)进行实验时,装置E中的实验现象为
您最近一年使用:0次
名校
3 . 某化学兴趣小组模拟“侯氏制碱法”制纯碱并进行后续实验。
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。
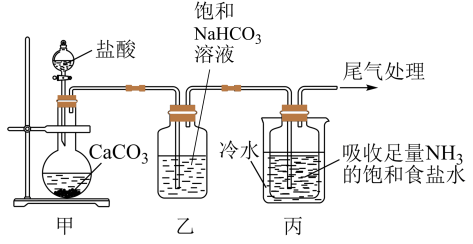
(1)装置乙的作用是_______ ,反应的化学方程式为_______ 。
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为____ 。
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤、_______ ,最后一步发生反应的化学方程式为_______ 。
II.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:
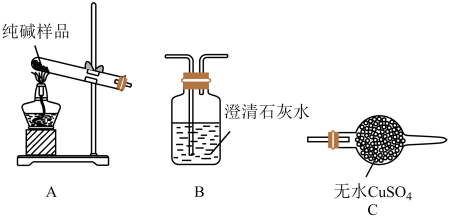
(5)测定该纯碱样品的纯度:称取m1g样品,置于小烧杯中,加水溶解,滴加足量CaCl2溶液。将反应混合物过滤、洗涤、干燥、称量,得到固体的质量为m2g。则该纯碱样品的纯度为_______ 。请另设计一个实验方案,测定纯碱样品的纯度(样品中只含有NaHCO3杂质)_______ 。
I.制备纯碱:先以NaCl、NH3、CO2和水等为原料,用下图所示装置制取NaHCO3,然后再将NaHCO3制备成Na2CO3。

(1)装置乙的作用是
(2)反应进行一段时间后,观察到装置丙中试剂瓶内溶液中有白色固体析出,经检验该白色固体是NaHCO3。装置丙中可得两种产物,分别是NaHCO3和另一种盐,装置丙中反应的化学方程式为
(3)用装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤、
II.测定所得产品的组成和纯度
(4)检验纯碱样品中是否混有NaHCO3,请选择下列装置设计实验,并完成下表:

| 选择的装置(填编号) | 实验现象 | 实验结论 |
| 样品中含NaHCO3 |
您最近一年使用:0次
2022-08-21更新
|
474次组卷
|
2卷引用:甘肃省天水市2023-2024学年高一上学期10月份化学竞赛试卷
解题方法
4 . 根据下列操作及现象,能达到目的是
| 选项 | 操作及现象 | 实验目的 |
| A | 向20mLNa2CO3和NaOH混合溶液中,滴入几滴酚酞试液,用0.1000mol/L盐酸标准溶液滴定至粉红色 | 测定NaOH的浓度 |
| B | 向溶有SO2的BaCl2溶液中加入Fe(NO3)3溶液,有白色沉淀生成 | 说明 具有强氧化性 具有强氧化性 |
| C | 向5mL0.1mol/LKI溶液中滴加1mL0.1mol/LFeCl3溶液,充分反应后再滴加少量KSCN溶液,溶液变红 | 证明KI与FeCl3的反应属于可逆反应 |
| D | 分别向2mL乙醇和乙二醇中加入一粒绿豆大小的金属钠,乙二醇产生气泡的速度更快 | 证明乙二醇中羟基数目多 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
5 . 为了研究不同浓度硝酸的性质,某小组设计了如下实验(固定装置和尾气处理装置略)。
(1)实验I中氧化剂和还原剂的物质的量之比是多少______ ?
(2)对实验I和实验II发生不同反应的原因提出如下解释:
①极稀的硝酸与金属锌反应时无气体产生,写出此时生成的硝酸盐的化学式______ 。
②浓硝酸具有较强的氧化性,可将NO转化为 ,请写出其反应的化学方程式
,请写出其反应的化学方程式______ 。
(3)对实验I所得溶液呈绿色,而实验II所得溶液呈蓝色的原因提出猜想:
查阅资料:i. 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;
ii. 。
。 是弱酸,不稳定。
是弱酸,不稳定。
猜想一: 溶于浓硝酸,与蓝色溶液混合而呈现绿色。
溶于浓硝酸,与蓝色溶液混合而呈现绿色。
猜想二: 电离出的
电离出的 与
与 结合为绿色的
结合为绿色的 。
。
①向浓硝酸中先通入 ,再滴加少量蓝色
,再滴加少量蓝色 溶液,证实猜想一合理。上述两步操作所得溶液的颜色分别为
溶液,证实猜想一合理。上述两步操作所得溶液的颜色分别为_______ 、_______ 。
②向蒸馏水中通入 得到无色溶液,向其中滴加蓝色的
得到无色溶液,向其中滴加蓝色的 溶液,溶液变为绿色,再滴加少量硝酸,结果溶液由绿色又变为蓝色。由此推出,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,请说明理由
溶液,溶液变为绿色,再滴加少量硝酸,结果溶液由绿色又变为蓝色。由此推出,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,请说明理由______ 。
(4)金可溶于王水(浓盐酸和浓硝酸按体积比3:1混合而成)生成 ,同时产生无色气体(露置在空气中变为红棕色),请写出该反应的化学方程式
,同时产生无色气体(露置在空气中变为红棕色),请写出该反应的化学方程式______ ,并分析该反应不直接生成 的原因
的原因______ 。
| 装置 | 编号 | 试剂a | 现象 |
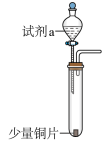 | I | 4mL浓硝酸(过量) | 铜片完全溶解,溶液变绿,出现大量红棕色气体 |
| II | 4mL稀硝酸(过量) | 铜片完全溶解,溶液变蓝,液面上方气体呈浅红棕色 |
(2)对实验I和实验II发生不同反应的原因提出如下解释:
①极稀的硝酸与金属锌反应时无气体产生,写出此时生成的硝酸盐的化学式
②浓硝酸具有较强的氧化性,可将NO转化为
 ,请写出其反应的化学方程式
,请写出其反应的化学方程式(3)对实验I所得溶液呈绿色,而实验II所得溶液呈蓝色的原因提出猜想:
查阅资料:i.
 溶于浓硝酸后呈黄色;
溶于浓硝酸后呈黄色;ii.
 。
。 是弱酸,不稳定。
是弱酸,不稳定。猜想一:
 溶于浓硝酸,与蓝色溶液混合而呈现绿色。
溶于浓硝酸,与蓝色溶液混合而呈现绿色。猜想二:
 电离出的
电离出的 与
与 结合为绿色的
结合为绿色的 。
。①向浓硝酸中先通入
 ,再滴加少量蓝色
,再滴加少量蓝色 溶液,证实猜想一合理。上述两步操作所得溶液的颜色分别为
溶液,证实猜想一合理。上述两步操作所得溶液的颜色分别为②向蒸馏水中通入
 得到无色溶液,向其中滴加蓝色的
得到无色溶液,向其中滴加蓝色的 溶液,溶液变为绿色,再滴加少量硝酸,结果溶液由绿色又变为蓝色。由此推出,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,请说明理由
溶液,溶液变为绿色,再滴加少量硝酸,结果溶液由绿色又变为蓝色。由此推出,猜想二不是实验Ⅰ所得溶液呈绿色的主要原因,请说明理由(4)金可溶于王水(浓盐酸和浓硝酸按体积比3:1混合而成)生成
 ,同时产生无色气体(露置在空气中变为红棕色),请写出该反应的化学方程式
,同时产生无色气体(露置在空气中变为红棕色),请写出该反应的化学方程式 的原因
的原因
您最近一年使用:0次
名校
解题方法
6 . 实验室模拟制备亚硝酰硫酸(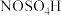 )的反应装置如图所示。已知:亚硝酰硫酸溶于硫酸,遇水易分解。下列说法错误的是
)的反应装置如图所示。已知:亚硝酰硫酸溶于硫酸,遇水易分解。下列说法错误的是
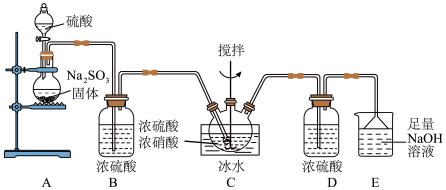
 )的反应装置如图所示。已知:亚硝酰硫酸溶于硫酸,遇水易分解。下列说法错误的是
)的反应装置如图所示。已知:亚硝酰硫酸溶于硫酸,遇水易分解。下列说法错误的是
| A.装置A中应使用70%的浓硫酸 |
| B.装置B、D中浓硫酸作用不同 |
C.装置C中反应为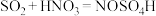 |
| D.D装置可以换为盛有碱石灰的干燥管 |
您最近一年使用:0次
7 . 用图1所示装置向装有一瓶氯气的集气瓶中添加适量的蒸馏水,振荡,先利用注射器滴加 溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法正确的是
溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法正确的是
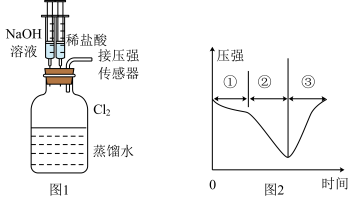
 溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法正确的是
溶液,再利用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。下列说法正确的是
| A.阶段①说明氯气溶于水,溶于水的氯气全部与水反应 |
| B.阶段②的压强变小,可利用该过程发生的反应制备漂白粉 |
C.阶段③发生反应的离子方程式为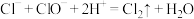 |
D.若将 换成 换成 ,则压强变化不会出现图2趋势 ,则压强变化不会出现图2趋势 |
您最近一年使用:0次
2023-11-15更新
|
440次组卷
|
2卷引用:广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试
名校
解题方法
8 . 醋酸亚铬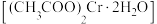 为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一股制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬:二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。某同学将过量锌粒和
为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一股制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬:二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。某同学将过量锌粒和 固体置于c中,加入少量蒸馏水,按下图连接好装置,下列说法
固体置于c中,加入少量蒸馏水,按下图连接好装置,下列说法错误 的是
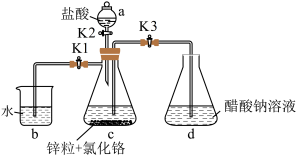
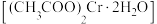 为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一股制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬:二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。某同学将过量锌粒和
为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一股制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬:二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。某同学将过量锌粒和 固体置于c中,加入少量蒸馏水,按下图连接好装置,下列说法
固体置于c中,加入少量蒸馏水,按下图连接好装置,下列说法
| A.实验中所用蒸馏水均需经煮沸后迅速冷却 |
B.实验开始时,应先打开 ,再打开 ,再打开 |
| C.d装置中析出砖红色沉淀后,应用冰水冷却后再过滤 |
| D.该同学的制备方法并不能保证得到纯净的醋酸亚铬 |
您最近一年使用:0次
2023-10-13更新
|
907次组卷
|
5卷引用:广东省广州市黄广中学2023-2024学年高一上学期化学竞赛选拔考试
解题方法
9 . “消洗灵”是具有消毒、杀菌、漂白和洗涤等综合功效的固体粉末,消毒原理与“84消毒液”相似,化学组成可以表示为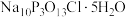 (磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
(磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
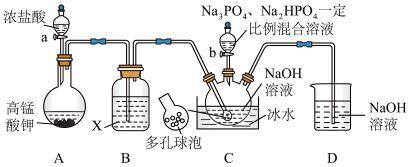
回答下列问题:
(1)①写出X试剂的名称______________ 。
②写出C中采用多孔球泡的目的______________ 。
③写出D装置的作用______________ 。
(2)打开仪器a的活塞及弹簧夹K,制备 碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
① “一系列操作”包括___________ 、___________ 、过滤、洗涤、低温干燥。
②若C中的 与
与 按物质的量之比
按物质的量之比 混合,写出C中制备“消洗灵”的总反应的化学方程式
混合,写出C中制备“消洗灵”的总反应的化学方程式______________ 。
③若生成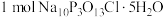 ,写出理论上至少消耗
,写出理论上至少消耗 的物质的量
的物质的量______________ 。
(3)“消洗灵”消毒时对金属腐蚀性小,原因是成分中的磷酸钠与空气共同作用,在金属表面形成不溶性磷酸盐膜,对金属具有良好的保护作用。写出用“消洗灵”对镁合金消毒,形成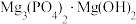 保护层的反应的化学方程式
保护层的反应的化学方程式______________ 。
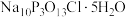 (磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
(磷酸三钠次氯酸钠)。某兴趣小组制备“消洗灵”的装置如图所示(夹持装置已略去):
回答下列问题:
(1)①写出X试剂的名称
②写出C中采用多孔球泡的目的
③写出D装置的作用
(2)打开仪器a的活塞及弹簧夹K,制备
 碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。
碱性溶液;关闭仪器a的活塞及弹簧夹K,打开装置C中滴液漏斗活塞;一段时间后,取出装置C中溶液,经“一系列操作”,得到粗产品。① “一系列操作”包括
②若C中的
 与
与 按物质的量之比
按物质的量之比 混合,写出C中制备“消洗灵”的总反应的化学方程式
混合,写出C中制备“消洗灵”的总反应的化学方程式③若生成
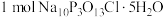 ,写出理论上至少消耗
,写出理论上至少消耗 的物质的量
的物质的量(3)“消洗灵”消毒时对金属腐蚀性小,原因是成分中的磷酸钠与空气共同作用,在金属表面形成不溶性磷酸盐膜,对金属具有良好的保护作用。写出用“消洗灵”对镁合金消毒,形成
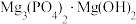 保护层的反应的化学方程式
保护层的反应的化学方程式
您最近一年使用:0次
名校
解题方法
10 . 下列实验操作或装置(略去部分夹持仪器)正确的是
 | 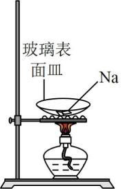 | 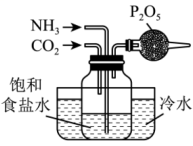 |  |
A.制取少量 | B.钠的燃烧 | C.制备 | D.配制一定物质的量浓度的溶液 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-12-27更新
|
1081次组卷
|
12卷引用:安徽省示范高中培优联盟2022-2023学年高二下学期联赛化学试题
安徽省示范高中培优联盟2022-2023学年高二下学期联赛化学试题湖南省百校2023届高三开年摸底联考化学试题(已下线)山东省青岛市2023届高三下学期一模化学试题变式题(选择题6-10)广东省广州市等5地广州百师信息科技有限公司等2校2022-2023学年高三下学期开学考试化学试题山东省蒙阴第一中学等5校2023届高三开学摸底联考化学试题河北省部分重点高中2023-2024学年高三上学期第一次综合素养测评化学试题广东省河源中学2023-2024学年上学期高三年级一调考试化学试题河北省衡水中学2023-2024学年高三上学期一调考试化学试题河北省石家庄市部分名校2024届高三上学期一调考试化学试题 安徽省合肥市第一中学2023-2024学年高一上学期素质拓展训练(四)化学试题黑龙江省实验中学2023-2024学年高一上学期第二次阶段测试化学试题山东省潍坊市2022年12月高三优生学习质量检测化学试题