1 . 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是_______________ 。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是______________________________ ,可能观察到的现象是溶液由浅绿色变为________ 色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选_________ 滴入小明所得的混合液中,并通过溶液出现______ 色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为__________ (填化学式)。
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是______ ,相关反应的离子方程式是_____________ 。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是
您最近一年使用:0次
2018-05-06更新
|
434次组卷
|
7卷引用:作业(十八) 铁盐和亚铁盐
作业(十八) 铁盐和亚铁盐贵州省遵义航天高级中学2017-2018学年高一下学期期中考试理科综合化学试题云南省彝良县民中2018-2019学年高一上学期12月份考试化学试题(已下线)专题10 性质探究类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)陕西省渭南市华州区咸林中学2021-2022学年高一上学期第三阶段质量检测化学试题陕西省铜川市耀州中学2022-2023学年高一上学期期末考试化学试题河南省南阳市六校2023-2024学年高一上学期12月月考化学试题
2 . 如图所示装置是用燃烧法确定有机物化学式常用的装置,这种方法是电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。回答下列问题:

(1)A装置分液漏斗中盛放的物质是______ ,写出有关反应的化学方程式:________ 。
(2)C装置(燃烧管)中CuO的作用是_____ ;写出E装置中所盛放试剂的名称:______ ;若将B装置去掉会对实验造成什么影响?_______ 。
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88g,已知该物质的相对分子质量为44,则该样品的化学式为___________ 。
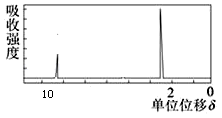
(4)若该有机物的核磁共振氢谱如下图所示,则其结构简式为______ ;该化合物具有的性质是:_______ 。(填序号)
A.能与水、乙醇、氯仿等互溶
B.无色、无味液体
C.能使酸性KMnO4溶液和溴水褪色
D.任何条件下不能与H2反应
(5)若符合下列条件,则该有机物的结构简式为___________ 。
①环状化合物 ②只有一种类型的氢原子
(6)某同学认E和空气相通,会影响测定结果准确性,应在E后再增加一个装置E,其主要目的是___________ 。

(1)A装置分液漏斗中盛放的物质是
(2)C装置(燃烧管)中CuO的作用是
(3)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.44g样品,经充分反应后,D管质量增加0.36g,E管质量增加0.88g,已知该物质的相对分子质量为44,则该样品的化学式为
(4)若该有机物的核磁共振氢谱如下图所示,则其结构简式为

A.能与水、乙醇、氯仿等互溶
B.无色、无味液体
C.能使酸性KMnO4溶液和溴水褪色
D.任何条件下不能与H2反应
(5)若符合下列条件,则该有机物的结构简式为
①环状化合物 ②只有一种类型的氢原子
(6)某同学认E和空气相通,会影响测定结果准确性,应在E后再增加一个装置E,其主要目的是
您最近一年使用:0次
2021-10-21更新
|
1201次组卷
|
4卷引用:第1章 有机化合物的结构特点与研究方法(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修3)
(已下线)第1章 有机化合物的结构特点与研究方法(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修3)(已下线)【知识图鉴】单元讲练测选择性必修3第1单元02基础练西安市长安区第一中学2021-2022学年高二上学期第一次质量检测化学试题陕西省汉中市洋县中学2021-2022学年高二下学期第一次月考化学试题
3 . 为探究Na与CO2反应的产物,某化学兴趣小组按如图装置进行实验。
已知: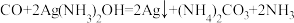
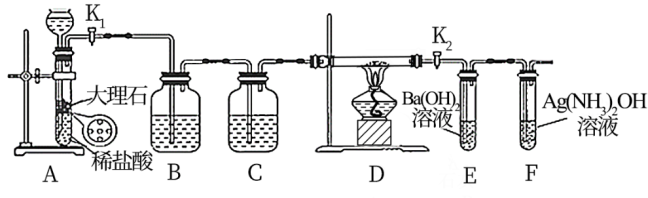
回答下列问题:
(1)写出A中反应的离子方程式:___________ 。
(2)仪器X的名称是___________ ;B中的溶液为___________ 。
(3)先称量硬质玻璃管的质量为m1g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g,再进行下列实验操作,正确的操作顺序是___________ (填字母)。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,通入CO2至E中出现浑浊
e.称量硬质玻璃管
f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔化成小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,硬质玻璃管中有大量黑色物质;
③F中试管内壁有银白色物质产生。
产生上述②现象的原因是___________ 。
(5)探究固体产物中钠元素的存在形式。
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有。
完成下列实验设计,验证上述假设:
已知:
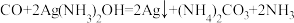

回答下列问题:
(1)写出A中反应的离子方程式:
(2)仪器X的名称是
(3)先称量硬质玻璃管的质量为m1g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g,再进行下列实验操作,正确的操作顺序是
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,通入CO2至E中出现浑浊
e.称量硬质玻璃管
f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
(4)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变黑,熔化成小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,硬质玻璃管中有大量黑色物质;
③F中试管内壁有银白色物质产生。
产生上述②现象的原因是
(5)探究固体产物中钠元素的存在形式。
假设一:只有Na2CO3;
假设二:只有Na2O;
假设三:Na2O和Na2CO3均有。
完成下列实验设计,验证上述假设:
| 步骤 | 操作 | 操作 |
| 1 | 将硬质玻璃管中的固体产物溶于水后过滤 | 假设一成立 |
| 2 | 往步骤1所得滤液中加入 |
您最近一年使用:0次
4 . 化学上常用燃烧法确定有机物的组成。这种方法是在电炉里加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。如图所列装置是用燃烧法确定有机物分子式常用的装置。
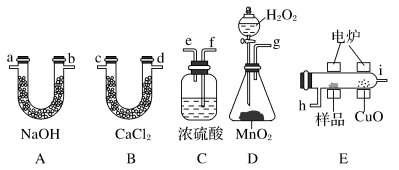
回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是__ 。
(2)C装置中浓H2SO4的作用是___ 。
(3)D装置中MnO2的作用是__ 。
(4)燃烧管中CuO的作用是___ 。
(5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为___ 。
(6)要确定该有机物的分子式,还要___ 。

回答下列问题:
(1)产生的氧气按从左到右流向,所选装置各导管的连接顺序是
(2)C装置中浓H2SO4的作用是
(3)D装置中MnO2的作用是
(4)燃烧管中CuO的作用是
(5)若准确称取0.90g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管质量增加1.32g,B管质量增加0.54g,则该有机物的最简式为
(6)要确定该有机物的分子式,还要
您最近一年使用:0次
2021-01-03更新
|
445次组卷
|
12卷引用:天津市南开中学人教版高中化学选修5预习练习:第一章 第四节 研究有机化合物的一般步骤和方法 第2课时
天津市南开中学人教版高中化学选修5预习练习:第一章 第四节 研究有机化合物的一般步骤和方法 第2课时(已下线)1.4 研究有机化合物的一般步骤和方法(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版选修5)(已下线)1.2 研究有机化合物的一般方法(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修3)(已下线)1.2.2 确定有机化合物的实验式与分子结构-2020-2021学年高二化学课时同步练(人教版2019选择性必修3)(已下线)2011-2012年新疆乌鲁木齐市第八中学高一下学期期末考试化学卷2015-2016学年辽宁大连经济技术开发区得胜高中高二下期中化学试卷2018版化学(苏教版)高考总复习专题十二课时跟踪训练--认识有机化合物【全国百强校】辽宁省鞍山市第一中学2018-2019学年高二下学期开学考试化学试题3.2有机化合物结构的测定能力提升宁夏石嘴山市第三中学2019-2020学年高二10月月考化学试题山西省朔州市怀仁县第一中学2018-2019学年高二下学期第二次月考化学试题江西省南昌市新建区第二中学2020-2021学年高二上学期“新星计划”体验营10月考化学试题
2020高三·全国·专题练习
名校
解题方法
5 . K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。回答下列问题:
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]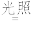 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为___ 。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

①通入氮气的目的是____ 。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有____ 、___ 。
③为防止倒吸,停止实验时应进行的操作是___ 。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是____ 。
(1)晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,以K3[Fe(CN)6]溶液为显色剂。其光解反应的化学方程式为:2K3[Fe(C2O4)3]
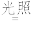 2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为
2FeC2O4+3K2C2O4+2CO2↑;显色反应的化学方程式为(2)某小组为探究三草酸合铁酸钾的热分解产物,按如图所示装置进行实验。

①通入氮气的目的是
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有
③为防止倒吸,停止实验时应进行的操作是
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是
您最近一年使用:0次
2020-12-09更新
|
638次组卷
|
5卷引用:专题9 第一~三单元综合拔高练-高中化学必修第二册苏教版2019
专题9 第一~三单元综合拔高练-高中化学必修第二册苏教版2019(已下线)专题讲座(九) 热点实验综合探究 (精讲)-2021年高考化学一轮复习讲练测四川省绵阳市南山中学实验学校2022届高三上学学期开学考试化学试题四川省泸县第四中学2021-2022学年高三上学期第二次月考理综化学试题(已下线)专题讲座(十)化学实验设计与探究(练) — 2022年高考化学一轮复习讲练测(新教材新高考)
名校
6 . 研究性学习小组对某硫酸亚铁晶体(FeSO4·xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按下图高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。
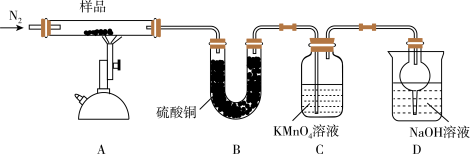
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有_____ (填分子式)。
(2)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体氧化铁。
(3)装置C中高锰酸钾溶液褪色,说明产物中存在_____ (填氧化性或还原性)气体_____ (填分子式)。
(4)实验中要持续通入氮气,否则测出的x会_____ (填“偏大”、“偏小”或“不变”)。
(5)从理论上分析得出硫酸亚铁分解还生成另-物质三氧化硫,写出硫酸亚铁分解的化学方程式____ 。
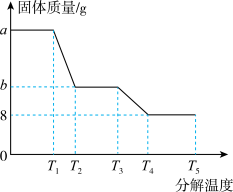
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4·xH2O)进行热分解,获得相关数据,绘制成固体质量一分解温度的关系如图,根据图中有关数据,可计算出FeSO4·xH2O中的x=_____ 。(写出计算过程)

(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有
(2)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体氧化铁。
(3)装置C中高锰酸钾溶液褪色,说明产物中存在
(4)实验中要持续通入氮气,否则测出的x会
(5)从理论上分析得出硫酸亚铁分解还生成另-物质三氧化硫,写出硫酸亚铁分解的化学方程式
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4·xH2O)进行热分解,获得相关数据,绘制成固体质量一分解温度的关系如图,根据图中有关数据,可计算出FeSO4·xH2O中的x=

您最近一年使用:0次
2020-08-31更新
|
371次组卷
|
3卷引用:第1章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)
(已下线)第1章 章末检测-2020-2021学年高一化学同步课堂帮帮帮(人教版2019必修第一册)江苏省启东中学2020-2021学年高一上学期期初考试化学试题河北省张家口市宣化第一中学2021-2022学年高一上学期期初考试化学试题
解题方法
7 . 部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3,CuO)5.76 g,经如图所示流程进行处理:
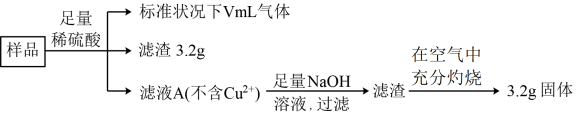
下列说法正确的是

下列说法正确的是
A.滤液A中的阳离子为 、 、 、 、 | B.样品中铁元素的质量为2.24 g |
| C.样品中CuO的质量为4.0 g | D.V=224 |
您最近一年使用:0次
8 . 为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
已知: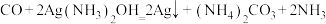
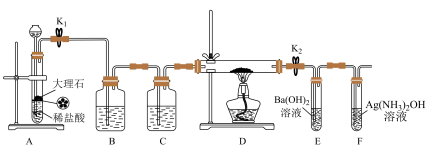
回答下列问题:
(1)B中的溶液为_________ 。
(2)先称量硬质玻璃管的质量为m1g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量为m2g。再进行下列实验操作,其正确顺序是_________ (填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊
e.关闭K1和K2
f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,硬质玻璃管中有大量黑色物质;
③F中试管内壁有银白色物质产生。
产生上述②现象的原因是___________ 。
(4)探究固体产物中钠元素的存在形式。
假设一:只有Na2CO3。
假设二:只有Na2O。
假设三:Na2O和Na2CO3均有。
完成下列实验设计,验证上述假设:
已知:
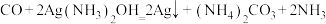

回答下列问题:
(1)B中的溶液为
(2)先称量硬质玻璃管的质量为m1g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量为m2g。再进行下列实验操作,其正确顺序是
a.点燃酒精灯,加热
b.熄灭酒精灯
c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊
e.关闭K1和K2
f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,硬质玻璃管中有大量黑色物质;
③F中试管内壁有银白色物质产生。
产生上述②现象的原因是
(4)探究固体产物中钠元素的存在形式。
假设一:只有Na2CO3。
假设二:只有Na2O。
假设三:Na2O和Na2CO3均有。
完成下列实验设计,验证上述假设:
步骤 | 操作或现象 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤 | 假设一成立 |
2 | 往步骤1所得滤液中 现象: |
您最近一年使用:0次
9 . 过氧乙酸(CH3COOOH)是无色易挥发,易溶于水的液体,受热易分解。有强烈刺激性气味,有腐蚀性,对人的眼睛、皮肤、黏膜、上呼吸道等有强烈刺激作用。
(1)实验室配制500mL0.1mol/L过氧乙酸溶液时,除需使用烧杯和玻璃棒外,还要用到以下哪些仪器_______ (填字母标号)。
A.分液漏斗 B.500mL容量瓶 C. 普通漏斗 D. 胶头滴管 E. 量筒
(2)某实验小组利用高浓度的双氧水和乙酸反应合成少量过氧乙酸,同时利用乙酸丁酯与水形成共沸物(沸点90. 7°C )及时分离出水。已知乙酸丁酯的密度为0.88g/cm3,难溶于水。实验装置如图所示。
CH3COOH+H2O2 CH3COOOH+H2O ∆H<0
CH3COOOH+H2O ∆H<0
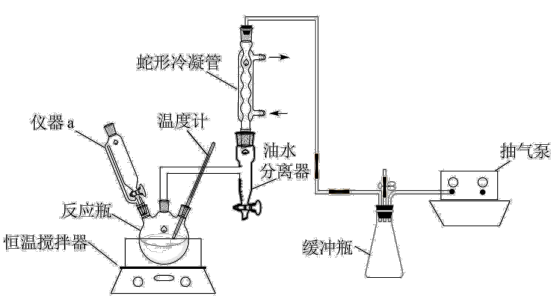
①仪器a的名称为_______ ,写出H2O2的电子式______
②装置中油水分离器的作用是_______
③反应体系采用减压的目的是_______
(3)过氧乙酸(含有少量H2O2杂质)的含量测定流程:
取样→H2SO4酸化→KMnO4除H2O2→加过量FeSO4溶液还原CH3COOOH → K2Cr2O7溶液滴定剩余FeSO4溶液
①过氧乙酸被Fe2 +还原,产物之一为CH3COOH,其离子方程式为_______ 。
②若样品体积为V0mL,加入c1 mol• L-1FeSO4溶液V1mL,消耗c2mo•L-1K2Cr2O7,溶液V2mL,则过氧乙酸含量为_______ g. L-1。
③若用KMnO4溶液除H2O2时,不慎滴加KMnO4过量,则导致最终测定过氧乙酸的含量_______ (填“偏高”、“偏低”或“不变”)。
(1)实验室配制500mL0.1mol/L过氧乙酸溶液时,除需使用烧杯和玻璃棒外,还要用到以下哪些仪器
A.分液漏斗 B.500mL容量瓶 C. 普通漏斗 D. 胶头滴管 E. 量筒
(2)某实验小组利用高浓度的双氧水和乙酸反应合成少量过氧乙酸,同时利用乙酸丁酯与水形成共沸物(沸点90. 7°C )及时分离出水。已知乙酸丁酯的密度为0.88g/cm3,难溶于水。实验装置如图所示。
CH3COOH+H2O2
 CH3COOOH+H2O ∆H<0
CH3COOOH+H2O ∆H<0
①仪器a的名称为
②装置中油水分离器的作用是
③反应体系采用减压的目的是
(3)过氧乙酸(含有少量H2O2杂质)的含量测定流程:
取样→H2SO4酸化→KMnO4除H2O2→加过量FeSO4溶液还原CH3COOOH → K2Cr2O7溶液滴定剩余FeSO4溶液
①过氧乙酸被Fe2 +还原,产物之一为CH3COOH,其离子方程式为
②若样品体积为V0mL,加入c1 mol• L-1FeSO4溶液V1mL,消耗c2mo•L-1K2Cr2O7,溶液V2mL,则过氧乙酸含量为
③若用KMnO4溶液除H2O2时,不慎滴加KMnO4过量,则导致最终测定过氧乙酸的含量
您最近一年使用:0次
2021-03-12更新
|
329次组卷
|
2卷引用:第一~二节综合拔高练
解题方法
10 . 膨松剂是一种食品添加剂。它在面包制作过程中发生反应产生气体,使面包变得松软,膨松剂产生气体的量是检验膨松剂品质的一项重要指标。已知某膨松剂含碳酸氢钠、碳酸氢铵中的一种或两种,某化学兴趣小组对该膨松剂进行了探究。
探究Ⅰ:检验膨松剂的成分:在硬质玻璃管中加入该膨松剂,按如图所示连接好装置(装置气密性良好,且装置内空气已排尽)。
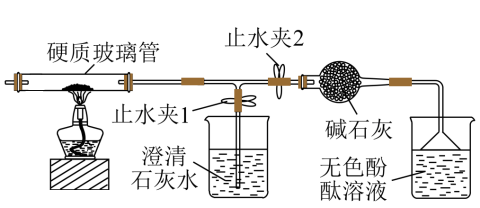
【观察与分析Ⅰ】点燃酒精灯。
(1)关闭止水夹2,打开止水夹1,澄清石灰水变浑浊,说明产物中有二氧化碳,该反应的化学方程式为_______ 。
(2)打开止水夹2,关闭止水夹1,观察到的现象是____ ,说明产物中有氨气。
(3)充分加热后,硬质玻璃管中_____ (填“有”或“无”)固体剩余。
【实验结论】该膨松剂是碳酸氢钠和碳酸氢铵的混合物。
探究Ⅱ:测定该膨松剂受热产生气体的质量:用如图所示装置测定该膨松剂样品产生的二氧化碳和氨气的质量(装置气密性良好,各装置中气体吸收剂足量)。
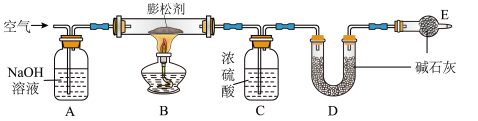
【观察与分析Ⅱ】(4)通过测定实验前后装置D的质量,其质量差即为样品产生二氧化碳的质量,装置C的作用是___ ,装置D的作用是______ ,若没有装置E,会造成测定结果______ (填“偏大”“不变”或“偏小”)。
(5)实验过程中必须向装置内通入空气,装置A的作用是除去空气中的______ (填名称)。停止加热后,继续通入空气一段时间,目的是______ 。
(6)若对装置C、D、E连接顺序进行调整,即可用于测定另一份同质量的相同样品受热分解产生的氨气的质量。则装置C、D、E连接顺序为________ ,通过测定实验前后装置C的质量,其质量差即为样品产生氨气的质量。
【拓展研究】(7)若将产生的氨气通过灼热的氧化铜会生成红色固体、无色液体和气体单质三种物质,则该反应的化学方程式为_____ 。
探究Ⅰ:检验膨松剂的成分:在硬质玻璃管中加入该膨松剂,按如图所示连接好装置(装置气密性良好,且装置内空气已排尽)。

【观察与分析Ⅰ】点燃酒精灯。
(1)关闭止水夹2,打开止水夹1,澄清石灰水变浑浊,说明产物中有二氧化碳,该反应的化学方程式为
(2)打开止水夹2,关闭止水夹1,观察到的现象是
(3)充分加热后,硬质玻璃管中
【实验结论】该膨松剂是碳酸氢钠和碳酸氢铵的混合物。
探究Ⅱ:测定该膨松剂受热产生气体的质量:用如图所示装置测定该膨松剂样品产生的二氧化碳和氨气的质量(装置气密性良好,各装置中气体吸收剂足量)。

【观察与分析Ⅱ】(4)通过测定实验前后装置D的质量,其质量差即为样品产生二氧化碳的质量,装置C的作用是
(5)实验过程中必须向装置内通入空气,装置A的作用是除去空气中的
(6)若对装置C、D、E连接顺序进行调整,即可用于测定另一份同质量的相同样品受热分解产生的氨气的质量。则装置C、D、E连接顺序为
【拓展研究】(7)若将产生的氨气通过灼热的氧化铜会生成红色固体、无色液体和气体单质三种物质,则该反应的化学方程式为
您最近一年使用:0次



