1 . 过氧化钙(CaO2)广泛应用于水产养殖、污水处理,是优良的供氧剂。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了Ca(OH)2,写出该反应的化学方程式:______________ 。
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。有同学不认同上述方案的理由是_______________________ 。
实验探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
(3)取一定质量的供氧剂溶于水,按照图1装置进行装配。读出体积时要注意:①该反应为放热反应,待气体恢复至室温再读数;②____________________________ ;③视线和凹液面最低处保持水平再读数。
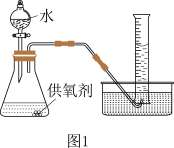
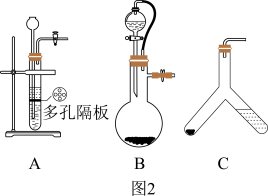
(4)用此装置测得的含量会偏大,原因是________________ ,为了避免此误差可将发生装置换成图2中的装置B或C。
方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图3。
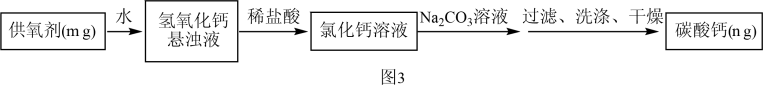
(5)滴加的Na2CO3溶液要过量的原因是_________________________ 。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了Ca(OH)2,写出该反应的化学方程式:
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。有同学不认同上述方案的理由是
实验探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
(3)取一定质量的供氧剂溶于水,按照图1装置进行装配。读出体积时要注意:①该反应为放热反应,待气体恢复至室温再读数;②

(4)用此装置测得的含量会偏大,原因是

方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图3。

(5)滴加的Na2CO3溶液要过量的原因是
您最近一年使用:0次
2 . 实验室有一瓶密封不严的漂白粉样品,其中肯定含有 ,请设计实验探究该样品中可能存在的其他物质[已知
,请设计实验探究该样品中可能存在的其他物质[已知 可使品红溶液褪色]。
可使品红溶液褪色]。
(1)提出合理假设。
假设①:该漂白粉未变质,含有___________ ;
假设②:该漂白粉全部变质,含有___________ ;
假设③:该漂白粉部分变质,既含有 ,又含有
,又含有 。
。
(2)设计实验方案,进行实验。
 ,请设计实验探究该样品中可能存在的其他物质[已知
,请设计实验探究该样品中可能存在的其他物质[已知 可使品红溶液褪色]。
可使品红溶液褪色]。(1)提出合理假设。
假设①:该漂白粉未变质,含有
假设②:该漂白粉全部变质,含有
假设③:该漂白粉部分变质,既含有
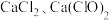 ,又含有
,又含有 。
。(2)设计实验方案,进行实验。
| 实验步骤 | 预期现象和结论 |
| 实验①:取少量上述漂白粉样品于试管中,加入适量稀盐酸,观察是否有气泡产生 | a.若无气泡产生,则假设 b. |
| 实验②:向实验①反应后的试管中滴人1~2滴品红溶液,振荡 | c.若品红溶液褪色,结合实验①中的b判断,则假设 d.若品红溶液不褪色,结合b判断,则假设 |
您最近一年使用:0次
3 . 过氧化钠保存不当容易变质,某课外活动小组为了粗略测定样品中过氧化钠的质量分数,他们称取10.0g样品,并设计用如图装置来测定过氧化钠的质量分数。
上图中的E和F构成量气装置,用来测定 的体积。
的体积。
(1)写出以下装置中发生反应的化学方程式。
装置A:__________ 。装置B:__________ 。
(2)D中NaOH溶液的作用是___________ 。
(3)为准确读出氧气的体积需进行以下操作,正确的顺序为_________ 。
A.调整量筒高度,使广口瓶E与量筒F内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
(4)读出量筒内水的体积后,折算成标准状况下氧气的体积为1.12L,则样品中过氧化钠的质量分数为________ 。

上图中的E和F构成量气装置,用来测定
 的体积。
的体积。(1)写出以下装置中发生反应的化学方程式。
装置A:
(2)D中NaOH溶液的作用是
(3)为准确读出氧气的体积需进行以下操作,正确的顺序为
A.调整量筒高度,使广口瓶E与量筒F内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
(4)读出量筒内水的体积后,折算成标准状况下氧气的体积为1.12L,则样品中过氧化钠的质量分数为
您最近一年使用:0次
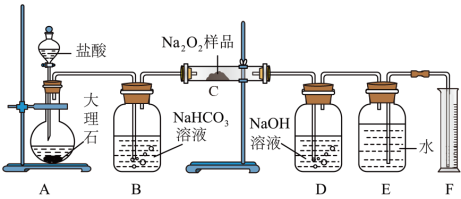
4 . 过氧化钠常作漂白剂、杀菌剂、消毒剂,若保存不当容易吸收空气中的 而变质。
而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入______ 溶液,充分振荡后有白色沉淀生成,证明 已经变质。
已经变质。
(2)为了粗略测定过氧化钠的纯度,他们设计并用如图装置来测定 样品中过氧化钠的质量分数。
样品中过氧化钠的质量分数。
①将仪器连接好以后,必须进行的第一步操作是______ 。
②从 装置中逸出的气体是否需要干燥?
装置中逸出的气体是否需要干燥?__ (填“是”或“否”)。
③ 中
中 溶液的作用为
溶液的作用为_________ 。
④实验结束,读取实验中生成气体的体积时,不合理的是______ (填序号)。
a 直接读取气体体积,不需冷却到室温
b 上下移动量筒,使得 、
、 中液面高度相同
中液面高度相同
c 视线与凹液面最低点相平,读取量筒中水的体积
⑤实验完成后, 到
到 之间导管内残留水的体积会使测量结果
之间导管内残留水的体积会使测量结果______ (填“偏大”“偏小”或“不影响”)。
 而变质。
而变质。(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
 已经变质。
已经变质。(2)为了粗略测定过氧化钠的纯度,他们设计并用如图装置来测定
 样品中过氧化钠的质量分数。
样品中过氧化钠的质量分数。
①将仪器连接好以后,必须进行的第一步操作是
②从
 装置中逸出的气体是否需要干燥?
装置中逸出的气体是否需要干燥?③
 中
中 溶液的作用为
溶液的作用为④实验结束,读取实验中生成气体的体积时,不合理的是
a 直接读取气体体积,不需冷却到室温
b 上下移动量筒,使得
 、
、 中液面高度相同
中液面高度相同c 视线与凹液面最低点相平,读取量筒中水的体积
⑤实验完成后,
 到
到 之间导管内残留水的体积会使测量结果
之间导管内残留水的体积会使测量结果
您最近一年使用:0次
名校
解题方法
5 . 为探究H2O2、SO2、Br2的性质,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

(1)在滴入浓硫酸之前要通入N2一段时间的目的是__________________________ 。
(2)该实验可以证明SO2具有_________ 性;H2O2的氧化性_________ Br2(填“强于”“弱于”)。
(3)B中红棕色褪去的原因_______________________________ ,B中重新变成红棕色的原因____________________________________ (均用离子方程式表示)。
(4)C中产生的白色沉淀是______ 。
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放_________ 的洗气瓶。再次进行实验时,则C中未产生沉淀。
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:
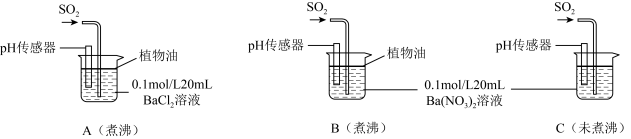
①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是__________________ 。(用化学方程式表示)
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是__________________ 。若实验B、C中通入足量的SO2后,溶液酸性:B_________ C(填“强于”“弱于”“等于”)。
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是___________________ 。

| 实验操作 | 实验现象 |
| i.打开弹簧夹,通入N2一段时间,关闭弹簧夹,打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
| ⅲ.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(2)该实验可以证明SO2具有
(3)B中红棕色褪去的原因
(4)C中产生的白色沉淀是
(5)甲同学通过C中产生白色沉淀,得出结论:SO2能与BaCl2反应产生沉淀。乙同学认为不能得出此结论,并对实验进行了改进:在B和C之间增加盛放
(6)为进一步研究SO2的性质,分别用煮沸和未煮沸过的蒸馏水配制Ba(NO3)2和BaCl2溶液,进行如下实验:

①实验A中,没有观察到白色沉淀,但pH传感器显示溶液呈酸性,原因是
②实验C中出现白色沉淀比实验B快很多。由此得出的结论是
(7)Na2SO3固体因贮放不慎发生变质。现取样品1.8克溶于水得溶液A,在A中加入足量BaCl2溶液,过滤得沉淀B,将沉淀B加入足量的稀硫酸后,沉淀不仅不消失,反而增加了0.16g(假如沉淀完全转化)。样品中Na2SO3的质量分数是
您最近一年使用:0次
2020-01-18更新
|
644次组卷
|
3卷引用:专题4 第一单元 第2课时硫酸的制备与性质-高中化学苏教2019版必修第一册
名校
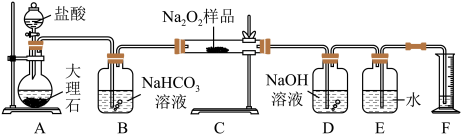
6 . 过氧化钠保存不当容易变质,某课外活动小组为了粗略测定样品中过氧化钠的质量分数,他们称取 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
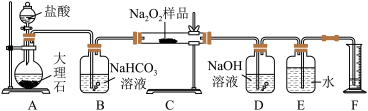
上图中的 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。
(1)写出以下装置中发生反应的化学方程式。
装置 :
:_____ 。装置 :
:_______ 。装置 :
:_________ 。
(2) 中
中 溶液的作用是
溶液的作用是_________ 。
(3)为准确读出氧气的体积需进行以下操作,正确的顺序为________ 。
A.调整量筒高度,使广口瓶 与量筒
与量筒 内液面相平
内液面相平
B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
 样品,并设计用如图装置来测定过氧化钠的质量分数。
样品,并设计用如图装置来测定过氧化钠的质量分数。
上图中的
 和
和 构成量气装置,用来测定
构成量气装置,用来测定 的体积。
的体积。(1)写出以下装置中发生反应的化学方程式。
装置
 :
: :
: :
:(2)
 中
中 溶液的作用是
溶液的作用是(3)为准确读出氧气的体积需进行以下操作,正确的顺序为
A.调整量筒高度,使广口瓶
 与量筒
与量筒 内液面相平
内液面相平B.将气体冷却至室温
C.平视,使凹液面最低点与视线水平相切再读数
您最近一年使用:0次
2020-09-04更新
|
548次组卷
|
5卷引用:人教版(2019)高一必修第一册第二章 海水中的重要元素 第一节 钠及其化合物 课时2 钠的几种化合物 焰色试验
人教版(2019)高一必修第一册第二章 海水中的重要元素 第一节 钠及其化合物 课时2 钠的几种化合物 焰色试验(已下线)3.2.1 钠的性质与制备-2021-2022学年高一化学课后培优练(苏教版2019必修第一册)(已下线)第13单元 化学实验基本操作(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷河北省石家庄市第二十四中学2020-2021学年高一上学期期中考试化学试题2广东省华南师范大学附属中学2020-2021学年高一上学期期中考试化学试题
名校
7 . 化学小组设计以下实验方案,测定某部分变质为碳酸钠的小苏打样品中NaHCO3的质量分数。
(1)方案一:称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量。重复操作,计算。仪器a的名称是____________ 。
(2)方案二:称取此混合物9.5g,溶于水中,配成100 mL溶液。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(NaHCO3)。
①取配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂
是____________ (填字母)。
A CaCl2溶液 B MgSO4溶液 C NaCl溶液 D Ba(OH)2溶液
②过滤,提取沉淀,则过滤操作所需要的玻璃仪器除玻璃棒、烧杯外,还有____________ 。
③将沉淀洗涤,并充分干燥,称量沉淀的质量为19.7g。由此可以计算ω(NaHCO3)=____________ 。
(3)方案三:称取一定质量样品,按如图装置进行实验:
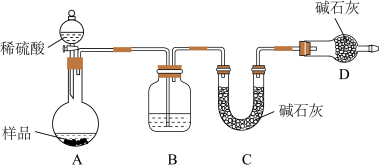
①B装置内所盛试剂是____________ ;
②D装置的作用是________ 。
③某同学认为上述测定结果__________ (填“偏高”或“偏低”),因为实验装置还存在一个明显的缺陷是________________ 。
(1)方案一:称取一定质量样品,置于仪器a中用酒精灯加热至恒重,冷却,用托盘天平称量剩余固体质量。重复操作,计算。仪器a的名称是
(2)方案二:称取此混合物9.5g,溶于水中,配成100 mL溶液。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(NaHCO3)。
①取配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂
是
A CaCl2溶液 B MgSO4溶液 C NaCl溶液 D Ba(OH)2溶液
②过滤,提取沉淀,则过滤操作所需要的玻璃仪器除玻璃棒、烧杯外,还有
③将沉淀洗涤,并充分干燥,称量沉淀的质量为19.7g。由此可以计算ω(NaHCO3)=
(3)方案三:称取一定质量样品,按如图装置进行实验:

①B装置内所盛试剂是
②D装置的作用是
③某同学认为上述测定结果
您最近一年使用:0次
2019-12-05更新
|
234次组卷
|
3卷引用:专题3 第二单元 第2课时 碳酸钠 碳酸氢钠-高中化学苏教2019版必修第一册
名校
8 . 过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入______ 溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。
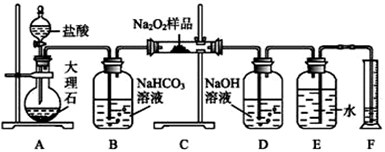
①将仪器连接好以后,必须进行的第一步操作是____________________________________ 。
②B装置出来的气体是否需要干燥______ (填“是”或“否”)。
③D中NaOH溶液的作用____________________ 。
④实验结束时,读取实验中生成气体的体积时,不合理的是__________ 。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为_____________ 。
⑥实验完成后E到F之间导管内残留水的体积会使测量结果________ (填“偏大”“偏小”或“不影响”)。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用如图装置来测定过氧化钠的质量分数。

①将仪器连接好以后,必须进行的第一步操作是
②B装置出来的气体是否需要干燥
③D中NaOH溶液的作用
④实验结束时,读取实验中生成气体的体积时,不合理的是
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为
⑥实验完成后E到F之间导管内残留水的体积会使测量结果
您最近一年使用:0次
2018-12-19更新
|
390次组卷
|
5卷引用:鲁科版(2019)高一必修第一册第1章 认识化学科学 总结检测
20-21高三·河南·开学考试
9 . 高铁酸钾(K2FeO4)是一种强氧化剂和环境友好型水处理剂,易分解,遇水和酸易变质。学习小组在实验室对高铁酸钾的制备和一些性质进行探究。
回答下列问题:
(1)高铁酸钾的制备。
步骤一:制备Na2FeO4,装置如图1所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;
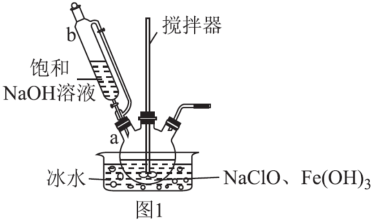
步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称为___ ,其侧管的作用为___ 。
②步骤一中采用冰水浴冷却的目的为___ ;a中制备Na2FeO4反应的离子方程式为___ 。
③步骤二中,能得到K2FeO4悬浊液的原因为___ 。
④K2FeO4悬浊液经过滤、洗涤、提纯,可得产品。其中提纯所用的操作名称为___ 。
(2)K2FeO4遇水转化为Fe(OH)3,则其作水处理剂的优点为___ 。
(3)用图2所示装置检验K2FeO4受热分解的产物。
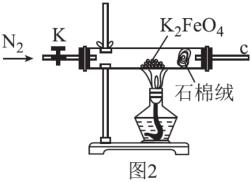
①检验分解的气体产物为O2的操作和现象为___ 。
②设计实验证明完全分解后的固体产物中不含Fe(Ⅱ)___ 。
回答下列问题:
(1)高铁酸钾的制备。
步骤一:制备Na2FeO4,装置如图1所示。将b中饱和NaOH溶液全部逐滴滴入a中,充分反应;

步骤二:由b向a中反应后液体中加入饱和KOH溶液;
步骤三:将a中所得浊液移出,分离提纯。
①仪器b的名称为
②步骤一中采用冰水浴冷却的目的为
③步骤二中,能得到K2FeO4悬浊液的原因为
④K2FeO4悬浊液经过滤、洗涤、提纯,可得产品。其中提纯所用的操作名称为
(2)K2FeO4遇水转化为Fe(OH)3,则其作水处理剂的优点为
(3)用图2所示装置检验K2FeO4受热分解的产物。

①检验分解的气体产物为O2的操作和现象为
②设计实验证明完全分解后的固体产物中不含Fe(Ⅱ)
您最近一年使用:0次
2021-08-28更新
|
550次组卷
|
4卷引用:3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)
(已下线)3.1.2 不同价态铁元素之间的转化-2021-2022学年高一化学课后培优练(鲁科版2019必修第一册)河南部分学校2022届新高三8月份摸底联考化学试题安徽省亳州市涡阳县育萃高级中学2021-2022学年高二上学期第一次月考化学试题山西省太原市第五十六中学2021-2022学年高三上学期第一次月考化学试题
名校
解题方法
10 . 印刷电路板在电子行业中应用广泛,其中的铜质线路是通过化学试剂刻蚀覆盖在有机绝缘材料上的铜板形成的。从废弃的印刷电路板上可以回收铜及其化合物。甲、乙、丙三组同学分别采用了不同的回收方案如下(部分产物略去):
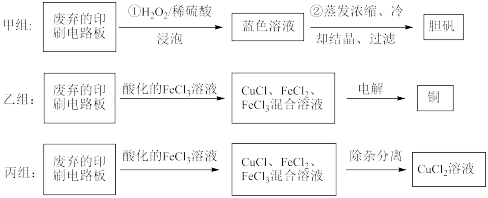
(1)甲组步骤①中反应的离子方程式为:______ 。
(2)甲组同学进行实验时,发现H2O2已变质不能使用,他们需要在不使用H2O2的前提下实现反应Cu+H2SO4=CuSO4+H2↑。在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”,不能实现的装置中不要填写)。
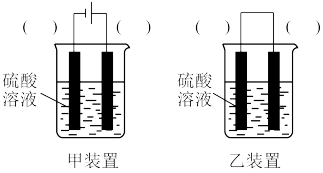
________
(3)乙组同学使用的FeCl3溶液需要酸化的原因是:________ 。
(4)图为乙组电解时的装置图。其中铜电极应该与电源的_____ (填“正极”或“负极”)相连。当观察到阴极有少量气泡产生时,即停止电解,此时要回收的铜已全部析出。则阴极发生的电极反应为(按反应发生的先后顺序书写):_____ 、___ 、___ 。
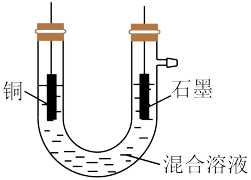
(5)乙组同学用1L 0.2mol/L的FeCl3溶液溶解铜,电解时,阴极产生无色气体0.56L(标准状况下)时停止电解,此时阳极产生的气体在标准状况下的体积共_____ L。
(6)丙组同学利用FeCl3腐蚀铜板后的混合液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤(写出试剂和操作)①_____________ ;②____ ;③过滤弃去滤渣。

(1)甲组步骤①中反应的离子方程式为:
(2)甲组同学进行实验时,发现H2O2已变质不能使用,他们需要在不使用H2O2的前提下实现反应Cu+H2SO4=CuSO4+H2↑。在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”,不能实现的装置中不要填写)。

(3)乙组同学使用的FeCl3溶液需要酸化的原因是:
(4)图为乙组电解时的装置图。其中铜电极应该与电源的

(5)乙组同学用1L 0.2mol/L的FeCl3溶液溶解铜,电解时,阴极产生无色气体0.56L(标准状况下)时停止电解,此时阳极产生的气体在标准状况下的体积共
(6)丙组同学利用FeCl3腐蚀铜板后的混合液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤(写出试剂和操作)①
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2、浓硫酸、NaOH溶液、CuO、Cu | ||
您最近一年使用:0次



