1 .  (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(1)探究三草酸合铁酸钾的热分解产物。
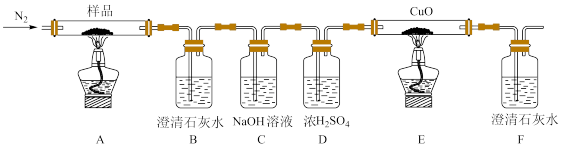
按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是_______ 。
②装置E中发生反应的化学方程式为_______ 。
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:
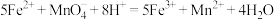
①配制溶液:实验中配制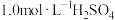 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、_______ (从下图中选择,写出名称)。
②测定:称量10.00g晶体样品,加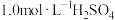 溶解后配成100mL溶液。
溶解后配成100mL溶液。
步骤Ⅰ取20.00mL配制好的溶液于锥形瓶中,滴加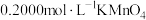 ,溶液至恰好完全反应。该操作的目的是
,溶液至恰好完全反应。该操作的目的是_______ 。
③步骤Ⅱ向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用
酸化,用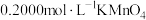 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。该晶体样品中铁的质量分数为
溶液20.00mL。该晶体样品中铁的质量分数为_______ (写出计算过程)。
 (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:(1)探究三草酸合铁酸钾的热分解产物。

按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是
②装置E中发生反应的化学方程式为
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:

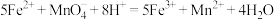
①配制溶液:实验中配制
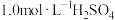 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、
②测定:称量10.00g晶体样品,加
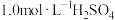 溶解后配成100mL溶液。
溶解后配成100mL溶液。步骤Ⅰ取20.00mL配制好的溶液于锥形瓶中,滴加
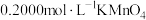 ,溶液至恰好完全反应。该操作的目的是
,溶液至恰好完全反应。该操作的目的是③步骤Ⅱ向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀
 酸化,用
酸化,用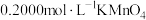 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。该晶体样品中铁的质量分数为
溶液20.00mL。该晶体样品中铁的质量分数为
您最近一年使用:0次
2020高二·天津·学业考试
解题方法
2 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,产生的现象是___ 。
(2)为测定绿矾中结晶水含量,将带有两端开关K1和K2的石英玻璃管(设为装置A)称重,记为m1g,将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。
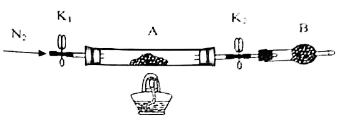
仪器B的名称是___ 。
②实验操作步骤:a.打开K1和K2,缓缓通入N2→b.点燃酒精灯,加热→c.熄灭酒精灯→d. →e.关闭K1和K2→f.称量A。d的操作为___ 。
③重复②的操作步骤,直至A恒重,记为m3g。根据实验记录,计算绿矾化学式中结晶水数目x=___ (列式表示)。若实验时将a、b的操作次序颠倒,则使x___ (填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
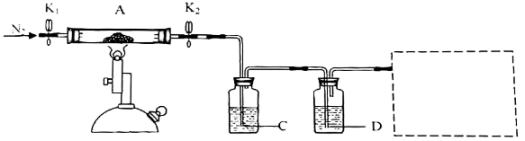
已知:装置C用于检验和吸收分解得到的气体产物之一——SO3。
①C、D中的溶液依次为___ 、___ (填标号)。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
C、D中有气泡冒出,并可观察到的现象分别为___ 、___ 。
②写出硫酸亚铁高温分解反应的化学方程式:___ 。
③在方框中画出尾气吸收装置并注明所用试剂___ 。
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,产生的现象是
(2)为测定绿矾中结晶水含量,将带有两端开关K1和K2的石英玻璃管(设为装置A)称重,记为m1g,将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。

仪器B的名称是
②实验操作步骤:a.打开K1和K2,缓缓通入N2→b.点燃酒精灯,加热→c.熄灭酒精灯→d. →e.关闭K1和K2→f.称量A。d的操作为
③重复②的操作步骤,直至A恒重,记为m3g。根据实验记录,计算绿矾化学式中结晶水数目x=
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

已知:装置C用于检验和吸收分解得到的气体产物之一——SO3。
①C、D中的溶液依次为
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
C、D中有气泡冒出,并可观察到的现象分别为
②写出硫酸亚铁高温分解反应的化学方程式:
③在方框中画出尾气吸收装置并注明所用试剂
您最近一年使用:0次
3 . 硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O]较硫酸亚铁不易被氧气氧化,是分析化学中重要的试剂,常用于代替硫酸亚铁。硫酸亚铁铵在500℃时隔绝空气加热完全分解。回答下列问题:
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO 3、H2O、N2和
3、H2O、N2和__________ 。
(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。
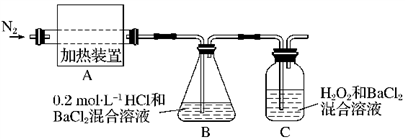
①A中固体充分加热较长时间后,通入氮气,目的是__________________________ 。
②为验证A中残留物是否含有FeO,需要选用的试剂有____________ (填字母)。
A.KSCN溶液B.稀硫酸
C.浓盐 酸D.KMnO4溶液
酸D.KMnO4溶液
③装置B中BaCl2溶液的作用是为了检验分解产物中是否有________ 气体生成,若含有该气体,观察到的现象为_______________________________________ 。
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为b mol,C中沉淀物质的量为a mol,则b________________ (填“大于”“小于”或“等于”)a。
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为___________________________________________ (用离子方程式表示)。
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
测定原理:MnO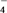 +Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
+Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
测定步骤:步骤一:准确称量20.00 g硫酸亚铁铵晶体,配制成100 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,用0.100 0 mol·L-1KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00 mL。
①如何判断滴定终点?________________________ ;
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为_________________ 。
(1)硫酸亚铁铵隔绝空气加热完全分解,发生了氧化还原反应,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO
 3、H2O、N2和
3、H2O、N2和(2)为检验分解产物的成分,设计如下实验装置进行实验,加热A中的硫酸亚铁铵至分解完全。

①A中固体充分加热较长时间后,通入氮气,目的是
②为验证A中残留物是否含有FeO,需要选用的试剂有
A.KSCN溶液B.稀硫酸
C.浓盐
 酸D.KMnO4溶液
酸D.KMnO4溶液③装置B中BaCl2溶液的作用是为了检验分解产物中是否有
④若A中分解产物有N2,固体残留物只有Fe2O3,Fe2O3的物质的量为b mol,C中沉淀物质的量为a mol,则b
⑤实验中,观察到C中有白色沉淀生成,则C中发生的反应为
(3)为测定某固体样品中(NH4)2Fe(SO4)2·6H2O的含量,某实验小组做了如下实验:
测定原理:MnO
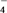 +Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)
+Fe2++H+―→Mn2++Fe3++H2O(方程式未配平)测定步骤:步骤一:准确称量20.00 g硫酸亚铁铵晶体,配制成100 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,用0.100 0 mol·L-1KMnO4溶液滴定至终点,重复两次,平均消耗KMnO4溶液16.00 mL。
①如何判断滴定终点?
②产品中(NH4)2Fe(SO4)2·6H2O的质量分数为
您最近一年使用:0次
2016-12-09更新
|
952次组卷
|
6卷引用:2018届高三一轮复习化学:微考点20-铁及其化合物的实验探究
名校
4 . 菠菜营养丰富,素有“蔬菜之王”的美称。民间流传:菠菜豆腐同食,易得结石。某化学兴趣小组对“菠菜豆腐是否不能同食”等问题进行探究。
已知:菠菜含有丰富的铁、草酸盐、碳酸盐等;豆腐中含有丰富的蛋白质及钙盐等。人体结石的主要成分:草酸钙(CaC2O4)。醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐等。
【探究一】菠菜中部分成分分析
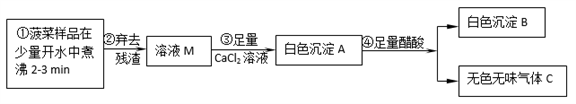
(1)步骤②中的实验室操作中需要的玻璃仪器有烧杯、玻璃棒和________________ 。
(2)白色沉淀B的化学式可能为_______________ 。
【探究二】某草酸钙晶体(CaC2O4·xH2O)热分解研究
按下图装置将某草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)。
(3)某研究所利用SDT Q600热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,得相关数据,绘制成固体质量—分解温度的关系如图。
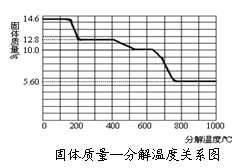
800℃以上时,固体成分的化学式为_____________ 。
②写出固体质量由12.8 g变为10.0 g过程中的的反应方程式为___________ 。
③试计算草酸钙晶体的x(写出计算过程)_______________ 。
已知:菠菜含有丰富的铁、草酸盐、碳酸盐等;豆腐中含有丰富的蛋白质及钙盐等。人体结石的主要成分:草酸钙(CaC2O4)。醋酸不与草酸钙反应,但能与碳酸钙反应生成可溶性盐等。
【探究一】菠菜中部分成分分析

(1)步骤②中的实验室操作中需要的玻璃仪器有烧杯、玻璃棒和
(2)白色沉淀B的化学式可能为
【探究二】某草酸钙晶体(CaC2O4·xH2O)热分解研究
按下图装置将某草酸钙晶体样品高温加热,使其完全分解,对所得气体产物进行探究(假设装置中各试剂均足量)。
(3)某研究所利用SDT Q600热分析仪对草酸钙晶体(CaC2O4·xH2O)进行热分解,得相关数据,绘制成固体质量—分解温度的关系如图。

800℃以上时,固体成分的化学式为
②写出固体质量由12.8 g变为10.0 g过程中的的反应方程式为
③试计算草酸钙晶体的x(写出计算过程)
您最近一年使用:0次



