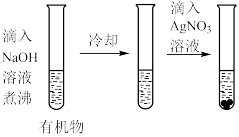
1 . 钛在医疗领域的应用非常广泛,如制人造关节、头盖、主动心瓣等, 是制备金属钛的重要中间体,某小组同学利用如图所示的装置在实验室制备
是制备金属钛的重要中间体,某小组同学利用如图所示的装置在实验室制备 (夹持装置略去).
(夹持装置略去). 易挥发,高温时能与
易挥发,高温时能与 反应,不与
反应,不与 反应,其他相关信息如表所示(
反应,其他相关信息如表所示( 为副产物):
为副产物):
回答下列问题:
(1)装置B中所盛试剂为___________ .
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞
c.检查装置气密性 d.关闭分液漏斗活塞
e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项中选择合适操作(不重复使用)并排序:___________ .
(3)若在反应前,先打开开关 ,从侧管持续通入一段时间的
,从侧管持续通入一段时间的 ,其目的是
,其目的是___________ ;装置C中除生成 外,还生成一种气态不成盐氧化物,该反应的化学方程式为
外,还生成一种气态不成盐氧化物,该反应的化学方程式为___________ ,判断该制备反应结束的实验现象是___________ .
(4)下列说法错误的是___________(填选项字母).
(5) 可用于制备纳米
可用于制备纳米 :以
:以 为载体,用
为载体,用 和水蒸气反应生成
和水蒸气反应生成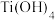 ,再控制温度生成纳米
,再控制温度生成纳米 .测定产物
.测定产物 组成的方法如下:
组成的方法如下:
步骤一:取样品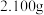 ,用稀硫酸充分溶解得到
,用稀硫酸充分溶解得到 ,再用足量铝将
,再用足量铝将 还原为
还原为 ,过滤并洗涤,将所得滤液和洗涤液合并注入
,过滤并洗涤,将所得滤液和洗涤液合并注入 容量瓶,定容得到待测液.
容量瓶,定容得到待测液.
步骤二:取待测液 于锥形瓶中,加几滴
于锥形瓶中,加几滴 溶液作指示剂,用
溶液作指示剂,用 的
的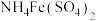 标准溶液滴定,将
标准溶液滴定,将 氧化为
氧化为 ,三次滴定消耗标准溶液体积的平均值为
,三次滴定消耗标准溶液体积的平均值为 .通过分析、计算,该样品中
.通过分析、计算,该样品中
___________ .
 是制备金属钛的重要中间体,某小组同学利用如图所示的装置在实验室制备
是制备金属钛的重要中间体,某小组同学利用如图所示的装置在实验室制备 (夹持装置略去).
(夹持装置略去).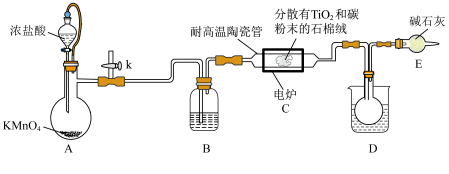
 易挥发,高温时能与
易挥发,高温时能与 反应,不与
反应,不与 反应,其他相关信息如表所示(
反应,其他相关信息如表所示( 为副产物):
为副产物):| 熔点/℃ | 沸点/℃ | 密度 | 水溶性 | |
 |  | 136.4 | 1.7 | 易水解生成白色沉淀,能溶于有机溶剂 |
 |  | 76.8 | 1.6 | 难溶于水 |
(1)装置B中所盛试剂为
(2)组装好仪器后,部分实验步骤如下:
a.装入药品 b.打开分液漏斗活塞
c.检查装置气密性 d.关闭分液漏斗活塞
e.停止加热,充分冷却 f.加热装置C中陶瓷管
从上述选项中选择合适操作(不重复使用)并排序:
(3)若在反应前,先打开开关
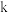 ,从侧管持续通入一段时间的
,从侧管持续通入一段时间的 ,其目的是
,其目的是 外,还生成一种气态不成盐氧化物,该反应的化学方程式为
外,还生成一种气态不成盐氧化物,该反应的化学方程式为(4)下列说法错误的是___________(填选项字母).
A.该装置有缺陷,通过装置 后的气体不可直接排放到空气中 后的气体不可直接排放到空气中 |
B.石棉线载体是为了增大气体与 和碳粉末的接触面积,以加快反应速率 和碳粉末的接触面积,以加快反应速率 |
C.装置D的烧杯中可加入冰水,便于收集到纯的液态 |
D.装置 可防止空气中的水蒸气进入装置 可防止空气中的水蒸气进入装置 的圆底烧瓶中使 的圆底烧瓶中使 变质 变质 |
(5)
 可用于制备纳米
可用于制备纳米 :以
:以 为载体,用
为载体,用 和水蒸气反应生成
和水蒸气反应生成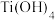 ,再控制温度生成纳米
,再控制温度生成纳米 .测定产物
.测定产物 组成的方法如下:
组成的方法如下:步骤一:取样品
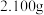 ,用稀硫酸充分溶解得到
,用稀硫酸充分溶解得到 ,再用足量铝将
,再用足量铝将 还原为
还原为 ,过滤并洗涤,将所得滤液和洗涤液合并注入
,过滤并洗涤,将所得滤液和洗涤液合并注入 容量瓶,定容得到待测液.
容量瓶,定容得到待测液.步骤二:取待测液
 于锥形瓶中,加几滴
于锥形瓶中,加几滴 溶液作指示剂,用
溶液作指示剂,用 的
的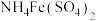 标准溶液滴定,将
标准溶液滴定,将 氧化为
氧化为 ,三次滴定消耗标准溶液体积的平均值为
,三次滴定消耗标准溶液体积的平均值为 .通过分析、计算,该样品中
.通过分析、计算,该样品中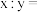
您最近一年使用:0次
名校
2 . 古代硫酸的制法是隔绝空气煅烧绿矾(FeSO4•7H2O),将蒸气冷却可制得一种无色粘稠的液体“绿矾油”,剩余的固体为红棕色。已知SO3的熔点是16.8°C,沸点是44.8°C,在加热条件下SO3具有比较强的氧化性。完成下列各空:
(1)绿矾油中溶质的化学式为_________ 。
(2)用下图装置煅烧绿矾并检验气体产物,煅烧一段时间后,发现D中U形管出现无色粘稠的液体,B中品红溶液褪色。

① 上述装置正确的连接顺序是A→( ) (用大写字母表示)。
② 写出煅烧绿矾的化学方程式_________ 。
(3)绿矾在空气中部分被氧化为硫酸铁,现取3.66g绿巩样品溶于稀盐酸,加入足贵的BaCl2溶液,过滤得沉淀4.66g,向溶液中通入56mL(标准状况)氯气恰好将Fe2+完全氧化,计算变质后的绿矾晶体中n(Fe3+):n(Fe2+)为_________ 。
(1)绿矾油中溶质的化学式为
(2)用下图装置煅烧绿矾并检验气体产物,煅烧一段时间后,发现D中U形管出现无色粘稠的液体,B中品红溶液褪色。

① 上述装置正确的连接顺序是A→
② 写出煅烧绿矾的化学方程式
(3)绿矾在空气中部分被氧化为硫酸铁,现取3.66g绿巩样品溶于稀盐酸,加入足贵的BaCl2溶液,过滤得沉淀4.66g,向溶液中通入56mL(标准状况)氯气恰好将Fe2+完全氧化,计算变质后的绿矾晶体中n(Fe3+):n(Fe2+)为
您最近一年使用:0次
2017-08-26更新
|
178次组卷
|
2卷引用:江西省南昌市2018届高三摸底调研考试化学试题
解题方法
3 . 高铁酸盐是优良的多功能水处理剂。K2FeO4为紫色固体,可溶于水,微溶于浓KOH溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出O2.某实验小组制备高铁酸钾(K2FeO4)并测定产品纯度。回答下列问题:
Ⅰ.制备K2FeO4
装置如下图所示,夹持、加热等装置略。___________ ,装置B中除杂质所用试剂是___________ ,装置D的作用是___________ 。
(2)A中发生反应的离子方程式为___________ 。
(3)C中反应为放热反应,而反应温度须控制在0~5℃,反应中KOH必须过量的原因是___________ 。
(4)写出C中总反应的离子方程式:___________ 。C中混合物经重结晶、有机物洗涤纯化、真空干燥,得到高铁酸钾晶体。
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00 g制得的晶体,配成250 mL溶液,准确量取25.00 mL K2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
(5)根据以上数据,样品中K2FeO4的质量分数为___________ 。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果___________ (填“偏高”“偏低”或“无影响”)。
Ⅰ.制备K2FeO4
装置如下图所示,夹持、加热等装置略。
(2)A中发生反应的离子方程式为
(3)C中反应为放热反应,而反应温度须控制在0~5℃,反应中KOH必须过量的原因是
(4)写出C中总反应的离子方程式:
Ⅱ.K2FeO4产品纯度的测定
准确称取1.00 g制得的晶体,配成250 mL溶液,准确量取25.00 mL K2FeO4溶液放入锥形瓶,加入足量CrCl3和NaOH溶液,振荡,再加入稀硫酸酸化后得Fe3+和Cr2O
 ,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。
,滴入几滴二苯胺磺酸钠作指示剂,用0.0500 mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗(NH4)2Fe(SO4)2标准溶液28.00 mL。(5)根据以上数据,样品中K2FeO4的质量分数为
您最近一年使用:0次
解题方法
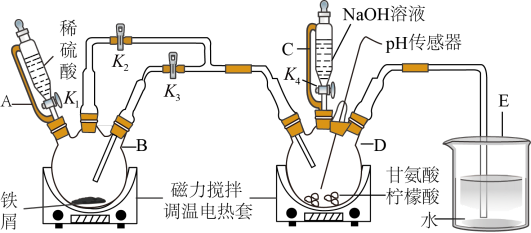
4 . 某小组设计制备补铁剂甘氨酸亚铁的实验步骤和装置图(夹持装置省略)如图:
合成反应为:2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O。
有关物质性质如表所示:
回答下列问题:
(1)步骤I制备FeSO4,先打开K1、K2,关闭K3,充分反应后(仍有气泡),将B中溶液转移到D中的操作是______ 。
(2)步骤I、II中,为了防止Fe2+被氧化,采取的措施有______ 、______ (填2种)。
(3)步骤II,D中反应液pH过高或过低均会导致产率降低,原因是______ 。
(4)下列说法不正确 的是______ 。
(5)步骤V,检测产品中铁元素的含量,需要用到如图电子天平,以差量法 准确称量样品。操作的正确排序为:电子天平开机预热→A→B→______→______→______→______→F。______

A.调水平(使水平仪气泡归中)
B.利用标准码进行校准
C.往称量瓶中加入一定量样品,放回秤盘
D.将称量瓶置于秤盘中间,待示数不变时,按TAR键去皮
E.从称量瓶中倒出一定量样品,放回秤盘
F.关闭侧门,待示数不变时读数记录

合成反应为:2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O。
有关物质性质如表所示:
| 甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,微溶于乙醇 |
| 具有两性 | 酸性和还原性 | 常温不易,氧化变质 |

回答下列问题:
(1)步骤I制备FeSO4,先打开K1、K2,关闭K3,充分反应后(仍有气泡),将B中溶液转移到D中的操作是
(2)步骤I、II中,为了防止Fe2+被氧化,采取的措施有
(3)步骤II,D中反应液pH过高或过低均会导致产率降低,原因是
(4)下列说法
| A.步骤I、II使用滴液漏斗A或C滴入液体时,无需取下上口玻璃塞 |
| B.步骤III加入乙醇的作用是降低甘氨酸亚铁的溶解度,促使其结晶析出 |
| C.步骤III过滤后洗涤,往漏斗中加水浸没沉淀,小心搅拌以加快过滤 |
| D.步骤IV重结晶,将粗产品溶解于适量水中,蒸发浓缩至出现大量晶体,趁热过滤 |

A.调水平(使水平仪气泡归中)
B.利用标准码进行校准
C.往称量瓶中加入一定量样品,放回秤盘
D.将称量瓶置于秤盘中间,待示数不变时,按TAR键去皮
E.从称量瓶中倒出一定量样品,放回秤盘
F.关闭侧门,待示数不变时读数记录
您最近一年使用:0次
名校
5 . 下列实验设计能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A. | 检验有机物中是否含有碘元素 |
|
| B. | 验证久置的 是否变质 是否变质 | 取少量久置的亚硫酸钠样品溶于除氧蒸馏水中,加入足量的稀盐酸,再滴加氯化钡溶液,观察是否有白色沉淀出现 |
| C. | 测定纯碱样品(含 )的纯度 )的纯度 | 取一定质量的纯碱样品与足量的盐酸反应,用碱石灰吸收产生的气体,测定碱石灰的增重 |
| D. | 确认某钾盐中含有硫元素 | 向该钾盐固体中滴加浓盐酸,将产生的气体通入品红溶液,观察到品红溶液褪色 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-03-08更新
|
350次组卷
|
4卷引用:陕西省延安市黄龙县中学2023-2024学年高三下学期开学考试理综试卷-高中化学
陕西省延安市黄龙县中学2023-2024学年高三下学期开学考试理综试卷-高中化学甘肃省张掖市某重点校2023-2024学年高三下学期模拟考化学试题(已下线)通关练03 常考化学实验基础知识-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)陕西省西安工业大学附属中学2023-2024学年高三下学期3月月考理科综合试题-高中化学
名校
6 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 探究金属钠在氧气中受热所剩固体的成分 | 取少量固体粉末,加入 蒸馏水 蒸馏水 | 若无气体生成,则固体粉末为 ;若有气体生成,则固体粉末为 ;若有气体生成,则固体粉末为 |
| B | 探究 与 与 反应的限度 反应的限度 | 取 溶液于试管中,加入 溶液于试管中,加入 溶液,充分反应后滴入几滴 溶液,充分反应后滴入几滴 溶液 溶液 | 若溶液变红,则 与 与 的反应有一定限度 的反应有一定限度 |
| C | 检验某无色溶液中是否含有 | 取少量该溶液于试管中,滴加稀氢氧化钠溶液,用湿润的红色石蕊试纸放试管口 | 试纸不变蓝,证明溶液中无铵根离子 |
| D | 探究 固体样品是否变质 固体样品是否变质 | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量 溶液 溶液 | 若有白色沉淀产生,则样品已经变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-11-13更新
|
233次组卷
|
4卷引用:黑龙江省佳木斯市第十二中学2022-2023学年高二上学期开学考试化学试题
解题方法
7 . 常温下,根据下列实验操作和现象得出的结论正确的是
| 选项 | 实验操作和现象 | 实验结论 |
| A | 分别测量浓度均为0.1mol·L-1Na2CO3溶液和Na[Al(OH)4]溶液的pH,后者pH更大 | Al(OH) 比CO 比CO 更容易结合H+ 更容易结合H+ |
| B | 将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液,出现白色沉淀 | 亚硫酸钠样品已变质 |
| C | 将盐酸滴入Na2CO3溶液产生无色气体,将产生的气体直接通入Na2SiO3溶液, | 非金属性:Cl>C>Si |
| D | 向BaCl2溶液中通入SO2和气体X,出现白色沉淀 | 气体X一定具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
解题方法
8 . 下列实验操作或实验方案,能达到目的的是
选项 | 实验操作或实验方案 | 目的 |
A | 向有MnO2固体的圆底烧瓶中加入浓盐酸,产生的气体依次通过饱和食盐水和浓硫酸 | 制取并纯化氯气 |
B | 取少量待测样品溶于蒸馏水,加入足量稀盐酸,再加入足量BaCl2溶液 | 检验Na2SO3固体是否变质 |
C | 用湿润的淀粉碘化钾试纸检验某气体,试纸变蓝 | 证明该气体为Cl2 |
D | 将NaOH待测液滴在湿润的pH试纸上,与标准比色卡对照 | 测定NaOH溶液的pH |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
9 . 氨基甲酸铵( )是一种重要的化工原料,可用作化学肥料、灭火剂洗涤剂等。某化学兴趣小组用以下装置模拟工业原理制备氨基甲酸铵。
)是一种重要的化工原料,可用作化学肥料、灭火剂洗涤剂等。某化学兴趣小组用以下装置模拟工业原理制备氨基甲酸铵。
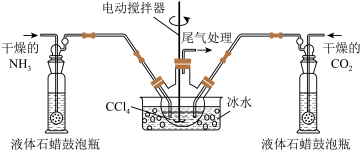
已知:①制取氨基甲酸铵反应为: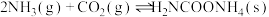
 。
。
②氨基甲酸铵易分解、易吸水,溶于水后生成碳酸氢铵和一水合氨。
③四氯化碳与液体石蜡均为惰性介质。
回答下列问题:
(1)若用如图所示装置制取氨气,你所选择的试剂是_______ 。
(2)液体石蜡鼓泡瓶的作用是_______ ,尾气处理装置中的试剂是_______ 。
(3)三颈烧瓶需用冰水浴冷却,其目的是_______ 。
(4) 液体中产生较多晶体悬浮物时,即停止反应,从三颈烧瓶中分离出粗产品的操作是
液体中产生较多晶体悬浮物时,即停止反应,从三颈烧瓶中分离出粗产品的操作是_______ 。
(5)将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡: 。可以判断该反应已经达到平衡的是_______。
。可以判断该反应已经达到平衡的是_______。
(6)因部分变质而混有碳酸氢铵的氨基甲酸铵样品1.173g,用足量石灰水充分反应后,使碳元素全部转化为碳酸钙,经过滤、洗涤、干燥后称量,测得质量为1.500g。样品中氨基甲酸铵的质量分数是_______ 。(计算结果保留四位有效数字)[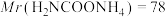 、
、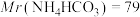 ]
]
 )是一种重要的化工原料,可用作化学肥料、灭火剂洗涤剂等。某化学兴趣小组用以下装置模拟工业原理制备氨基甲酸铵。
)是一种重要的化工原料,可用作化学肥料、灭火剂洗涤剂等。某化学兴趣小组用以下装置模拟工业原理制备氨基甲酸铵。
已知:①制取氨基甲酸铵反应为:
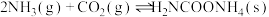
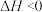 。
。②氨基甲酸铵易分解、易吸水,溶于水后生成碳酸氢铵和一水合氨。
③四氯化碳与液体石蜡均为惰性介质。
回答下列问题:
(1)若用如图所示装置制取氨气,你所选择的试剂是

(2)液体石蜡鼓泡瓶的作用是
(3)三颈烧瓶需用冰水浴冷却,其目的是
(4)
 液体中产生较多晶体悬浮物时,即停止反应,从三颈烧瓶中分离出粗产品的操作是
液体中产生较多晶体悬浮物时,即停止反应,从三颈烧瓶中分离出粗产品的操作是(5)将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡:
 。可以判断该反应已经达到平衡的是_______。
。可以判断该反应已经达到平衡的是_______。A. |
| B.容器中总压强不变 |
| C.容器中混合气体的平均相对分子质量不变 |
| D.容器中氨气的体积分数不变 |
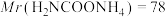 、
、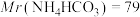 ]
]
您最近一年使用:0次
2022-11-01更新
|
162次组卷
|
2卷引用:湖北省武汉市洪山高级中学2022-2023学年高二上学期开学考试化学试题
名校
10 .  是一种常用的补血剂,在空气中易变质。某同学通过如下实验测定该补血剂中
是一种常用的补血剂,在空气中易变质。某同学通过如下实验测定该补血剂中 的含量:先称取
的含量:先称取 样品,用煮沸冷却的蒸馏水配制成
样品,用煮沸冷却的蒸馏水配制成 溶液;再量取
溶液;再量取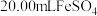 溶液于锥形瓶中,逐滴滴入
溶液于锥形瓶中,逐滴滴入 的
的 溶液,反应完全后,共消耗
溶液,反应完全后,共消耗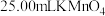 溶液(不考虑空气对反应的影响)。下列说法错误的是
溶液(不考虑空气对反应的影响)。下列说法错误的是
 是一种常用的补血剂,在空气中易变质。某同学通过如下实验测定该补血剂中
是一种常用的补血剂,在空气中易变质。某同学通过如下实验测定该补血剂中 的含量:先称取
的含量:先称取 样品,用煮沸冷却的蒸馏水配制成
样品,用煮沸冷却的蒸馏水配制成 溶液;再量取
溶液;再量取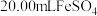 溶液于锥形瓶中,逐滴滴入
溶液于锥形瓶中,逐滴滴入 的
的 溶液,反应完全后,共消耗
溶液,反应完全后,共消耗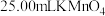 溶液(不考虑空气对反应的影响)。下列说法错误的是
溶液(不考虑空气对反应的影响)。下列说法错误的是A.该反应的离子方程式为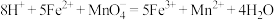 |
B.该样品中 的含量为21.875% 的含量为21.875% |
C.配制溶液时需用到的玻璃仪器仅有烧杯、漏斗、量筒、玻璃棒和 容量瓶 容量瓶 |
| D.用煮沸冷却的蒸馏水配制溶液的目的是除去溶解在水中的氧气 |
您最近一年使用:0次
2023-02-03更新
|
136次组卷
|
2卷引用:河北省保定市定州市第二中学2022-2023学年高一下学期开学考试化学试题