1 . 苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
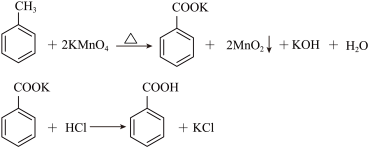
已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g。
实验流程:
①往装置A中加入2.7mL(2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示。
请回答:
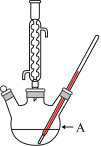
(1)装置A的名称_________ 。若不用温度计,本实验控制反应温度的措施为__________ 。
(2)白色粗产品中除了KCl外,其他可能的无机杂质为________________ 。
(3)操作②中趁热过滤的目的是_______________ ,操作I的名称_______________ 。
(4)步骤③中用到的定量仪器有分析天平,_____________ ,50mL酸式、碱式滴定管。
(5)样品中苯甲酸纯度为_____________________ 。
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将______________ (填“偏大”、“偏小”或“不变”)。


已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g。
实验流程:
①往装置A中加入2.7mL(2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示。
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(1)装置A的名称
(2)白色粗产品中除了KCl外,其他可能的无机杂质为
(3)操作②中趁热过滤的目的是
(4)步骤③中用到的定量仪器有分析天平,
(5)样品中苯甲酸纯度为
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将
您最近一年使用:0次
2 . 亚氯酸钠(NaClO2)是重要漂白剂,探究小组开展如下实验,回答下列问题:
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取.
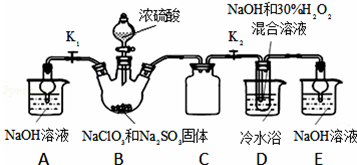
已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)装置C的作用是_______________ ;
(2)已知装置B中的产物有ClO2气体,则装置B中反应的方程式为________________ ;装置D中反应生成NaClO2的化学方程式为_________________ ;反应后的溶液中阴离子除了ClO2﹣、ClO3﹣、Cl﹣、ClO﹣、OH﹣外还可能含有的一种阴离子是_________ ;检验该离子的方法是______________ ;
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤.
①减压,55℃蒸发结晶;②___________ ;③____________ ;④___________ 得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是______________ ;
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣).请计算所称取的样品中NaClO2的物质的量为_______________ .
实验Ⅰ:制取NaClO2晶体按如下图装置进行制取.

已知:NaClO2饱和溶液在低于38℃时析出NaClO2•3H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)装置C的作用是
(2)已知装置B中的产物有ClO2气体,则装置B中反应的方程式为
(3)请补充从装置D反应后的溶液中获得NaClO2晶体的操作步骤.
①减压,55℃蒸发结晶;②
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是
实验Ⅱ:样品杂质分析与纯度测定
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2﹣+4I﹣+4H+=2H2O+2I2+Cl﹣,将所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,加入淀粉溶液做指示剂,用c mol•L﹣1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣).请计算所称取的样品中NaClO2的物质的量为
您最近一年使用:0次
2016-12-09更新
|
141次组卷
|
2卷引用:2016届四川省成都市邛崃市高埂中学高三上学期开学考试化学试卷
名校
3 . 以NaCl等为原料制备KClO4的过程如下:
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为_______ L(标准状况)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是________________ 。

(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl- (反应为:3 KClO4 +C6H12O6 ═ 6 H2O + 6 CO2↑ + 3 KCl),加入少量K2CrO4溶液作指示剂,用0. 20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=________________ mol/L。
② 计算KClO4样品的纯度(请写出计算过程。)______________________________
①在无隔膜、微酸性条件下,发生反应:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3。
③一定条件下反应:4KClO3=3KClO4+KCl,将产物分离得到KClO4。
(1)电解时,产生质量为2.13g NaClO3,同时得到H2的体积为
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是

(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验:
准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4-全部转化为Cl- (反应为:3 KClO4 +C6H12O6 ═ 6 H2O + 6 CO2↑ + 3 KCl),加入少量K2CrO4溶液作指示剂,用0. 20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积21.00mL。滴定达到终点时,产生砖红色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,则此时c(Cl-)=
② 计算KClO4样品的纯度(请写出计算过程。)
您最近一年使用:0次
2016-12-09更新
|
304次组卷
|
6卷引用:2017届江苏省丹阳高级中学高三下学期期初考试化学试卷
4 . 我国市售加碘食盐中含有碘酸钾。已知碘酸钾在酸性条件下是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应。工业生产碘酸钾的流程如下:

请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式: 。
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:② (请从化学平衡角度解释)。
(3)已知几种物质的溶解度见下表:
由上表数据分析可知,操作Ⅰ的名称为 、 。
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是 。
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1 g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0 mol·L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00 mL,则成品中KIO3的质量分数为 (列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O,I2+2Na2S2O3===2NaI+Na2S4O6)。
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示 。
②根据乙同学的实验结果推测,甲同学的实验结果会 (填“偏大”,“偏小”或“无影响”)。

请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式: 。
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:② (请从化学平衡角度解释)。
(3)已知几种物质的溶解度见下表:
| KCl | KH(IO3)2 | KClO3 | |
| 溶解度g/100 g水(25 ℃) | 20.8 | 0.8 | 7.5 |
| 溶解度g/100 g水(80 ℃) | 37.1 | 12.4 | 16.2 |
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是 。
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1 g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0 mol·L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00 mL,则成品中KIO3的质量分数为 (列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O,I2+2Na2S2O3===2NaI+Na2S4O6)。
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡。 | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡。 | 溶液变蓝色 |
②根据乙同学的实验结果推测,甲同学的实验结果会 (填“偏大”,“偏小”或“无影响”)。
您最近一年使用:0次
名校
5 . 碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂、抗酸剂等。其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝。
(1)碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为________ 。
(2)碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃;③________________________ 。
(3)若pH过高,则对产品的影响是________________________ 。
(4)为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO20.448 L(已换算成标准状况下),并测得溶液中含有0.02 mol Al3+。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成__________________________ (写出计算过程)。
(1)碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为
(2)碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃;③
(3)若pH过高,则对产品的影响是
(4)为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880 g样品用足量稀硝酸溶解,得到CO20.448 L(已换算成标准状况下),并测得溶液中含有0.02 mol Al3+。
②加热至340 ℃以上时样品迅速分解,得到金属氧化物、CO2和H2O。当样品分解完全时,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成
您最近一年使用:0次
2016-12-09更新
|
254次组卷
|
3卷引用:江苏省泰州中学2018届高三上学期开学考试化学试题
解题方法
6 . CuSO4溶液与K2C2O4溶液混合反应,产物之一是只含一种阴离子的蓝色钾盐水合物。通过下述实验确定该晶体的组成。
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL。
已知涉及的部分离子方程式如下:
步骤a:2 MnO +5C2O
+5C2O +16H+= 2Mn2++8H2O+10CO2↑
+16H+= 2Mn2++8H2O+10CO2↑
步骤b:2Cu2++4I-= 2CuI↓+I2 I2+2S2O = 2I-+S4O
= 2I-+S4O
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中
c(I-)≥________ mol·L-1。
(2)MnO4-在酸性条件下,加热能分解为O2;同时生成Mn2+。该反应的离子方程式为_______________ ;若无该操作,则测定的Cu2+的含量将会__________ (填“偏高”、“偏低”或“不变”)。
(3)步骤b用淀粉溶液作指示剂,则滴定终点观察到的现象为_____________________ 。
(4)通过计算确定样品晶体的组成_____________________ 。
步骤a:称取0.672 0 g样品,放入锥形瓶,加入适量2 mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.200 0 mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL。
步骤b:接着将溶液充分加热,使淡紫红色消失,溶液最终呈现蓝色。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.250 0 mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL。
已知涉及的部分离子方程式如下:
步骤a:2 MnO
 +5C2O
+5C2O +16H+= 2Mn2++8H2O+10CO2↑
+16H+= 2Mn2++8H2O+10CO2↑步骤b:2Cu2++4I-= 2CuI↓+I2 I2+2S2O
 = 2I-+S4O
= 2I-+S4O
(1)已知室温下CuI的Ksp=1.27×10-12,欲使溶液中c(Cu+)≤1.0×10-6 mol·L-1,应保持溶液中
c(I-)≥
(2)MnO4-在酸性条件下,加热能分解为O2;同时生成Mn2+。该反应的离子方程式为
(3)步骤b用淀粉溶液作指示剂,则滴定终点观察到的现象为
(4)通过计算确定样品晶体的组成
您最近一年使用:0次
2016-12-09更新
|
376次组卷
|
3卷引用:2017届江苏省丹阳高级中学高三上期初考试化学试卷
14-15高三上·湖北恩施·开学考试
名校
7 . 高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿(主要成分是二氧化锰)制高锰酸钾的流程如下(部分条件和产物省略):
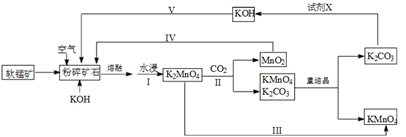
请回答下列问题:
(1)提高锰酸钾浸出率(浸出锰酸钾质量与固体总质量之比)的措施有______________________ 。
(2)写出向二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式:___________________________________ 。
(3)从经济性考虑试剂X宜选择(填名称):___________ 。上述流程中,设计步骤IV和V的目的是____________________________________ 。
(4)以惰性材料为电极,采用电解锰酸钾溶液的方法完成步骤III转化。
①阳极反应式为___________________ 。
②电解过程中,阴极附近电解质溶液的pH将_______ (填:增大、减小或不变)。
(5)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不变色时,达到滴定终点。写出离子方程式:__________________ 。
(6)已知:常温下,Ksp [Mn(OH)2]=2.010-13。工业上,调节pH沉淀废水中Mn2+。当pH=10时,溶液中c(Mn2+)=______________ 。

请回答下列问题:
(1)提高锰酸钾浸出率(浸出锰酸钾质量与固体总质量之比)的措施有
(2)写出向二氧化锰和氢氧化钾熔融物中通入空气时发生的主要化学反应的方程式:
(3)从经济性考虑试剂X宜选择(填名称):
(4)以惰性材料为电极,采用电解锰酸钾溶液的方法完成步骤III转化。
①阳极反应式为
②电解过程中,阴极附近电解质溶液的pH将
(5)测定高锰酸钾样品纯度:向高锰酸钾溶液中滴定硫酸锰溶液,产生黑色沉淀。当溶液由紫红色刚好褪色且半分钟不变色时,达到滴定终点。写出离子方程式:
(6)已知:常温下,Ksp [Mn(OH)2]=2.010-13。工业上,调节pH沉淀废水中Mn2+。当pH=10时,溶液中c(Mn2+)=
您最近一年使用:0次



