名校
解题方法
1 . 铅铬黄是一种颜料,主要成分是铬酸铅 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
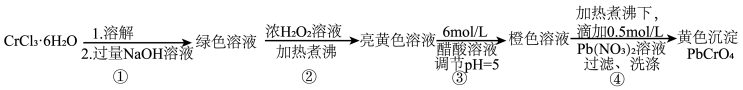
回答下列问题:
(1)已知 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是_______ 。
(2)第②步生成了 ,写出该步骤的离子方程式
,写出该步骤的离子方程式_______ 。为了使 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是_______ (填序号)。
A.首先加热绿色溶液,然后将一定量 浓溶液滴入其中
浓溶液滴入其中
B.首先加热 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中
C.首先将一定量 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸
(3)第③步调节pH=5的目的是为了将 转化为
转化为_______ (填写离子符号),并且防止在碱性条件下_______ 形成沉淀。
(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:_______ 。
(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为 ,再用
,再用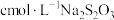 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=_______ (用含c、m和V的式子表示)。
 (摩尔质量323g/mol)。现以
(摩尔质量323g/mol)。现以 和
和 等为原料制备该物质,并测定产物纯度。
等为原料制备该物质,并测定产物纯度。
回答下列问题:
(1)已知
 不溶于水,具有两性。第①步所得绿色溶液中的有色离子是
不溶于水,具有两性。第①步所得绿色溶液中的有色离子是(2)第②步生成了
 ,写出该步骤的离子方程式
,写出该步骤的离子方程式 反应充分而不剩余,以下方案中最合理的是
反应充分而不剩余,以下方案中最合理的是A.首先加热绿色溶液,然后将一定量
 浓溶液滴入其中
浓溶液滴入其中B.首先加热
 浓溶液,然后转入热的绿色溶液中
浓溶液,然后转入热的绿色溶液中C.首先将一定量
 浓溶液滴入绿色溶液中,然后加热煮沸
浓溶液滴入绿色溶液中,然后加热煮沸(3)第③步调节pH=5的目的是为了将
 转化为
转化为(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加
 溶液后,产生
溶液后,产生 黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:
黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为
 ,再用
,再用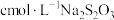 标准溶液滴定至淡黄绿色,发生反应
标准溶液滴定至淡黄绿色,发生反应 。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=
您最近一年使用:0次
2022-08-30更新
|
243次组卷
|
2卷引用:四川省成都市第七中学2023届高三上学期入学考试化学试题
2 . 工业上用饱和食盐水吸收尾气 和
和 制备无水
制备无水 。同时得到副产物
。同时得到副产物 。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
。实验室用如图装置模拟该制备过程(加热和固定装置已省略):

已知:浓硫酸的沸点为338℃。回答下列问题:
(1)仪器a的名称_______ ,导气管b的作用_______ 。
(2)装置A中发生的化学反应的化学方程式为_______ 。
(3)固、固加热制取氨气的发生装置可以选择下图中的_______ (填编号),反应的化学方程式为_______ 。

(4)利用各物质的溶解度曲线图(见图)分离产品,取出装置B中的溶液,蒸发浓缩,趁热过滤可得_______ ,然后将滤液_______ 、过滤、洗涤、干燥可得另一产物。

(5)产品中可能混有少量 和
和 杂质,混有
杂质,混有 杂质的原因可能是
杂质的原因可能是_______ ,检验产品中含有 的的实验方法:取少量样品于试管中,加入适量水溶解,
的的实验方法:取少量样品于试管中,加入适量水溶解,_______ 。
【可选试剂:稀硝酸、 溶液、酸性
溶液、酸性 溶液、
溶液、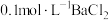 溶液、
溶液、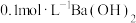 溶液、
溶液、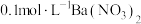 溶液】
溶液】
 和
和 制备无水
制备无水 。同时得到副产物
。同时得到副产物 。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
。实验室用如图装置模拟该制备过程(加热和固定装置已省略):
已知:浓硫酸的沸点为338℃。回答下列问题:
(1)仪器a的名称
(2)装置A中发生的化学反应的化学方程式为
(3)固、固加热制取氨气的发生装置可以选择下图中的

(4)利用各物质的溶解度曲线图(见图)分离产品,取出装置B中的溶液,蒸发浓缩,趁热过滤可得

(5)产品中可能混有少量
 和
和 杂质,混有
杂质,混有 杂质的原因可能是
杂质的原因可能是 的的实验方法:取少量样品于试管中,加入适量水溶解,
的的实验方法:取少量样品于试管中,加入适量水溶解,【可选试剂:稀硝酸、
 溶液、酸性
溶液、酸性 溶液、
溶液、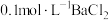 溶液、
溶液、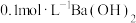 溶液、
溶液、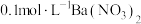 溶液】
溶液】
您最近一年使用:0次
2023-02-25更新
|
1014次组卷
|
4卷引用:江西省宜春市丰城中学2023-2024学年高二上学期入学考试化学试题
名校
3 . 铁有两种氯化物,都是重要的化工试剂。查阅有关资料如下:(氯化铁)熔点为306℃,沸点为315℃;易吸收空气中的水分而潮解,工业上采用向500~600℃的铁粉中通入氯气来生产无水氯化铁。(氯化亚铁)熔点为670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。某化学活动小组用如图所示的装置(夹持装置略去)模拟工业生产制备无水化。请回答下列问题:
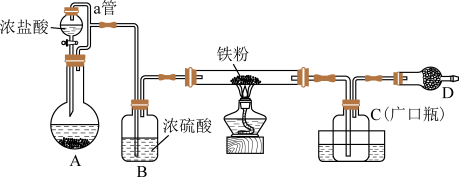
(1)添加浓盐酸的仪器名称是_______ 。
(2)在装置A中,用 与浓盐酸反应制取氯气,写出反应的离子方程式
与浓盐酸反应制取氯气,写出反应的离子方程式_______ 。
(3)D中装的药品是碱石灰,其作用是_______ 。
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的_______ (只能选取一种试剂,填序号)进行俭测。
①H2O2溶液 ②KI一淀粉溶液 ③KSCN溶液 ④K3[Fe(CN)6]溶液
(5)定量分析。取装置C中的产物,按以下步骤进行测定:
①称取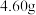 产品溶于过量的稀盐酸中;
产品溶于过量的稀盐酸中;
②加入足量 溶液;
溶液;
③再加入足量 溶液:
溶液:
④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为 。
。
则该样品中铁元素的质量分数为_______ %(结果精确到小数点后两位)。
(6)由(5)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量_______ (填“相等”“偏高”或“偏低”),说明含有FeCl2杂质。
②若要得到较纯净的无水氧化铁,可采取的“装置”改进措施是_______ 。

(1)添加浓盐酸的仪器名称是
(2)在装置A中,用
 与浓盐酸反应制取氯气,写出反应的离子方程式
与浓盐酸反应制取氯气,写出反应的离子方程式(3)D中装的药品是碱石灰,其作用是
(4)定性分析。取装置C中的少量产物溶于稀硫酸中配成稀溶液待用。若产物中混有FeCl2,可用下列试剂中的
①H2O2溶液 ②KI一淀粉溶液 ③KSCN溶液 ④K3[Fe(CN)6]溶液
(5)定量分析。取装置C中的产物,按以下步骤进行测定:
①称取
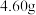 产品溶于过量的稀盐酸中;
产品溶于过量的稀盐酸中;②加入足量
 溶液;
溶液;③再加入足量
 溶液:
溶液:④过滤、洗涤后灼烧沉淀;
⑤称量所得红棕色固体为
 。
。则该样品中铁元素的质量分数为
(6)由(5)定量分析数据得出结论,并提出改进措施。
①用题目所给的装置制得的产物中,铁元素含量
②若要得到较纯净的无水氧化铁,可采取的“装置”改进措施是
您最近一年使用:0次
解题方法
4 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 检验某无色溶液中是否含有 | 取少量该溶液于试管中,加足量稀硫酸,产生气体通入澄清石灰水中 | 若产生无色无味的气体,且石灰水变浑浊,则该溶液中含 |
| B | 探究 与水蒸气高温反应的固体产物中铁元素的化合价 与水蒸气高温反应的固体产物中铁元素的化合价 | 取少量固体产物于试管中,加足量的稀盐酸溶解,分成两份;一份中滴加硫氰化钾溶液,另一份中滴加高锰酸钾溶液 | 若前者溶液变血红色,后者溶液紫色褪去,则固体产物中铁元素有 、 、 两种化合价 两种化合价 |
| C | 探究乙烯能否被酸性高锰酸钾氧化 | 向乙醇中加入适量浓硫酸制备乙烯,并将产生的气体直接通入酸性高锰酸钾溶液中 | 溶液紫红色褪去,说明乙烯能被酸性高锰酸钾氧化 |
| D | 检验某牙膏中是否存在甘油 | 取少量该牙膏样品于试管中,加适量蒸馏水,搅拌、静置,取上层清液,加入适量新制氢氧化铜 | 若产生绛蓝色溶液,则该牙膏中含甘油 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
5 . 如图是铜与浓硫酸反应并验证其产物性质的装置图。请回答下列问题。
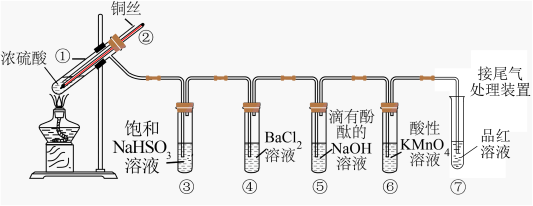
(1)试管①中发生反应的化学方程式为____ ;其中硫酸发生了____ (填“氧化”或“还原”)反应。
(2)一段时间后,④中溶液无明显现象,⑤⑥⑦溶液均褪色,试管⑤⑥⑦中的现象分别说明SO2的水溶液具有____ 、SO2具有____ 、漂白性。
(3)下列说法正确的是____ (填字母)。
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物CuSO4,可立刻向试管①中加水,观察颜色
(4)充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中n(Cu2+)变大的是____ (填字母)。
a.HClb.Fe2O3c.KNO3
(5)反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为____ 。
(6)为了测定尾气中SO2的含量,将尾气样品经过管道通入盛有400mL0.1mol·L-1酸性KMnO4溶液的密闭容器中。若管道中气体流量为aL·min-1,经过8min溶液恰好褪色,假定样品中SO2被充分吸收,该尾气样品中SO2的含量为____ g·L-1。(假设尾气中其他气体不与酸性KMnO4溶液反应)

(1)试管①中发生反应的化学方程式为
(2)一段时间后,④中溶液无明显现象,⑤⑥⑦溶液均褪色,试管⑤⑥⑦中的现象分别说明SO2的水溶液具有
(3)下列说法正确的是
a.上下移动铜丝可控制反应的发生与停止
b.反应结束后,从导管向装置中鼓入空气,使气体完全被吸收,防止污染
c.实验结束后,试管①中有白色固体出现,为确认白色固体为产物CuSO4,可立刻向试管①中加水,观察颜色
(4)充分反应后发现,铜丝与硫酸都有剩余,在此情况下,加入下列物质能使溶液中n(Cu2+)变大的是
a.HClb.Fe2O3c.KNO3
(5)反应停止后,待装置冷却,向试管④中加入氯水,产生白色沉淀,反应的离子方程式为
(6)为了测定尾气中SO2的含量,将尾气样品经过管道通入盛有400mL0.1mol·L-1酸性KMnO4溶液的密闭容器中。若管道中气体流量为aL·min-1,经过8min溶液恰好褪色,假定样品中SO2被充分吸收,该尾气样品中SO2的含量为
您最近一年使用:0次
2022-08-24更新
|
77次组卷
|
2卷引用:安徽省宣城市三校2022-2023学年高二上学期期初联考化学试题
名校
解题方法
6 . 研究小组为探究 在空气中变质后的产物,进行如下实验并记录现象。
在空气中变质后的产物,进行如下实验并记录现象。
实验①:取 样品加水溶解,得到澄清溶液a。
样品加水溶解,得到澄清溶液a。
实验②:取少量溶液a,向其中加入过量盐酸,有臭鸡蛋气味的气体生成,且出现淡黄色浑浊。
实验③:将实验②中的浊液过滤,向滤液中加入 溶液,产生白色沉淀。
溶液,产生白色沉淀。
已知信息:i. 溶液能溶解S,并生成
溶液能溶解S,并生成 ,
, 与酸反应生成S和
与酸反应生成S和 (臭鸡蛋气味);ii.
(臭鸡蛋气味);ii. 易溶于水。
易溶于水。
下列说法不正确的是
 在空气中变质后的产物,进行如下实验并记录现象。
在空气中变质后的产物,进行如下实验并记录现象。实验①:取
 样品加水溶解,得到澄清溶液a。
样品加水溶解,得到澄清溶液a。实验②:取少量溶液a,向其中加入过量盐酸,有臭鸡蛋气味的气体生成,且出现淡黄色浑浊。
实验③:将实验②中的浊液过滤,向滤液中加入
 溶液,产生白色沉淀。
溶液,产生白色沉淀。已知信息:i.
 溶液能溶解S,并生成
溶液能溶解S,并生成 ,
, 与酸反应生成S和
与酸反应生成S和 (臭鸡蛋气味);ii.
(臭鸡蛋气味);ii. 易溶于水。
易溶于水。下列说法不正确的是
A.实验②中淡黄色浑浊可能是 与 与 反应产生的 反应产生的 |
B.实验①和实验②说明 样品中一定含有S 样品中一定含有S |
C.实验③中产生的白色沉淀是 |
D. 样品中可能含有 样品中可能含有 |
您最近一年使用:0次
2023-02-09更新
|
693次组卷
|
12卷引用:北京交通大学附属中学2023-2024学年高三上学期开学考试化学试题
北京交通大学附属中学2023-2024学年高三上学期开学考试化学试题北京市第一○一中学2023-2024学年高三下学期开学考试化学试题北京市西城区2021~2022学年高三上学期期末考试化学试题河北省五校联盟(保定市第一中学等)2021-2022学年高三下学期3月模拟考试化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)化学-2022年高考押题预测卷01(北京卷)安徽省示范高中培优联盟 2022-2023学年高二上学期联赛化学试题黑龙江省佳木斯市第十二中学2022-2023学年高三上学期期中考试化学试题巩固训练7北京市第二中学2022-2023学年高二下学期3月月考化学试题北京市第二中学2023-2024学年高三上学期12月月考化学试题(已下线)北京市第四中学2023-2024学年高三下学期一模模拟化学试题
名校
解题方法
7 . 我国规定,食盐中加入KIO3。某厂生产碘酸钾(KIO3)的工艺流程如图:
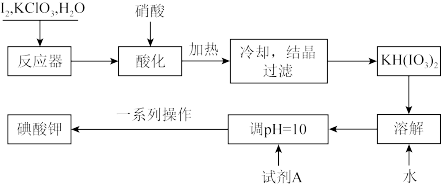
请回答下列问题:
(1)试剂A是____ ;流程图中“一系列操作”包括蒸发浓缩、降温结晶、过滤、洗涤、干燥。其中,“洗涤剂”是75%的酒精,而不用蒸馏水,其主要原因是____ 。
(2)工业上,还可用电解法制取KIO3。以石墨和不锈钢为电极材料,电解KI溶液。化学方程式为KI+3H2O KIO3+3H2↑。在该反应中,氧化产物是
KIO3+3H2↑。在该反应中,氧化产物是____ 。
(3)常用KI淀粉试纸检验碘盐,其操作是:取少量样品溶于蒸馏水,加几滴食醋,用KI淀粉试纸蘸取该溶液,若变蓝色,则该盐为加碘盐。写出离子方程式____ 。
(4)测定产品纯度:取wg产品溶于蒸馏水,配制成250mL溶液。取20mL所配制溶液于锥形瓶中,加入过量的KI溶液,滴适量稀硫酸,再滴加几滴指示剂B,用cmol·L-1Na2S2O3溶液滴定至终点,消耗标准溶液为VmL。已知:I2+2S2O =2I-+S4O
=2I-+S4O 。
。
①根据上述数据,测得产品纯度为____ (用含w、c、V表达式表示)。
②为了充分反应,滴定之前需要“振荡”锥形瓶中溶液,如果振荡时间过长,测得结果会____ (填“偏高”、“偏低”或“无影响”)。

请回答下列问题:
(1)试剂A是
(2)工业上,还可用电解法制取KIO3。以石墨和不锈钢为电极材料,电解KI溶液。化学方程式为KI+3H2O
 KIO3+3H2↑。在该反应中,氧化产物是
KIO3+3H2↑。在该反应中,氧化产物是(3)常用KI淀粉试纸检验碘盐,其操作是:取少量样品溶于蒸馏水,加几滴食醋,用KI淀粉试纸蘸取该溶液,若变蓝色,则该盐为加碘盐。写出离子方程式
(4)测定产品纯度:取wg产品溶于蒸馏水,配制成250mL溶液。取20mL所配制溶液于锥形瓶中,加入过量的KI溶液,滴适量稀硫酸,再滴加几滴指示剂B,用cmol·L-1Na2S2O3溶液滴定至终点,消耗标准溶液为VmL。已知:I2+2S2O
 =2I-+S4O
=2I-+S4O 。
。①根据上述数据,测得产品纯度为
②为了充分反应,滴定之前需要“振荡”锥形瓶中溶液,如果振荡时间过长,测得结果会
您最近一年使用:0次
2022-07-29更新
|
208次组卷
|
3卷引用:河南省焦作市修武县第一中学2022-2023学年高二上学期定位考试化学试题
8 . 用工业钒渣(含 、
、 、Fe)制备工业催化剂
、Fe)制备工业催化剂 的流程如图所示:
的流程如图所示:
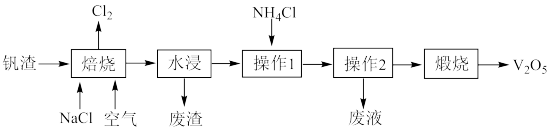
已知:
① 为白色或淡黄色晶体,易溶于水。
为白色或淡黄色晶体,易溶于水。
② 为白色的结晶性粉末,微溶于冷水,溶于热水。
为白色的结晶性粉末,微溶于冷水,溶于热水。
(1)硫酸工业中, 转化为
转化为 选用
选用 作催化剂,催化过程分两步完成,第二步方程式为
作催化剂,催化过程分两步完成,第二步方程式为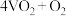
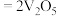 ,则第一步方程式为
,则第一步方程式为_______ 。
(2)“焙烧”过程的产物之一为 ,写出生成
,写出生成 的化学方程式:
的化学方程式:_______ 。废渣的主要成分为氧化铁和_______ 。
(3)“操作1”需要加入过量氯化铵,其目的是_______ ;实验室完成“操作2”时需要用到的玻璃仪器有_______ ;若操作后得到的目标产物纯度不够,则提纯目标产物的方法是_______ 。
(4)“煅烧”中,除生成 外,还生成
外,还生成_______ 。
(5)测定产品纯度的实验步骤如下:
①称取样品ag,加入硫酸,得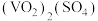 溶液;
溶液;
②加入b
 溶液V1mL(过量),发生如下反应:
溶液V1mL(过量),发生如下反应: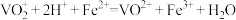
③过量的 用c
用c
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积为
溶液体积为 mL。
mL。
当加入最后一滴 溶液时,溶液变为
溶液时,溶液变为_______ ,且半分钟内不恢复原色,说明达到滴定终点。假设杂质不参与反应,则产品中 的质量分数为
的质量分数为_______ %。
 、
、 、Fe)制备工业催化剂
、Fe)制备工业催化剂 的流程如图所示:
的流程如图所示:
已知:
①
 为白色或淡黄色晶体,易溶于水。
为白色或淡黄色晶体,易溶于水。②
 为白色的结晶性粉末,微溶于冷水,溶于热水。
为白色的结晶性粉末,微溶于冷水,溶于热水。(1)硫酸工业中,
 转化为
转化为 选用
选用 作催化剂,催化过程分两步完成,第二步方程式为
作催化剂,催化过程分两步完成,第二步方程式为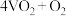
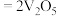 ,则第一步方程式为
,则第一步方程式为(2)“焙烧”过程的产物之一为
 ,写出生成
,写出生成 的化学方程式:
的化学方程式:(3)“操作1”需要加入过量氯化铵,其目的是
(4)“煅烧”中,除生成
 外,还生成
外,还生成(5)测定产品纯度的实验步骤如下:
①称取样品ag,加入硫酸,得
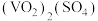 溶液;
溶液;②加入b

 溶液V1mL(过量),发生如下反应:
溶液V1mL(过量),发生如下反应: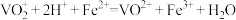
③过量的
 用c
用c
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积为
溶液体积为 mL。
mL。当加入最后一滴
 溶液时,溶液变为
溶液时,溶液变为 的质量分数为
的质量分数为
您最近一年使用:0次
2022-05-22更新
|
185次组卷
|
2卷引用:重庆市2023-2024学年高二下学期开学考试化学试题
名校
9 . Mn及其化合物在工业生产中具有重要的用途。
I.以含MnCO3的矿石为原料,经硫酸溶解得到含Mn2+的溶液,再经一系列处理后进行电解,获得金属Mn。
(1)Mn在_______ (填“阳极”或“阴极”)生成。
(2)阳极泥中含有MnO2,写出产生MnO2的电极反应式:_______ 。
II.阳极泥中除含锰元素外,还含有铅元素,采用如下方法可将它们分别转化为活性MnO2和PbO。
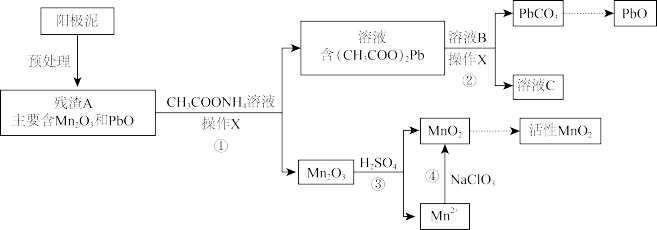
已知:(CH3COO)2Pb在水中难解离。
(3)操作X为_______ 。
(4)①中反应的离子方程式为_______ 。
(5)滤液C能循环使用,②中溶液B的溶质为_______ 。
(6)a.为了将③中Mn2O3完全转化为MnO2,理论上④中加入的NaClO3与Mn2O3的物质的量之比为_______ (已知NaClO3的还原产物为NaCl)。
b.加入NaClO3前,需将溶液pH调大至6左右。调节pH的目的是_______ 。
(7)活性MnO2纯度的测定
i.用V1mLc1mol∙L-1Na2C2O4溶液(H2SO4)酸化)溶解wg活性MnO2样。品。(MnO2+ +4H+=2CO2↑+Mn2++2H2O)
+4H+=2CO2↑+Mn2++2H2O)
ii.用c2mol∙L-1酸性KMnO4标准溶液滴定i中剩余的 消耗KMnO4标准溶液V2mL。(5
消耗KMnO4标准溶液V2mL。(5 +2
+2 +16H+=2Mn2++10CO2↑+8H2O)
+16H+=2Mn2++10CO2↑+8H2O)
样品中MnO2的质量分数=_______ [M(MnO2)=87g·mol-1]。
I.以含MnCO3的矿石为原料,经硫酸溶解得到含Mn2+的溶液,再经一系列处理后进行电解,获得金属Mn。
(1)Mn在
(2)阳极泥中含有MnO2,写出产生MnO2的电极反应式:
II.阳极泥中除含锰元素外,还含有铅元素,采用如下方法可将它们分别转化为活性MnO2和PbO。

已知:(CH3COO)2Pb在水中难解离。
(3)操作X为
(4)①中反应的离子方程式为
(5)滤液C能循环使用,②中溶液B的溶质为
(6)a.为了将③中Mn2O3完全转化为MnO2,理论上④中加入的NaClO3与Mn2O3的物质的量之比为
b.加入NaClO3前,需将溶液pH调大至6左右。调节pH的目的是
(7)活性MnO2纯度的测定
i.用V1mLc1mol∙L-1Na2C2O4溶液(H2SO4)酸化)溶解wg活性MnO2样。品。(MnO2+
 +4H+=2CO2↑+Mn2++2H2O)
+4H+=2CO2↑+Mn2++2H2O)ii.用c2mol∙L-1酸性KMnO4标准溶液滴定i中剩余的
 消耗KMnO4标准溶液V2mL。(5
消耗KMnO4标准溶液V2mL。(5 +2
+2 +16H+=2Mn2++10CO2↑+8H2O)
+16H+=2Mn2++10CO2↑+8H2O)样品中MnO2的质量分数=
您最近一年使用:0次
2022-05-08更新
|
495次组卷
|
4卷引用:北京市清华大学附属中学朝阳学校2023-2024学年高三下学期开学考化学试题
解题方法
10 . 下列实验方案设计、预期现象和结论都正确的是
| 目的 | 实验方案设计 | 现象和结论 | |
| A | 比较AgCl和AgI的 大小 大小 | 向NaCl和NaI的混合溶液中滴加少量 溶液,观察现象 溶液,观察现象 | 若溶液中产生黄色沉淀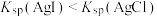 |
| B | 比较C和Si元素的非金属性强弱 | 将碳单质和二氧化硅固体混合置于硬质玻璃管内高温加热,并检验反应后产物 | 若反应后有灰黑色金属光泽的硅单质生成,则非金属性:C>Si |
| C | 检验苯中是否含有苯酚 | 取少量样品于试管中,滴加适量的浓溴水,观察现象 | 若未观察到有白色沉淀产生,则说明苯中不含有苯酚 |
| D | 验证 溶液中含有的含碘微粒 溶液中含有的含碘微粒 | 向两支盛有 溶液的试管中,分别滴加淀粉溶液和 溶液的试管中,分别滴加淀粉溶液和 溶液,观察现象 溶液,观察现象 | 若前者溶液变蓝,后者有黄色沉淀,则 溶液中存在 溶液中存在 和 和 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次



