名校
1 . 亚铁氰化钾晶体,化学式为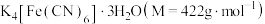 ,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
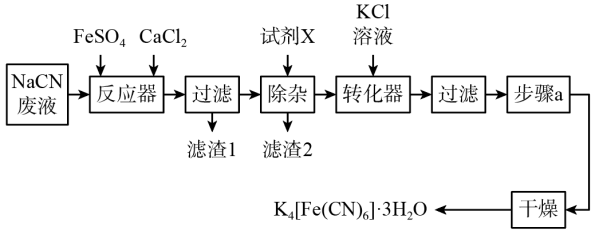
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为___________ 。
(2)反应器中发生的主要反应的化学方程式为___________ 。
(3)在“除杂”步骤中,向体系中加入适量的试剂X为___________ (填字母)。
a.NaCl b. c.
c.
(4)转化器中发生反应的离子方程式___________ 。
(5)实验室进行步骤a的操作为___________ 。
(6)对所得样品进行纯度测定:
步骤1:准确称取8.884g黄血盐样品加入水中充分溶解,将所得溶液转移至容量瓶并配制成100.00mL溶液。
步骤2:量取25.00mL上述溶液,用 酸性
酸性 溶液滴定,达到滴定终点时,共消耗
溶液滴定,达到滴定终点时,共消耗 溶液30.50mL。该实验中所发生的反应如下:
溶液30.50mL。该实验中所发生的反应如下:
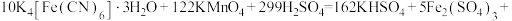
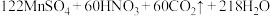
①通过计算确定该样品的纯度是___________ (保留3位有效数字)。
②下列操作会使测定结果偏高的是___________ (填字母)。
A.步骤1过程中黄血盐所含亚铁在空气中部分氧化
B.滴定前仰视滴定管读数,滴定后读数正确
C.滴定结束后,滴定管内壁附着液滴
D.滴定前滴定管尖嘴部分有气泡,滴定后尖嘴部分无气泡
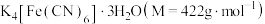 ,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
,俗名黄血盐,可溶于水,不溶于乙醇,在电镀、食品添加剂等方面有广泛用途。用含NaCN的废液合成黄血盐的主要工艺流程如下:
(1)实验室用绿矾晶体配制硫酸亚铁溶液时,为了防止其变质需要添加的试剂为
(2)反应器中发生的主要反应的化学方程式为
(3)在“除杂”步骤中,向体系中加入适量的试剂X为
a.NaCl b.
 c.
c.
(4)转化器中发生反应的离子方程式
(5)实验室进行步骤a的操作为
(6)对所得样品进行纯度测定:
步骤1:准确称取8.884g黄血盐样品加入水中充分溶解,将所得溶液转移至容量瓶并配制成100.00mL溶液。
步骤2:量取25.00mL上述溶液,用
 酸性
酸性 溶液滴定,达到滴定终点时,共消耗
溶液滴定,达到滴定终点时,共消耗 溶液30.50mL。该实验中所发生的反应如下:
溶液30.50mL。该实验中所发生的反应如下: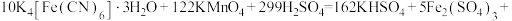
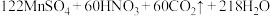
①通过计算确定该样品的纯度是
②下列操作会使测定结果偏高的是
A.步骤1过程中黄血盐所含亚铁在空气中部分氧化
B.滴定前仰视滴定管读数,滴定后读数正确
C.滴定结束后,滴定管内壁附着液滴
D.滴定前滴定管尖嘴部分有气泡,滴定后尖嘴部分无气泡
您最近一年使用:0次
2022-03-18更新
|
860次组卷
|
4卷引用:陕西省西安中学2023-2024学年高三上学期期末考试理综试题-高中化学
陕西省西安中学2023-2024学年高三上学期期末考试理综试题-高中化学山东省泰安市2021-2022学年高三下学期3月一模考试化学试题(已下线)必刷卷03-2022年高考化学考前信息必刷卷(山东专用)河北省衡水中学2022-2023学年高三上学期四调考试化学试题
名校
解题方法
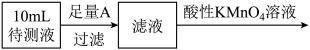
2 . 为了测定某氯化钙样品中钙元素的含量,进行如下实验(实验步骤已打乱):
①将沉淀全部放入锥形瓶中,加入足量的10% H2SO4和适量的蒸馏水,使沉淀完全溶解,溶液呈酸性,加热至75℃,趁热用0.0500mol/L KMnO4溶液进行滴定,记录所用KMnO4溶液的体积。
②过滤并洗涤沉淀。
③准确称取氯化钙样品0.2400g,放入烧杯中,加入适量6mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35.00mL 0.2500mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀。经检验,Ca2+已沉淀完全。
④再重复以上操作3次并进行数据处理,得出平均所用KMnO4溶液的体积为16.00mL
完成下列各题:
(1)上面的实验步骤合理的顺序是_______ 。(填序号)
(2)写出步骤①中加入KMnO4溶液后发生反应的离子方程式_______ 。
(3)滴定终点判断的依据是_______ 。
(4)某次实验滴定结束时滴定管内的液面见图,则此时液面读数为_______ mL。

(5)根据数据计算,样品中钙元素的质量分数为_______ %。(保留两位小数)
(6)同学乙重复实验,计算出的钙元素质量分数偏大,可能有的原因有_______。
①将沉淀全部放入锥形瓶中,加入足量的10% H2SO4和适量的蒸馏水,使沉淀完全溶解,溶液呈酸性,加热至75℃,趁热用0.0500mol/L KMnO4溶液进行滴定,记录所用KMnO4溶液的体积。
②过滤并洗涤沉淀。
③准确称取氯化钙样品0.2400g,放入烧杯中,加入适量6mol/L的盐酸和适量蒸馏水使样品完全溶解,再滴加35.00mL 0.2500mol/L (NH4)2C2O4溶液,水浴加热,逐渐生成CaC2O4沉淀。经检验,Ca2+已沉淀完全。
④再重复以上操作3次并进行数据处理,得出平均所用KMnO4溶液的体积为16.00mL
完成下列各题:
(1)上面的实验步骤合理的顺序是
(2)写出步骤①中加入KMnO4溶液后发生反应的离子方程式
(3)滴定终点判断的依据是
(4)某次实验滴定结束时滴定管内的液面见图,则此时液面读数为

(5)根据数据计算,样品中钙元素的质量分数为
(6)同学乙重复实验,计算出的钙元素质量分数偏大,可能有的原因有_______。
| A.酸性高锰酸钾溶液已部分变质 |
| B.滴定过程中,用蒸馏水冲洗锥形瓶内壁上的KMnO4溶液 |
| C.滴定时有部分高锰酸钾溶液滴在了实验台上 |
| D.酸式滴定管用蒸馏水洗过后又用所要盛装的溶液润洗 |
您最近一年使用:0次
2022-04-11更新
|
332次组卷
|
3卷引用:河南省驻马店市确山县第一高级中学2023~2024学年高二上学期第二次月考化学试题
名校
3 . 下列实验操作、现象和所得到的结论均正确的是
| 选项 | 实验内容 | 实验结论 |
| A | 将Fe(NO3)2样品溶于稀HNO3溶液中,加入KSCN溶液,显红色 | Fe(NO3)2已经氧化变质 |
| B | 用pH试纸测定同浓度的NaCl和NaF溶液的pH,pH(NaCl)<pH(NaF) | 结合H+能力:Cl-<F- |
| C | 取1mL0.1mol/LKI溶液于试管中,加入5mL0.1mol/LFeCl3,充分反应后滴入5滴15%KSCN溶液 | 若溶液变血红色,则KI和FeCl3反应有一定限度 |
| D | 向2支盛有5mL不同浓度NaHSO3溶液的试管中,同时加入2mL5%H2O2溶液,观察并比较实验现象 | 探究浓度对反应速率的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-02-23更新
|
220次组卷
|
3卷引用:黑龙江省哈尔滨市第一中学校2023-2024学年高二上学期期末考试化学试卷
名校
解题方法
4 . 下列有关实验、现象、及结论等叙述正确的有
①向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀,X具有强氧化性
②将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,非金属性:Cl>Si
③向某溶液加入稀硫酸,有淡黄色沉淀和刺激性气味的气体,该溶液中一定含有S2O32-
④向X溶液加新制氯水,再加入少量KSCN溶液,溶液变为红色,X溶液中一定含有Fe2+
⑤向饱和NaHCO3溶液中滴加硼酸,无气泡产生,酸性:硼酸<碳酸
⑥取少量Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,证明样品已变质
①向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀,X具有强氧化性
②将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生,非金属性:Cl>Si
③向某溶液加入稀硫酸,有淡黄色沉淀和刺激性气味的气体,该溶液中一定含有S2O32-
④向X溶液加新制氯水,再加入少量KSCN溶液,溶液变为红色,X溶液中一定含有Fe2+
⑤向饱和NaHCO3溶液中滴加硼酸,无气泡产生,酸性:硼酸<碳酸
⑥取少量Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,证明样品已变质
| A.1条 | B.2条 | C.3条 | D.4条 |
您最近一年使用:0次
2019-12-10更新
|
998次组卷
|
3卷引用:2024届重庆市乌江新高考协作体高三下学期模拟预测化学试题
5 . 根据下列实验操作与现象所得出的结论正确的是
| 选项 | 实验操作与现象 | 结论 |
| A | 将灼热后表面变黑的螺旋状铜丝伸入约 的乙醇中,铜丝能保持红热一段时间 的乙醇中,铜丝能保持红热一段时间 | 乙醇催化氧化反应是放热反应 |
| B | 取久置的 粉末,向其中滴加过量盐酸,产生无色气体 粉末,向其中滴加过量盐酸,产生无色气体 |  未变质 未变质 |
| C | 取少量医用酒精加入一小粒金属钠,产生无色气体 | 乙醇能与钠反应 |
| D | 将红热的铂丝伸入装有浓氨水的锥形瓶中的液面上方,瓶口出现少量红棕色气体 | 氨的氧化产物为 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
6 . 硫酰氯(SO2Cl2)是一种重要的有机氯化剂,可用于制造医药品、农药和染料等。某化学学习小组用干燥的SO2和Cl2在活性炭催化下制取硫酰氯,反应的化学方程式为: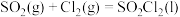 ,该反应为放热反应,装置如图所示(部分夹持装置省略)。
,该反应为放热反应,装置如图所示(部分夹持装置省略)。
(1)仪器A的名称为___________ 。
(2)C中盛放的药品是___________ ,其作用为___________ 。
(3)用浓盐酸和高锰酸钾反应可以制备氯气,写出相关离子方程式___________ 。
(4)若缺少装置乙和丁,对产品硫酰氯会有何影响,请用化学方程式表示___________ 。
(5)反应过程中,为防止SO2Cl2分解,可采取的措施有___________ 。(至少写一条)
(6)该化学小组成员经过实验测得产物量较少,猜测可能是原料中亚硫酸钠部分变质,为了验证亚硫酸钠发生了变质,可设计如下实验:取少量亚硫酸钠原料加水溶解,___________ 。
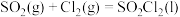 ,该反应为放热反应,装置如图所示(部分夹持装置省略)。
,该反应为放热反应,装置如图所示(部分夹持装置省略)。
(1)仪器A的名称为
(2)C中盛放的药品是
(3)用浓盐酸和高锰酸钾反应可以制备氯气,写出相关离子方程式
(4)若缺少装置乙和丁,对产品硫酰氯会有何影响,请用化学方程式表示
(5)反应过程中,为防止SO2Cl2分解,可采取的措施有
(6)该化学小组成员经过实验测得产物量较少,猜测可能是原料中亚硫酸钠部分变质,为了验证亚硫酸钠发生了变质,可设计如下实验:取少量亚硫酸钠原料加水溶解,
您最近一年使用:0次
解题方法
7 . 在有机化学中,硫酰氯( )常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的
)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的 和
和 在活性炭催化下制取硫酰氯。反应的化学方程式为
在活性炭催化下制取硫酰氯。反应的化学方程式为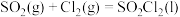
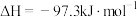 ,实验装置如图所示(部分夹持装置未画出)。
,实验装置如图所示(部分夹持装置未画出)。
已知:硫酰氯通常条件下为无色液体,熔点 ,沸点69.1℃,在潮湿空气中会“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
,沸点69.1℃,在潮湿空气中会“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
(1)装置丙中作为反应容器的仪器名称为___________ ,装置丙中球形冷凝管的作用是___________ ;控制两种反应物体积大致相等的操作是___________ 。
(2)装置乙、丁中选择的合适试剂分别是___________ 、___________ (填字母)。
A.浓硫酸 B.饱和食盐水 C.浓氢氧化钠溶液 D.饱和 溶液
溶液
(3)若缺少装置己,生成的硫酰氯( )可能会变质,生成新物质的化学式为
)可能会变质,生成新物质的化学式为___________ 。
(4)氯磺酸(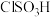 )加热分解,也能制得硫酰氯:
)加热分解,也能制得硫酰氯: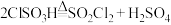 ,分离两种产物的方法是
,分离两种产物的方法是___________ 。
(5)长期储存的硫酰氯会显黄绿色,可能的原因是___________ (用化学方程式和必要的文字加以解释)。
(6)若反应中消耗的氯气体积为896mL(标准状况下),最后经过分离提纯得到4.05g纯净的硫酰氯,则硫酰氯的产率为___________ ;为提高本实验硫酰氯的产率,在实验操作中还需要注意的有___________ (填字母)。
a.控制气流速度,宜慢不宜快
b.保证装置的气密性良好
c.先向装置丙中通入一种气体,排出空气后再通入另一种气体
d.先通气体,再通冷凝水
 )常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的
)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的 和
和 在活性炭催化下制取硫酰氯。反应的化学方程式为
在活性炭催化下制取硫酰氯。反应的化学方程式为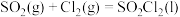
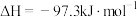 ,实验装置如图所示(部分夹持装置未画出)。
,实验装置如图所示(部分夹持装置未画出)。已知:硫酰氯通常条件下为无色液体,熔点
 ,沸点69.1℃,在潮湿空气中会“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
,沸点69.1℃,在潮湿空气中会“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
(1)装置丙中作为反应容器的仪器名称为
(2)装置乙、丁中选择的合适试剂分别是
A.浓硫酸 B.饱和食盐水 C.浓氢氧化钠溶液 D.饱和
 溶液
溶液(3)若缺少装置己,生成的硫酰氯(
 )可能会变质,生成新物质的化学式为
)可能会变质,生成新物质的化学式为(4)氯磺酸(
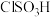 )加热分解,也能制得硫酰氯:
)加热分解,也能制得硫酰氯: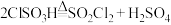 ,分离两种产物的方法是
,分离两种产物的方法是(5)长期储存的硫酰氯会显黄绿色,可能的原因是
(6)若反应中消耗的氯气体积为896mL(标准状况下),最后经过分离提纯得到4.05g纯净的硫酰氯,则硫酰氯的产率为
a.控制气流速度,宜慢不宜快
b.保证装置的气密性良好
c.先向装置丙中通入一种气体,排出空气后再通入另一种气体
d.先通气体,再通冷凝水
您最近一年使用:0次
名校
解题方法
8 . 活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Cu等元素及少量不溶于水的杂质)制备ZnO,工艺流程图所示:___________ ,常温下Fe2+比Fe3+更容易被氧化变质,请从结构角度加以解释___________ 。
(2)加入H2O2的目的是___________ ;“调pH”时除ZnO外还可以选用的物质是___________ 。
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了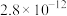 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为___________ 。证明Fe3+已除尽的化学方法是___________ 。
(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:___________ 。
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是___________。

(2)加入H2O2的目的是
a.氨水 b.氢氧化铁 c.氢氧化锌
(3)常温下、pH=5时,Fe3+的浓度降到了
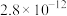 mol/L,此时Fe(OH)3的溶度积常数的数值为
mol/L,此时Fe(OH)3的溶度积常数的数值为(4)已知沉锌时固体产物是Zn2(OH)2CO3,请写出该过程的离子方程式:
(5)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是___________。
| A.粗锌作阳极,纯锌作阴极,电解质溶液是硫酸锌溶液 |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的金属阳离子只有Al3+、Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu |
您最近一年使用:0次
名校
解题方法
9 . 某小组同学探究久置 固体变质的情况,并测定其中铁元素的质量分数。将
固体变质的情况,并测定其中铁元素的质量分数。将 固体用蒸馏水溶解,配成
固体用蒸馏水溶解,配成 待测液,进行实验。
待测液,进行实验。
资料: 中S元素的化合价为-2价:酸性条件下,
中S元素的化合价为-2价:酸性条件下, 的还原产物为
的还原产物为 。
。
(1)实验一:
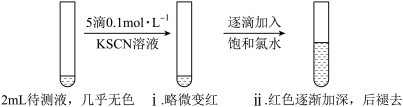
①i中溶液略微变红,说明待测液中存在___________ 。
②ii中溶液颜色逐渐加深的原因是___________ 。
③由实验一推测 固体变质的情况是
固体变质的情况是___________ (填字母序号)。
a.未变质 b.部分变质 c.完全变质
(2)实验二:探究ii中“红色褪去”的原因。
针对“红色褪去”的现象,小组同学猜想可能的原因是___________ ,并通过如下实验证实了猜想。将褪色后的溶液分两份分别进行实验,请补全①中的操作和②中的现象。
(3)实验三:将 固体用蒸馏水溶解,配成
固体用蒸馏水溶解,配成 待测液,进行实验,测定久置
待测液,进行实验,测定久置 固体中铁元素的含量。设计实验方案如图:
固体中铁元素的含量。设计实验方案如图:
①可选作A的物质是___________ (填字母序号)。
a. b.
b. c.
c. d.
d.
②若消耗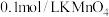 溶液
溶液 ,则久置
,则久置 固体中铁元素的质量分数是
固体中铁元素的质量分数是___________ 。
 固体变质的情况,并测定其中铁元素的质量分数。将
固体变质的情况,并测定其中铁元素的质量分数。将 固体用蒸馏水溶解,配成
固体用蒸馏水溶解,配成 待测液,进行实验。
待测液,进行实验。资料:
 中S元素的化合价为-2价:酸性条件下,
中S元素的化合价为-2价:酸性条件下, 的还原产物为
的还原产物为 。
。(1)实验一:

①i中溶液略微变红,说明待测液中存在
②ii中溶液颜色逐渐加深的原因是
③由实验一推测
 固体变质的情况是
固体变质的情况是a.未变质 b.部分变质 c.完全变质
(2)实验二:探究ii中“红色褪去”的原因。
针对“红色褪去”的现象,小组同学猜想可能的原因是
| 序号 | 操作 | 现象 |
| ① | 产生红褐色沉淀 | |
| ② | 滴加 溶液 溶液 |
(3)实验三:将
 固体用蒸馏水溶解,配成
固体用蒸馏水溶解,配成 待测液,进行实验,测定久置
待测液,进行实验,测定久置 固体中铁元素的含量。设计实验方案如图:
固体中铁元素的含量。设计实验方案如图:
①可选作A的物质是
a.
 b.
b. c.
c. d.
d.
②若消耗
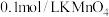 溶液
溶液 ,则久置
,则久置 固体中铁元素的质量分数是
固体中铁元素的质量分数是
您最近一年使用:0次
解题方法
10 . 氯化铁是一种重要的化工产品,易升华,易溶于水并且有强烈的吸水性,会吸收空气中的水分而发生变质。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验。请根据如图回答下列问答:
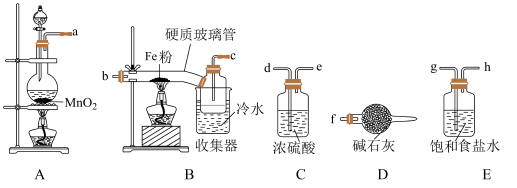
(1)盛装浓盐酸的仪器名称为___________ ;
(2)装置的连接顺序为:a→_____ →_____ →_____ →_____ →_____ →_____ →f(按气体方向填写)
(3)写出A中反应的化学方程式___________ ;
(4)B中硬质玻璃管直接连接收集器,不能使用细导管连接的原因是___________ ;
(5)实验结束后,测得装置B的质量增加克,则理论上装置B中反应转移电子的物质的量为___________  (用含m的式子回答);
(用含m的式子回答);
(6)碱石灰的作用是___________ ;
(7) 和
和 可以相互转化,用如图所示装置进行氢气还原
可以相互转化,用如图所示装置进行氢气还原 的实验,实验结束,取少量石英管内剩余固体溶于稀盐酸,固体全部溶解且无气泡,对固体成分进行猜测并设计实验验证。
的实验,实验结束,取少量石英管内剩余固体溶于稀盐酸,固体全部溶解且无气泡,对固体成分进行猜测并设计实验验证。
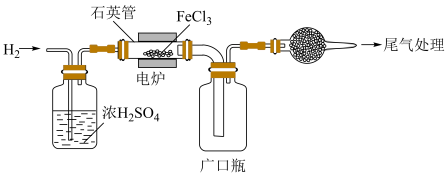
猜测1:只有
猜测2:含有 和
和
猜测3:只有
①实验方案:
已知:铁氰化钾溶液与 反应产生蓝色沉淀
反应产生蓝色沉淀
第一步加入的试剂为___________ ;
实验结论:现象一为___________ ,现象二为___________ ,则猜测1成立;
②另一个同学猜想,加热到更高温度T,,可能会还原得到其他物质。该同学在温度T下重复上述还原实验,当把石英管内剩余固体溶于稀盐酸时,发现固体溶解且有少量气泡产生,请写出温度T下石英管内发生反应的化学方程式___________ 。

(1)盛装浓盐酸的仪器名称为
(2)装置的连接顺序为:a→
(3)写出A中反应的化学方程式
(4)B中硬质玻璃管直接连接收集器,不能使用细导管连接的原因是
(5)实验结束后,测得装置B的质量增加克,则理论上装置B中反应转移电子的物质的量为
 (用含m的式子回答);
(用含m的式子回答);(6)碱石灰的作用是
(7)
 和
和 可以相互转化,用如图所示装置进行氢气还原
可以相互转化,用如图所示装置进行氢气还原 的实验,实验结束,取少量石英管内剩余固体溶于稀盐酸,固体全部溶解且无气泡,对固体成分进行猜测并设计实验验证。
的实验,实验结束,取少量石英管内剩余固体溶于稀盐酸,固体全部溶解且无气泡,对固体成分进行猜测并设计实验验证。
猜测1:只有

猜测2:含有
 和
和
猜测3:只有

①实验方案:
已知:铁氰化钾溶液与
 反应产生蓝色沉淀
反应产生蓝色沉淀| 实验步骤 | 操作 | 现象 |
| 第一步 | 取溶液于试管中,加入___________ | 现象一 |
| 第二步 | 另取溶液于试管中,加入铁氰化钾溶液 | 现象二 |
实验结论:现象一为
②另一个同学猜想,加热到更高温度T,,可能会还原得到其他物质。该同学在温度T下重复上述还原实验,当把石英管内剩余固体溶于稀盐酸时,发现固体溶解且有少量气泡产生,请写出温度T下石英管内发生反应的化学方程式
您最近一年使用:0次



