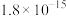名校
解题方法
1 . 下列实验操作、现象及结论都正确的是
| 选项 | 实验目的 | 实验现象 | 结论 |
| A | 检验乙醇是否含水,向乙醇中加入一小块钠 | 产生无色气体 | 乙醇中含有水 |
| B | 检验溴乙烷发生消去反应的产物,加热溴乙烷、乙醇和NaOH混合液,产生的气体通入溴水 | 溶液褪色 | 溴乙烷消去产物为乙烯 |
| C | 向苯酚溶液中滴加少量浓溴水,振荡 | 无白色沉淀 | 苯酚与浓溴水不反应 |
| D | 在3mL5%的 溶液滴入3∼4滴5%的NaOH溶液,振荡后加入0.5mL的乙醛溶液并加热 溶液滴入3∼4滴5%的NaOH溶液,振荡后加入0.5mL的乙醛溶液并加热 | 未产生砖红色沉淀 | 乙醛已经完全变质 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-09-24更新
|
224次组卷
|
2卷引用:辽宁省重点高中沈阳市郊联体2023-2024学年高二下学期5月期中化学试题
名校
解题方法
2 . 活性氧化锌能对太阳光线和其他大气物质形成防护,常用于敏感皮肤的面霜和化妆品。工业上用菱锌矿(主要成分为ZnCO3,还含有Ni、Cd、Fe、Cu等元素及少量不溶于水的杂质)制备ZnO,工艺流程图所示:

(1)为了提高“溶浸”效果,可采取的措施有___________ (任写两条)。
(2)常温下Fe2+比Fe3+更容易被氧化变质,请从结构角度加以解释___________ 。
(3)“除铁”时,先加入H2O2溶液发生反应的离子方程式为___________ ;“调pH”时除ZnO外还可以选用的物质是___________ 。
a.氨水 b.氢氧化钠 c.氢氧化锌
(4)常温下pH=5时,Fe3+的浓度降到了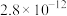 mo1/L,此时Fe(OH)3的溶度积常数的数值为
mo1/L,此时Fe(OH)3的溶度积常数的数值为___________ ,证明Fe3+已除尽的化学方法是___________ 。
(5)已知沉锌时固体产物是Zn2(OH)2CO3,写出该过程的离子方程式:___________ 。
(6)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是___________。

(1)为了提高“溶浸”效果,可采取的措施有
(2)常温下Fe2+比Fe3+更容易被氧化变质,请从结构角度加以解释
(3)“除铁”时,先加入H2O2溶液发生反应的离子方程式为
a.氨水 b.氢氧化钠 c.氢氧化锌
(4)常温下pH=5时,Fe3+的浓度降到了
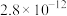 mo1/L,此时Fe(OH)3的溶度积常数的数值为
mo1/L,此时Fe(OH)3的溶度积常数的数值为(5)已知沉锌时固体产物是Zn2(OH)2CO3,写出该过程的离子方程式:
(6)粗锌中含有少量Al、Fe、Cu等杂质,可用电解法制备高纯度锌,下列叙述正确的是___________。
| A.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| B.电解后,溶液中存在的金属阳离子只有Al3+、Fe2+和Zn2+ |
| C.粗锌作阳极,纯锌作阴极,电解质溶液是硫酸锌溶液 |
| D.电解后,电解槽底部的阳极泥中只有Cu |
您最近一年使用:0次
名校
解题方法
3 . 乙基溴化镁( )是一种性质极为活泼的有机试剂。其制备和使用过程如下:
)是一种性质极为活泼的有机试剂。其制备和使用过程如下:
已知:
①制备原理: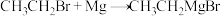
 ,反应决速步为
,反应决速步为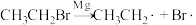 ,该步所需能量决定了反应的活性;
,该步所需能量决定了反应的活性;
② 极易在空气、潮湿、酸性环境下变质;
极易在空气、潮湿、酸性环境下变质;
③几种物质的物理性质
Ⅰ.制备
在仪器A中加入3.6gMg屑(已在稀盐酸中浸泡2小时并干燥),向恒压滴液漏斗中倒入10.1mL(0.10mol) 和25.0mL无水乙醚的混合液备用。之后将少量混合液加入A中,并添加少量引发剂,使用热风枪吹热A,待液体微沸,再逐滴缓慢加入余下的混合液,冰浴1.5h后反应结束。
和25.0mL无水乙醚的混合液备用。之后将少量混合液加入A中,并添加少量引发剂,使用热风枪吹热A,待液体微沸,再逐滴缓慢加入余下的混合液,冰浴1.5h后反应结束。
打开恒压滴液漏斗上口的玻璃塞,加入6.7mL(0.12mol)乙醛,之后打开其下口使乙醛逐滴与 反应,然后滴加20.0mL饱和
反应,然后滴加20.0mL饱和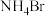 溶液生成产物X(伴有一种盐和碱性气体产生)。将X从混合液中提纯后,其质量为5.92g。
溶液生成产物X(伴有一种盐和碱性气体产生)。将X从混合液中提纯后,其质量为5.92g。
回答下列问题:
(1)仪器A的名称是______ , 的晶体类型为
的晶体类型为______ 。
(2)Ar气球的作用是______ 。
(3)研究发现,卤代烃均有和Mg反应的性质,则以下物质中反应活性最高的为______(填序号)。
(4)“制备”过程中使用热风枪替代酒精灯的原因是______ 。若迟迟未能引发反应,则将溶剂更换为四氢呋喃即可顺利进行,其原因是______ 。
(5)“使用”过程中,X在提纯后进行了氢谱和质谱的表征,结果如下: 与乙醛反应生成X(碳骨架无支链)的总反应为
与乙醛反应生成X(碳骨架无支链)的总反应为______ 。
(6) 在“制备”中的产率为
在“制备”中的产率为______ %(“使用”过程中反应均完全,且提纯无损耗)。
 )是一种性质极为活泼的有机试剂。其制备和使用过程如下:
)是一种性质极为活泼的有机试剂。其制备和使用过程如下:已知:
①制备原理:
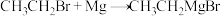
 ,反应决速步为
,反应决速步为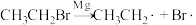 ,该步所需能量决定了反应的活性;
,该步所需能量决定了反应的活性;②
 极易在空气、潮湿、酸性环境下变质;
极易在空气、潮湿、酸性环境下变质;③几种物质的物理性质
| 物质 | 熔点/℃ | 沸点/℃ | 物理性质(25℃) |
| 乙醚 | ―116.2 | 34.5 | 无色液体、易挥发、易燃 |
| 四氢呋喃 | ―108.5 | 66.0 | 无色液体,可溶于水、乙醛 |
| 乙基溴化镁 | ―116.3 | 34.6 | 深棕色液体 |
在仪器A中加入3.6gMg屑(已在稀盐酸中浸泡2小时并干燥),向恒压滴液漏斗中倒入10.1mL(0.10mol)
 和25.0mL无水乙醚的混合液备用。之后将少量混合液加入A中,并添加少量引发剂,使用热风枪吹热A,待液体微沸,再逐滴缓慢加入余下的混合液,冰浴1.5h后反应结束。
和25.0mL无水乙醚的混合液备用。之后将少量混合液加入A中,并添加少量引发剂,使用热风枪吹热A,待液体微沸,再逐滴缓慢加入余下的混合液,冰浴1.5h后反应结束。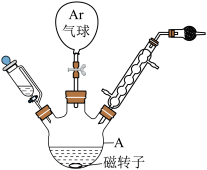
打开恒压滴液漏斗上口的玻璃塞,加入6.7mL(0.12mol)乙醛,之后打开其下口使乙醛逐滴与
 反应,然后滴加20.0mL饱和
反应,然后滴加20.0mL饱和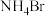 溶液生成产物X(伴有一种盐和碱性气体产生)。将X从混合液中提纯后,其质量为5.92g。
溶液生成产物X(伴有一种盐和碱性气体产生)。将X从混合液中提纯后,其质量为5.92g。回答下列问题:
(1)仪器A的名称是
 的晶体类型为
的晶体类型为(2)Ar气球的作用是
(3)研究发现,卤代烃均有和Mg反应的性质,则以下物质中反应活性最高的为______(填序号)。
A.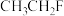 | B. | C. | D.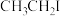 |
(4)“制备”过程中使用热风枪替代酒精灯的原因是
(5)“使用”过程中,X在提纯后进行了氢谱和质谱的表征,结果如下:
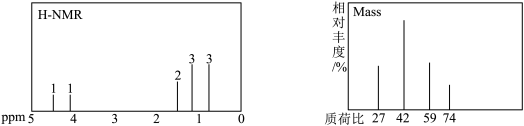
 与乙醛反应生成X(碳骨架无支链)的总反应为
与乙醛反应生成X(碳骨架无支链)的总反应为(6)
 在“制备”中的产率为
在“制备”中的产率为
您最近一年使用:0次
4 . 实验室以柠檬酸亚铁、柠檬酸铵等为原料可制得柠檬酸铁铵。已知:柠檬酸结构简式为 ,是易溶于水的晶体,可用
,是易溶于水的晶体,可用 表示;柠檬酸可与
表示;柠檬酸可与 反应制柠檬酸亚铁。
反应制柠檬酸亚铁。
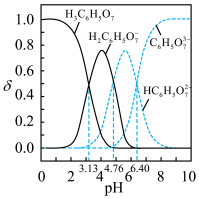
 ,测定其组成的实验方案如下:取适量样品溶于蒸馏水配成100mL溶液。取20.00mL溶液加入足量NaOH溶液充分反应,过滤、洗涤,灼烧至恒重,测得固体质量为0.32g。取20.00mL溶液于锥形瓶中,依次加入足量EDTA(能与部分金属离子结合)、HCHO溶液充分反应,滴入2滴酚酞试液,用1.00
,测定其组成的实验方案如下:取适量样品溶于蒸馏水配成100mL溶液。取20.00mL溶液加入足量NaOH溶液充分反应,过滤、洗涤,灼烧至恒重,测得固体质量为0.32g。取20.00mL溶液于锥形瓶中,依次加入足量EDTA(能与部分金属离子结合)、HCHO溶液充分反应,滴入2滴酚酞试液,用1.00 NaOH标准液滴定至终点,消耗标准液12.00mL。[
NaOH标准液滴定至终点,消耗标准液12.00mL。[ ;
;
 ]。加入EDTA的作用为
]。加入EDTA的作用为(3)避光条件下,柠檬酸铁铵与铁氰化钾[
 ]反应得到普鲁士黄(PY),其立方晶胞结构如图所示。
]反应得到普鲁士黄(PY),其立方晶胞结构如图所示。
 均与
均与 形成配位键。结合电子式解释
形成配位键。结合电子式解释 作配体的原因:
作配体的原因:②普鲁士蓝(PB)晶胞结构如图所示, 周围最近且等距的
周围最近且等距的 有12个,“○”位置被
有12个,“○”位置被 或
或 占据,用“
占据,用“ ”在图上补全PB结构图中Ⅰ和Ⅱ两个小立方体中的
”在图上补全PB结构图中Ⅰ和Ⅱ两个小立方体中的 。
。
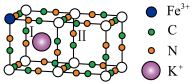
 能容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测
能容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。充电过程中,推测 会从PB中脱嵌出来,理由是
会从PB中脱嵌出来,理由是(4)补充完整由铁泥(主要含有单质铁、少量
 和铁的氧化物)制备
和铁的氧化物)制备 的实验方案,部分装置如图所示:取一定量的铁泥,
的实验方案,部分装置如图所示:取一定量的铁泥, 。(须使用试剂:
。(须使用试剂: 、
、 溶液、稀硫酸)
溶液、稀硫酸)
您最近一年使用:0次
名校
5 . 如图所示装置是用燃烧法确定有机物( )化学式的装置,这种方法是电炉加热时利用纯氧氧化管内样品,根据产物的质量确定有机物的组成。回答下列问题:
)化学式的装置,这种方法是电炉加热时利用纯氧氧化管内样品,根据产物的质量确定有机物的组成。回答下列问题:______ 。
(2)D和E中的试剂不可调换,理由是____________ 。
(3)CuO的作用是______ (举1例,用化学方程式表示),O2的作用有____________ 。
(4)准确称取0.74g样品,经充分反应后,D管质量增加0.90g,E管质量增加1.76g。则该样品中有机物的最简式为______ 。通过对样品进行分析,
得到如图谱。分析图谱可知,样品中有机物的相对分子质量为,结构简式为______ 。______ (填“合理”或“不合理”),理由是____________ 。
 )化学式的装置,这种方法是电炉加热时利用纯氧氧化管内样品,根据产物的质量确定有机物的组成。回答下列问题:
)化学式的装置,这种方法是电炉加热时利用纯氧氧化管内样品,根据产物的质量确定有机物的组成。回答下列问题:
(2)D和E中的试剂不可调换,理由是
(3)CuO的作用是
(4)准确称取0.74g样品,经充分反应后,D管质量增加0.90g,E管质量增加1.76g。则该样品中有机物的最简式为
得到如图谱。分析图谱可知,样品中有机物的相对分子质量为,结构简式为

您最近一年使用:0次
名校
解题方法
6 . 格氏试剂(R—MgX,R表示烃基,X表示卤原子)是重要的有机试剂,实验小组查阅资料设计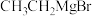 的制备过程如下:
的制备过程如下:
原理: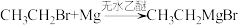
已知:①该制备实验需在绝对无水、无氧的环境下进行。一般不易发生,常需引发剂,引发后,反应剧烈且放热。
②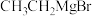 沸点为34.6℃。
沸点为34.6℃。
 .试剂的预处理
.试剂的预处理
(1)乙醚[沸点:34.5℃,密度为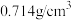 ,微溶于水,混有过氧乙醚(
,微溶于水,混有过氧乙醚(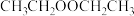 )、少量水]的处理:
)、少量水]的处理:
①过氧乙醚的检验:取少量样品滴于KI-淀粉试纸中央,出现___________ 现象,说明其中含有过氧乙醚。
②除过氧乙醚:将乙醚转入___________ (选填下列仪器标号)中,加入适量的硫酸亚铁溶液,充分振荡,静置分层,___________ (填具体操作),分离出下层水相。最后将有机相转移至蒸馏装置中蒸馏,收集34.5℃馏分。 .
.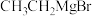 的制备
的制备
如图组装装置(加热和夹持装置已略),向仪器X中加入2.4g镁条和1小粒碘,装好装置,向仪器Y中加入0.12mol溴乙烷和25.00mL乙醚,混匀后开始滴入仪器X中,反应中保持微沸,加完后,温水浴加热回流20min直至镁条完全反应。___________ 。
(3)回流结束后,需进行的操作有①停止加热 ②关闭冷凝水 ③移去水浴,正确的顺序为___________ (填序号)。
(4)实验装置存在缺陷,导致制备的格氏试剂易水解,该如何改进?___________ 。
(5)反应温度过高会导致副反应的发生,避免副反应的发生可采取的操作或措施有___________ 。
(6)打开仪器Y上口的玻璃塞,加入0.2mol乙醛,之后打开其下口使乙醛逐滴与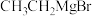 反应,然后滴加20.0mL饱和
反应,然后滴加20.0mL饱和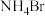 溶液生成产物Z(伴有一种盐和碱性气体产生)。将Z从混合液中提纯后进行了氢谱和质谱的表征,结果如下:
溶液生成产物Z(伴有一种盐和碱性气体产生)。将Z从混合液中提纯后进行了氢谱和质谱的表征,结果如下: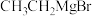 与乙醛反应生成Z(碳骨架无支链)的总反应为
与乙醛反应生成Z(碳骨架无支链)的总反应为___________ 。
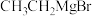 的制备过程如下:
的制备过程如下:原理:
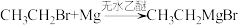
已知:①该制备实验需在绝对无水、无氧的环境下进行。一般不易发生,常需引发剂,引发后,反应剧烈且放热。
②
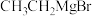 沸点为34.6℃。
沸点为34.6℃。 .试剂的预处理
.试剂的预处理(1)乙醚[沸点:34.5℃,密度为
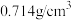 ,微溶于水,混有过氧乙醚(
,微溶于水,混有过氧乙醚(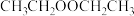 )、少量水]的处理:
)、少量水]的处理:①过氧乙醚的检验:取少量样品滴于KI-淀粉试纸中央,出现
②除过氧乙醚:将乙醚转入
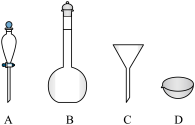
 .
.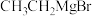 的制备
的制备如图组装装置(加热和夹持装置已略),向仪器X中加入2.4g镁条和1小粒碘,装好装置,向仪器Y中加入0.12mol溴乙烷和25.00mL乙醚,混匀后开始滴入仪器X中,反应中保持微沸,加完后,温水浴加热回流20min直至镁条完全反应。
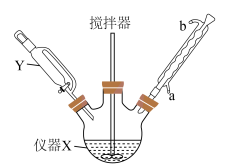
(3)回流结束后,需进行的操作有①停止加热 ②关闭冷凝水 ③移去水浴,正确的顺序为
(4)实验装置存在缺陷,导致制备的格氏试剂易水解,该如何改进?
(5)反应温度过高会导致副反应的发生,避免副反应的发生可采取的操作或措施有
(6)打开仪器Y上口的玻璃塞,加入0.2mol乙醛,之后打开其下口使乙醛逐滴与
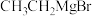 反应,然后滴加20.0mL饱和
反应,然后滴加20.0mL饱和 溶液生成产物Z(伴有一种盐和碱性气体产生)。将Z从混合液中提纯后进行了氢谱和质谱的表征,结果如下:
溶液生成产物Z(伴有一种盐和碱性气体产生)。将Z从混合液中提纯后进行了氢谱和质谱的表征,结果如下: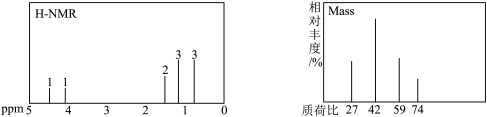
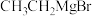 与乙醛反应生成Z(碳骨架无支链)的总反应为
与乙醛反应生成Z(碳骨架无支链)的总反应为
您最近一年使用:0次
解题方法
7 . 某实验小组设计一体化实验,通过量气法测定阿伏加德罗常数,同时制得 并探究其性质.回答下列问题:
并探究其性质.回答下列问题:
I.测定阿伏加德罗常数同时制得 .实验装置如图所示:
.实验装置如图所示:___________ ,阴极发生的电极反应式是___________ ;
(2)烧杯中最终会看到___________ 色沉淀;
(3)在一定电流强度下电解一段时间,收集到的气体体积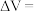
___________  (用含
(用含 的式子表示).将
的式子表示).将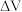 换算成标准状况下的体积记为
换算成标准状况下的体积记为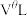 ,已知电路中通过的总电量为
,已知电路中通过的总电量为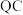 ,1个电子所带的电量为
,1个电子所带的电量为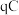 ,则阿伏伽德罗常数
,则阿伏伽德罗常数
___________ (用含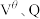 和q的表达式表示)。
和q的表达式表示)。
Ⅱ.探究 的性质.实验小组将上述电解得到的产物
的性质.实验小组将上述电解得到的产物 洗涤干净后,进行如下实验:
洗涤干净后,进行如下实验: 白色,
白色,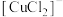 无色,
无色, 黄色.
黄色.
(4)检验电解产物 洗净需要用到的试剂是
洗净需要用到的试剂是___________ ;
(5)解释溶液颜色由无色变为黄色的原因___________ (用离子方程式表示);
Ⅲ.测量电解产物 的含量。
的含量。
(6)称取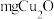 样品置于烧杯中(该样品杂质不与后续试剂反应),加入足量酸性
样品置于烧杯中(该样品杂质不与后续试剂反应),加入足量酸性 溶液,使
溶液,使 全部转化为
全部转化为 ,加入过量
,加入过量 溶液,然后用
溶液,然后用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 .(己知:
.(己知: )
)
则测得电解产物中 的含量为
的含量为___________  。
。
 并探究其性质.回答下列问题:
并探究其性质.回答下列问题:I.测定阿伏加德罗常数同时制得
 .实验装置如图所示:
.实验装置如图所示:
(2)烧杯中最终会看到
(3)在一定电流强度下电解一段时间,收集到的气体体积
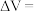
 (用含
(用含 的式子表示).将
的式子表示).将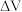 换算成标准状况下的体积记为
换算成标准状况下的体积记为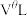 ,已知电路中通过的总电量为
,已知电路中通过的总电量为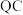 ,1个电子所带的电量为
,1个电子所带的电量为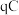 ,则阿伏伽德罗常数
,则阿伏伽德罗常数
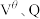 和q的表达式表示)。
和q的表达式表示)。Ⅱ.探究
 的性质.实验小组将上述电解得到的产物
的性质.实验小组将上述电解得到的产物 洗涤干净后,进行如下实验:
洗涤干净后,进行如下实验: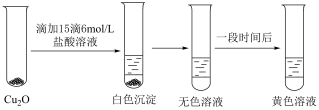
 白色,
白色,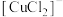 无色,
无色, 黄色.
黄色.(4)检验电解产物
 洗净需要用到的试剂是
洗净需要用到的试剂是(5)解释溶液颜色由无色变为黄色的原因
Ⅲ.测量电解产物
 的含量。
的含量。(6)称取
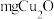 样品置于烧杯中(该样品杂质不与后续试剂反应),加入足量酸性
样品置于烧杯中(该样品杂质不与后续试剂反应),加入足量酸性 溶液,使
溶液,使 全部转化为
全部转化为 ,加入过量
,加入过量 溶液,然后用
溶液,然后用 溶液滴定至终点,消耗
溶液滴定至终点,消耗 .(己知:
.(己知: )
)则测得电解产物中
 的含量为
的含量为 。
。
您最近一年使用:0次
解题方法
8 . 被誉为“工业维他命”的铂族金属钌(Ru)广泛用于航天航空、石油化学、信息传感工业、制药等高科技领域。以下工艺实现了电子废弃物中铂族金属钌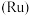 的回收利用。已知电子废弃物主要成分为
的回收利用。已知电子废弃物主要成分为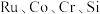 等物质,请回答以下问题:
等物质,请回答以下问题: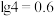 ②常见物质的
②常见物质的 如下表所示:
如下表所示:
(1)为加快“酸浸”时的浸取速率,下列措施中无法达到目的是______ (填字母)。
a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加盐酸浓度 e.适当升高温度
(2)滤渣2为______ 。
(3)“氧化溶浸”环节生成配离子 反应的离子方程式为
反应的离子方程式为______ 。
(4)“还原1”环节所需氧化剂和还原剂的物质的量之比为1:1,则 的氧化产物为
的氧化产物为______ 。
(5)滤液1中含 和
和 的浓度分别为
的浓度分别为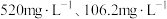 ,“调
,“调 ”时调
”时调 的范围为
的范围为______ 。(已知:当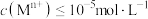 时,可认为
时,可认为 已经沉淀完全)
已经沉淀完全)
(6)沉钴。向除杂后的 溶液中加入
溶液中加入 溶液或
溶液或 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到 ,不能用同浓度的
,不能用同浓度的 溶液代替
溶液代替 溶液的原因是
溶液的原因是______ 。
(7)制备 。将所得的
。将所得的 草酸钴晶体
草酸钴晶体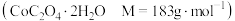 高温灼烧,其热重分析曲线如图:
高温灼烧,其热重分析曲线如图: 点对应的物质的化学式:
点对应的物质的化学式:______ ,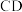 段发生反应的化学方程式为:
段发生反应的化学方程式为:______ 。
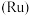 的回收利用。已知电子废弃物主要成分为
的回收利用。已知电子废弃物主要成分为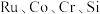 等物质,请回答以下问题:
等物质,请回答以下问题: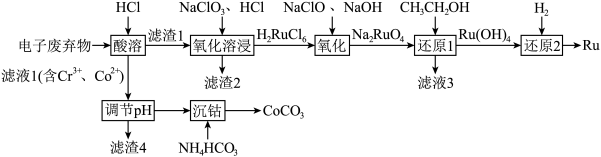
 ②常见物质的
②常见物质的 如下表所示:
如下表所示:化合物 |
|
|
|
|
|
(1)为加快“酸浸”时的浸取速率,下列措施中无法达到目的是
a.将样品粉碎 b.延长浸取时间 c.充分搅拌 d.适当增加盐酸浓度 e.适当升高温度
(2)滤渣2为
(3)“氧化溶浸”环节生成配离子
 反应的离子方程式为
反应的离子方程式为(4)“还原1”环节所需氧化剂和还原剂的物质的量之比为1:1,则
 的氧化产物为
的氧化产物为(5)滤液1中含
 和
和 的浓度分别为
的浓度分别为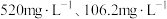 ,“调
,“调 ”时调
”时调 的范围为
的范围为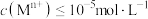 时,可认为
时,可认为 已经沉淀完全)
已经沉淀完全)(6)沉钴。向除杂后的
 溶液中加入
溶液中加入 溶液或
溶液或 溶液作沉淀剂,可得到
溶液作沉淀剂,可得到 ,不能用同浓度的
,不能用同浓度的 溶液代替
溶液代替 溶液的原因是
溶液的原因是(7)制备
 。将所得的
。将所得的 草酸钴晶体
草酸钴晶体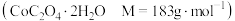 高温灼烧,其热重分析曲线如图:
高温灼烧,其热重分析曲线如图: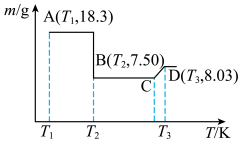
 点对应的物质的化学式:
点对应的物质的化学式: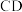 段发生反应的化学方程式为:
段发生反应的化学方程式为:
您最近一年使用:0次
9 . 氯的化合物在生活中有着广泛的用途。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生Cl-和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为Cl-除去。
转化为Cl-除去。
①关于二氧化氯的说法不正确的是_______ 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去 的离子方程式为
的离子方程式为_______ 。
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:ClO2+H2O2+NaOH=NaClO2+O2+H2O(未配平)。
①ClO2的氧化性_______ H2O2的氧化性(填“大于”或“小于”)。
②为测定产品中NaClO2的纯度,进行如下实验:准确称取1.000g上述产品,溶于水配成100.00mL溶液,取10.00mL待测液,加入过量KI溶液,酸性条件下发生反应: +4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2
+4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2 =2I-+
=2I-+ )。计算该样品的纯度为
)。计算该样品的纯度为_______ 。(写出计算过程)
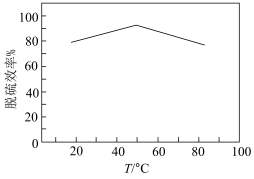
③工业上常用NaClO2溶液对燃煤烟气进行脱硫。已知NaClO2溶液具有强氧化性,酸性条件下NaClO2发生歧化反应生成ClO2,ClO2易溶于水,具有强氧化性,可氧化SO2.在实验室模拟脱硫过程:先加稀硫酸调节NaClO2吸收液的pH为5,再向其中通入含SO2的模拟烟气。测得脱硫反应后,溶液中的阴离子为Cl-,则SO2的氧化产物是_______ 。测得脱硫效率(即SO2的吸收率)随温度变化的曲线如下图所示。_______ 。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生Cl-和少量的
 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为Cl-除去。
转化为Cl-除去。①关于二氧化氯的说法不正确的是
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去
 的离子方程式为
的离子方程式为(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:ClO2+H2O2+NaOH=NaClO2+O2+H2O(未配平)。
①ClO2的氧化性
②为测定产品中NaClO2的纯度,进行如下实验:准确称取1.000g上述产品,溶于水配成100.00mL溶液,取10.00mL待测液,加入过量KI溶液,酸性条件下发生反应:
 +4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2
+4I-+4H+=2H2O+2I2+Cl-,杂质不与I-反应。以淀粉作指示剂,再加入0.2000mol/LNa2S2O3溶液,恰好完全反应时消耗的Na2S2O3溶液的体积为20.00mL。(已知:I2+2 =2I-+
=2I-+ )。计算该样品的纯度为
)。计算该样品的纯度为③工业上常用NaClO2溶液对燃煤烟气进行脱硫。已知NaClO2溶液具有强氧化性,酸性条件下NaClO2发生歧化反应生成ClO2,ClO2易溶于水,具有强氧化性,可氧化SO2.在实验室模拟脱硫过程:先加稀硫酸调节NaClO2吸收液的pH为5,再向其中通入含SO2的模拟烟气。测得脱硫反应后,溶液中的阴离子为Cl-,则SO2的氧化产物是
您最近一年使用:0次
名校
解题方法
10 . 三氯化铬(CrCl3)为紫色单斜晶体,熔点为83 ℃,易潮解,易升华,能溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。在实验室中利用Cr2O3与CCl4反应制备无水CrCl3,并收集该反应产生的光气(COCl2),实验装置如图所示(夹持、加热及部分冷却装置已省略)。
实验步骤如下:

Ⅰ.检查完装置气密性后,按照图示装入药品,打开K1、K2、K3,通入氮气。
Ⅱ.一段时间后,关闭K3,将装置B加热到预定温度,再将装置A在85 ℃下进行水浴加热。
Ⅲ.待装置B中反应结束后,装置A、B停止加热;一段时间后,停止通入氮气。
Ⅳ.将装置C在30 ℃下进行加热,得到产物和光气。
已知:ⅰ.光气能溶于CCl4,易与水发生反应生成CO2和HCl。
ⅱ.有关物质的熔、沸点如下表:
回答下列问题:
(1)仪器d中盛有无水CaCl2固体,其作用为___________ ;若无仪器d和后续装置,仪器b的上管口可能出现的现象为___________ 。
(2)通入N2除起到将装置内空气排出的作用外,还具有的作用为___________ (写一条即可)。
(3)步骤Ⅳ中,将光气分离出的操作名称为___________ ;
(4)B中得到产品的化学方程式为___________ 。
(5)光气剧毒,该实验中用NaOH溶液吸收逸出的少量光气。也可以用乙醇处理COCl2,生成一种含氧酸酯(C2H5OCOOC2H5),用乙醇处理光气的化学方程式为___________ 。
(6)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr2O +6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI。
+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI。
①该实验可选用的指示剂名称为___________ 。
②样品中无水三氯化铬的质量分数为___________ 。
实验步骤如下:

Ⅰ.检查完装置气密性后,按照图示装入药品,打开K1、K2、K3,通入氮气。
Ⅱ.一段时间后,关闭K3,将装置B加热到预定温度,再将装置A在85 ℃下进行水浴加热。
Ⅲ.待装置B中反应结束后,装置A、B停止加热;一段时间后,停止通入氮气。
Ⅳ.将装置C在30 ℃下进行加热,得到产物和光气。
已知:ⅰ.光气能溶于CCl4,易与水发生反应生成CO2和HCl。
ⅱ.有关物质的熔、沸点如下表:
| 化学式 | Cr2O3 | CrCl3 | CCl4 | COCl2 |
| 熔点/℃ | 1435 | 1 152 | -23 | -118 |
| 沸点/℃ | 4000 | 1 300 | 76 | 8.2 |
(1)仪器d中盛有无水CaCl2固体,其作用为
(2)通入N2除起到将装置内空气排出的作用外,还具有的作用为
(3)步骤Ⅳ中,将光气分离出的操作名称为
(4)B中得到产品的化学方程式为
(5)光气剧毒,该实验中用NaOH溶液吸收逸出的少量光气。也可以用乙醇处理COCl2,生成一种含氧酸酯(C2H5OCOOC2H5),用乙醇处理光气的化学方程式为
(6)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O
 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。已知:Cr2O
 +6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI。
+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI。①该实验可选用的指示剂名称为
②样品中无水三氯化铬的质量分数为
您最近一年使用:0次