名校
1 . 三氯化铬(CrCl3)是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室用 和
和 (沸点76.8℃)在高温下制备无水
(沸点76.8℃)在高温下制备无水 ,同时生成
,同时生成 气体。实验装置(加热及夹持装置略)如图所示。
气体。实验装置(加热及夹持装置略)如图所示。
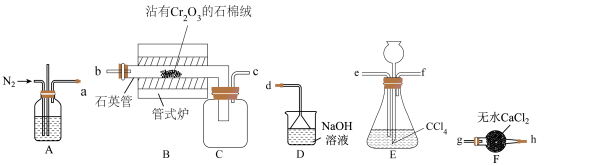
已知: 气体有毒,遇水发生水解产生两种酸性气体。
气体有毒,遇水发生水解产生两种酸性气体。
回答下列问题:
(1)实验装置合理的连接顺序为a→___________ →d。
(2)制备 时进行操作:(i)连接装置,……;(ii)装入药品并通入
时进行操作:(i)连接装置,……;(ii)装入药品并通入 ;加热石英管至400℃;(ⅲ)停止通入
;加热石英管至400℃;(ⅲ)停止通入 ,加热E装置;(iv)加热石英管继续升温至650℃,直到B中反应基本完成,切断管式炉的电源;(v)停止E装置加热,继续通入
,加热E装置;(iv)加热石英管继续升温至650℃,直到B中反应基本完成,切断管式炉的电源;(v)停止E装置加热,继续通入 一段时间;(vi)装置冷却后,结束制备实验。
一段时间;(vi)装置冷却后,结束制备实验。
①补全步骤i的操作___________ 。
②实验过程中为了形成稳定的 气流,对E装置加热的最佳方式是
气流,对E装置加热的最佳方式是___________ ,装置E中长颈漏斗的作用是___________ 。
③步骤v中“继续通入 一段时间”的目的是
一段时间”的目的是___________ 。
(3)装置D中反应的离子方程式为___________ 。
(4)测定 产品的纯度,实验如下:
产品的纯度,实验如下:
①取 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,继续加热一段时间;
,继续加热一段时间;
②冷却后,滴入适量的稀硫酸和浓磷酸,使 转化为
转化为 ,加适量的蒸馏水配成250.00mL溶液;
,加适量的蒸馏水配成250.00mL溶液;
③取25.00mL溶液,用新配制的 的
的 标准溶液滴定至终点,重复3次,平均消耗
标准溶液滴定至终点,重复3次,平均消耗 标准溶液VmL(已知
标准溶液VmL(已知 被
被 还原为
还原为 )。
)。
则样品中 (摩尔质量为
(摩尔质量为 )的质量分数为
)的质量分数为___________ %;若步骤③中所用标准溶液已变质,将导致 质量分数测定值
质量分数测定值___________ (填“偏高”、“偏低”或“无影响”)。
 和
和 (沸点76.8℃)在高温下制备无水
(沸点76.8℃)在高温下制备无水 ,同时生成
,同时生成 气体。实验装置(加热及夹持装置略)如图所示。
气体。实验装置(加热及夹持装置略)如图所示。
已知:
 气体有毒,遇水发生水解产生两种酸性气体。
气体有毒,遇水发生水解产生两种酸性气体。回答下列问题:
(1)实验装置合理的连接顺序为a→
(2)制备
 时进行操作:(i)连接装置,……;(ii)装入药品并通入
时进行操作:(i)连接装置,……;(ii)装入药品并通入 ;加热石英管至400℃;(ⅲ)停止通入
;加热石英管至400℃;(ⅲ)停止通入 ,加热E装置;(iv)加热石英管继续升温至650℃,直到B中反应基本完成,切断管式炉的电源;(v)停止E装置加热,继续通入
,加热E装置;(iv)加热石英管继续升温至650℃,直到B中反应基本完成,切断管式炉的电源;(v)停止E装置加热,继续通入 一段时间;(vi)装置冷却后,结束制备实验。
一段时间;(vi)装置冷却后,结束制备实验。①补全步骤i的操作
②实验过程中为了形成稳定的
 气流,对E装置加热的最佳方式是
气流,对E装置加热的最佳方式是③步骤v中“继续通入
 一段时间”的目的是
一段时间”的目的是(3)装置D中反应的离子方程式为
(4)测定
 产品的纯度,实验如下:
产品的纯度,实验如下:①取
 产品,在强碱性条件下,加入过量
产品,在强碱性条件下,加入过量 溶液,小火加热使
溶液,小火加热使 完全转化为
完全转化为 ,继续加热一段时间;
,继续加热一段时间;②冷却后,滴入适量的稀硫酸和浓磷酸,使
 转化为
转化为 ,加适量的蒸馏水配成250.00mL溶液;
,加适量的蒸馏水配成250.00mL溶液;③取25.00mL溶液,用新配制的
 的
的 标准溶液滴定至终点,重复3次,平均消耗
标准溶液滴定至终点,重复3次,平均消耗 标准溶液VmL(已知
标准溶液VmL(已知 被
被 还原为
还原为 )。
)。则样品中
 (摩尔质量为
(摩尔质量为 )的质量分数为
)的质量分数为 质量分数测定值
质量分数测定值
您最近一年使用:0次
2023-12-08更新
|
410次组卷
|
3卷引用:天津市2023-2024学年天津一中高三年级第二次月考化学
解题方法
2 . 某小组设计制备补铁剂甘氨酸亚铁的实验步骤和装置图(夹持装置省略)如图:
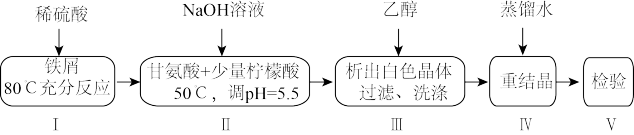
合成反应为:2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O。
有关物质性质如表所示:
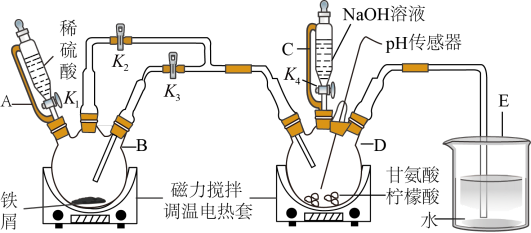
回答下列问题:
(1)步骤I制备FeSO4,先打开K1、K2,关闭K3,充分反应后(仍有气泡),将B中溶液转移到D中的操作是______ 。
(2)步骤I、II中,为了防止Fe2+被氧化,采取的措施有______ 、______ (填2种)。
(3)步骤II,D中反应液pH过高或过低均会导致产率降低,原因是______ 。
(4)下列说法不正确 的是______ 。
(5)步骤V,检测产品中铁元素的含量,需要用到如图电子天平,以差量法 准确称量样品。操作的正确排序为:电子天平开机预热→A→B→______→______→______→______→F。______

A.调水平(使水平仪气泡归中)
B.利用标准码进行校准
C.往称量瓶中加入一定量样品,放回秤盘
D.将称量瓶置于秤盘中间,待示数不变时,按TAR键去皮
E.从称量瓶中倒出一定量样品,放回秤盘
F.关闭侧门,待示数不变时读数记录

合成反应为:2H2NCH2COOH+FeSO4+2NaOH=(H2NCH2COO)2Fe+Na2SO4+2H2O。
有关物质性质如表所示:
| 甘氨酸 | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇 | 易溶于水和乙醇 | 易溶于水,微溶于乙醇 |
| 具有两性 | 酸性和还原性 | 常温不易,氧化变质 |

回答下列问题:
(1)步骤I制备FeSO4,先打开K1、K2,关闭K3,充分反应后(仍有气泡),将B中溶液转移到D中的操作是
(2)步骤I、II中,为了防止Fe2+被氧化,采取的措施有
(3)步骤II,D中反应液pH过高或过低均会导致产率降低,原因是
(4)下列说法
| A.步骤I、II使用滴液漏斗A或C滴入液体时,无需取下上口玻璃塞 |
| B.步骤III加入乙醇的作用是降低甘氨酸亚铁的溶解度,促使其结晶析出 |
| C.步骤III过滤后洗涤,往漏斗中加水浸没沉淀,小心搅拌以加快过滤 |
| D.步骤IV重结晶,将粗产品溶解于适量水中,蒸发浓缩至出现大量晶体,趁热过滤 |

A.调水平(使水平仪气泡归中)
B.利用标准码进行校准
C.往称量瓶中加入一定量样品,放回秤盘
D.将称量瓶置于秤盘中间,待示数不变时,按TAR键去皮
E.从称量瓶中倒出一定量样品,放回秤盘
F.关闭侧门,待示数不变时读数记录
您最近一年使用:0次
3 . 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 加热盛有 固体的试管,试管底部固体消失,试管口有固体凝结 固体的试管,试管底部固体消失,试管口有固体凝结 |  固体受热易升华 固体受热易升华 |
| B | 将 样品溶于稀硫酸后,滴加KSCN溶液,溶液变为红色 样品溶于稀硫酸后,滴加KSCN溶液,溶液变为红色 |  样品已变质 样品已变质 |
| C | 向无色气体中通入少量氧气,气体变成红棕色,加水振荡后变为无色 | 该无色气体含有NO |
| D | 取5mL 0.1 KI溶液,加入1mL 0.1 KI溶液,加入1mL 0.1  溶液,用 溶液,用 萃取,下层呈紫红色,分液后,向水层滴入KSCN溶液,溶液变成红色 萃取,下层呈紫红色,分液后,向水层滴入KSCN溶液,溶液变成红色 |  与 与 所发生的反应为可逆反应 所发生的反应为可逆反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-08-21更新
|
165次组卷
|
2卷引用:山东省青岛市第三十九中2023-2024学年高一下学期期中考试化学试卷
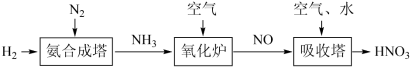
4 . I.空气中的氮氧化物主要来源:化石燃料燃烧、工业制硝酸尾气、汽车尾气。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:________ 。
(2)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为_______ 。
II.铁器时代是人类发展史中一个极为重要的时代,铁及其化合物在人类的生产、生活中都起了巨大的作用。
(3)长期放置的FeSO4溶液易被氧化而变质,实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是_______ (用离子方程式表示)。
(4)利用部分变质的FeSO4溶液制备Fe2O3:
部分变质的FeSO4溶液 溶液I
溶液I  沉淀II
沉淀II  Fe2O3
Fe2O3
①H2O2溶液的作用是______ 。
②写出由“溶液I”到“沉淀II”反应的离子方程式:______ 。
③“操作III”的名称为_______ 。
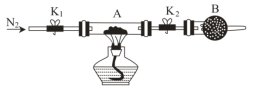
(5)为测定某绿矾FeSO4·xH2O中结晶水的含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g;将该绿矾FeSO4·xH2O样品装入石英玻璃管中,再次将装置A称重,记为m2g,按图示连接好装置进行实验。______ (填标号);重复上述操作步骤,直至装置A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量装置A f.冷却至室温
②根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水的数目x=_____ (列出计算式即可)。
(2)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO氧化NO生成
 和
和 ,其离子方程式为
,其离子方程式为II.铁器时代是人类发展史中一个极为重要的时代,铁及其化合物在人类的生产、生活中都起了巨大的作用。
(3)长期放置的FeSO4溶液易被氧化而变质,实验室用绿矾FeSO4·xH2O配制FeSO4溶液时为了防止FeSO4溶液变质,经常向其中加入铁粉,其原因是
(4)利用部分变质的FeSO4溶液制备Fe2O3:
部分变质的FeSO4溶液
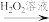 溶液I
溶液I  沉淀II
沉淀II 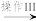 Fe2O3
Fe2O3①H2O2溶液的作用是
②写出由“溶液I”到“沉淀II”反应的离子方程式:
③“操作III”的名称为
(5)为测定某绿矾FeSO4·xH2O中结晶水的含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g;将该绿矾FeSO4·xH2O样品装入石英玻璃管中,再次将装置A称重,记为m2g,按图示连接好装置进行实验。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2 d.打开K1和K2,缓缓通入N2 e.称量装置A f.冷却至室温
②根据实验记录,计算绿矾FeSO4·xH2O化学式中结晶水的数目x=
您最近一年使用:0次
名校
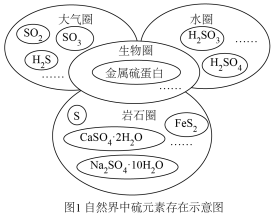
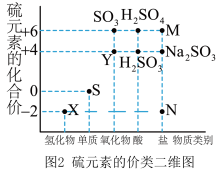
5 . 硫元素广泛存在于自然界中,是动植物生长不可缺少的元素。
I.图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。___________ 。
(2)工业上常以黄铁矿为原料来制备硫酸,通入空气焙烧黄铁矿的化学方程式为___________ 。
(3) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是___________ 。
II.小组同学利用图3装置测定空气中 的含量。
的含量。___________ ,该装置中发生反应的离子方程式为___________ 。
(5)若空气流速为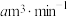 ,当观察到装置内
,当观察到装置内___________ 时,结束计时,测定耗时tmin,假定空气中的 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是___________  。
。
I.图1是自然界中硫元素的存在示意图,图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
(2)工业上常以黄铁矿为原料来制备硫酸,通入空气焙烧黄铁矿的化学方程式为
(3)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是II.小组同学利用图3装置测定空气中
 的含量。
的含量。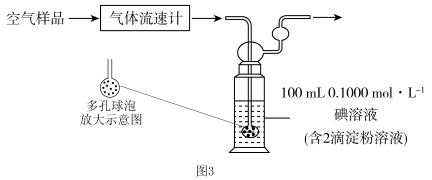
(5)若空气流速为
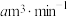 ,当观察到装置内
,当观察到装置内 可被溶液充分吸收,该空气样品中
可被溶液充分吸收,该空气样品中 的含量是
的含量是 。
。
您最近一年使用:0次
6 . 下列由相关实验现象所推出的结论不正确的是
A.取一定量 样品,溶解后加入 样品,溶解后加入 溶液,产生白色沉淀,加入稀硝酸,仍有沉淀,由此可知此样品已变质 溶液,产生白色沉淀,加入稀硝酸,仍有沉淀,由此可知此样品已变质 |
B.向某溶液滴加稀硝酸酸化的 溶液,产生白色沉淀,该溶液中含 溶液,产生白色沉淀,该溶液中含 |
C.向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则待测溶液中一定含有 |
| D.将气体通过无水硫酸铜粉末,粉末变蓝,表明原气体中一定含有水蒸气 |
您最近一年使用:0次
名校
解题方法
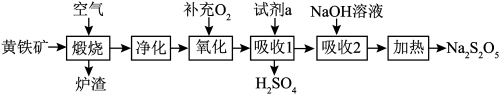
7 . 硫酸的消耗量是衡量一个国家化学工业发展水平的标志。以黄铁矿(主要成分为 )为原料生产
)为原料生产 和
和 。
。
(1) 中铁元素的化合价为
中铁元素的化合价为________ ;试剂a为________ 。
(2) 可和盐酸发生复分解反应生成一种不稳定的液态化合物,该化合物的电子式:
可和盐酸发生复分解反应生成一种不稳定的液态化合物,该化合物的电子式:________ 。
(3)煅烧时主要反应的化学方程式为____________ 。
(4)“氧化”时,反应的化学方程式为____________ 。
(5) 可用于葡萄酒的抗氧化剂,用碘液可以测定葡萄酒中
可用于葡萄酒的抗氧化剂,用碘液可以测定葡萄酒中 的含量,请写出其反应的离子方程式:
的含量,请写出其反应的离子方程式:__________ 。若要检验 是否变质生成了
是否变质生成了 ,设计简单实验进行检验
,设计简单实验进行检验____________ 。
(6)在测定某葡萄酒中 的含量时,取100.00mL葡萄酒样品,消耗
的含量时,取100.00mL葡萄酒样品,消耗 碘液20.00mL,样品中
碘液20.00mL,样品中 的含量为
的含量为________  。
。
 )为原料生产
)为原料生产 和
和 。
。
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)
 可和盐酸发生复分解反应生成一种不稳定的液态化合物,该化合物的电子式:
可和盐酸发生复分解反应生成一种不稳定的液态化合物,该化合物的电子式:(3)煅烧时主要反应的化学方程式为
(4)“氧化”时,反应的化学方程式为
(5)
 可用于葡萄酒的抗氧化剂,用碘液可以测定葡萄酒中
可用于葡萄酒的抗氧化剂,用碘液可以测定葡萄酒中 的含量,请写出其反应的离子方程式:
的含量,请写出其反应的离子方程式: 是否变质生成了
是否变质生成了 ,设计简单实验进行检验
,设计简单实验进行检验(6)在测定某葡萄酒中
 的含量时,取100.00mL葡萄酒样品,消耗
的含量时,取100.00mL葡萄酒样品,消耗 碘液20.00mL,样品中
碘液20.00mL,样品中 的含量为
的含量为 。
。
您最近一年使用:0次
名校
解题方法
8 . 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
| 选项 | 实验操作和现象 | 结论 |
| A | 将SO2通入酸性高锰酸钾溶液,溶液褪色 | SO2具有漂白性 |
| B | 将除去氧化膜的铝片放入浓硫酸中,无明显现象 | 常温下铝和浓硫酸不反应 |
| C | 取少量Na2SO3固体样品配成溶液,加入足量盐酸酸化,再加氯化钡溶液,有白色沉淀产生 | 该Na2SO3样品变质 |
| D | 取少量食盐样品,溶于水,向其中加入淀粉溶液,溶液不变蓝 | 该食盐样品中没有添加KIO3 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-19更新
|
290次组卷
|
2卷引用:江苏省宿迁市青华中学2023-2024学年高一上学期化学综合练习(二)
名校
解题方法
9 . 氯化亚铜(CuCl)广泛用于冶金、电镀、医药等行业。已知CuCl难溶于水和乙醇,在潮湿空气中易变质。学习小组开展了与CuCl相关的系列实验。回答下列问题:
Ⅰ.利用废铜屑制备 ,实验装置如图所示。
,实验装置如图所示。_______ 。
(2)三颈烧瓶中制备 的化学方程式为
的化学方程式为____ ,将浓盐酸加入三颈烧瓶的操作为:____ ,再将分液漏斗下面的活塞打开。
Ⅱ.制备氯化亚铜,制备流程如图所示:
(3)反应①中氧化剂与还原剂的物质的量之比为_______ ,操作②为_______ 。
(4)析出的CuCl粗产品不用盐酸而用水、乙醇分别洗涤的目的依次是_____ 、_______ 。
(5)测定产品中CuCl的质量分数。准确称取制备的CuCl产品0.40g,加入足量的氯化铁溶液,待样品全部溶解后,加入适量稀硫酸,用 的
的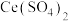 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗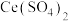 溶液24.00mL,反应中
溶液24.00mL,反应中 被还原为
被还原为 ,产品中CuCl的质量分数为
,产品中CuCl的质量分数为_____ (保留四位有效数字)。
Ⅰ.利用废铜屑制备
 ,实验装置如图所示。
,实验装置如图所示。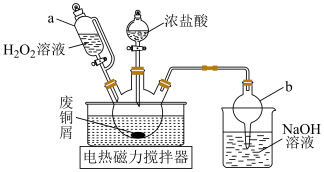
(2)三颈烧瓶中制备
 的化学方程式为
的化学方程式为Ⅱ.制备氯化亚铜,制备流程如图所示:


(3)反应①中氧化剂与还原剂的物质的量之比为
(4)析出的CuCl粗产品不用盐酸而用水、乙醇分别洗涤的目的依次是
(5)测定产品中CuCl的质量分数。准确称取制备的CuCl产品0.40g,加入足量的氯化铁溶液,待样品全部溶解后,加入适量稀硫酸,用
 的
的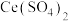 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗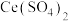 溶液24.00mL,反应中
溶液24.00mL,反应中 被还原为
被还原为 ,产品中CuCl的质量分数为
,产品中CuCl的质量分数为
您最近一年使用:0次
10 . 食品级焦亚硫酸钠 常用作食品的抗氧化剂,在空气中易氧化、受热易分解。实验室可通过制备
常用作食品的抗氧化剂,在空气中易氧化、受热易分解。实验室可通过制备 的过饱和溶液经结晶制得。回答下列问题:
的过饱和溶液经结晶制得。回答下列问题:
(1)实验室制备少量 的装置如图1所示:打开磁力搅拌器,将装有
的装置如图1所示:打开磁力搅拌器,将装有 过饱和溶液的锥形瓶置于40℃水浴中,通入
过饱和溶液的锥形瓶置于40℃水浴中,通入 ,当
,当 数字采集器测得溶液的
数字采集器测得溶液的 为
为___________ 时,停止反应,装置甲中生成 的过饱和溶液,在20℃左右静置结晶脱水制得焦亚硫酸钠。从装置甲中获得已析出的晶体,可采取的分离方法是
的过饱和溶液,在20℃左右静置结晶脱水制得焦亚硫酸钠。从装置甲中获得已析出的晶体,可采取的分离方法是___________ 。 转化成
转化成 的化学方程式为
的化学方程式为___________ 。
(2)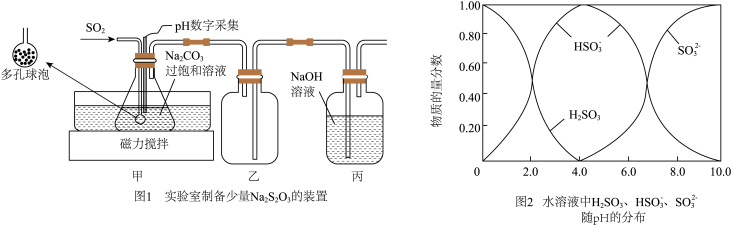
通 气体的导管末端是带许多小孔的玻璃球泡,其主要作用是
气体的导管末端是带许多小孔的玻璃球泡,其主要作用是___________ 。
(3)析出固体的反应液经减压蒸发、冷却结晶、减压抽滤、洗涤、25℃~30℃干燥,可进一步获得 固体。其中减压蒸发是为了
固体。其中减压蒸发是为了___________ 。
(4)长期放置的 晶体会部分氧化而发生变质,验证产品是否变质时所需的试剂是
晶体会部分氧化而发生变质,验证产品是否变质时所需的试剂是___________ 。(已知: 溶于水即生成
溶于水即生成 )
)
(5)某机构通过下述方法检测变质样品中抗氧化剂 残留的含量,步骤如下:
残留的含量,步骤如下:
步骤一:取配制后的样品溶液 于锥形瓶中(假设其他杂质不反应)。
于锥形瓶中(假设其他杂质不反应)。
步骤二:用 的碘标准液滴定至终点,消耗碘标准液
的碘标准液滴定至终点,消耗碘标准液 。
。
滴定反应的离子方程式为___________ ,该样品中 的残留量为
的残留量为___________  。
。
 常用作食品的抗氧化剂,在空气中易氧化、受热易分解。实验室可通过制备
常用作食品的抗氧化剂,在空气中易氧化、受热易分解。实验室可通过制备 的过饱和溶液经结晶制得。回答下列问题:
的过饱和溶液经结晶制得。回答下列问题:(1)实验室制备少量
 的装置如图1所示:打开磁力搅拌器,将装有
的装置如图1所示:打开磁力搅拌器,将装有 过饱和溶液的锥形瓶置于40℃水浴中,通入
过饱和溶液的锥形瓶置于40℃水浴中,通入 ,当
,当 数字采集器测得溶液的
数字采集器测得溶液的 为
为 的过饱和溶液,在20℃左右静置结晶脱水制得焦亚硫酸钠。从装置甲中获得已析出的晶体,可采取的分离方法是
的过饱和溶液,在20℃左右静置结晶脱水制得焦亚硫酸钠。从装置甲中获得已析出的晶体,可采取的分离方法是 转化成
转化成 的化学方程式为
的化学方程式为(2)

通
 气体的导管末端是带许多小孔的玻璃球泡,其主要作用是
气体的导管末端是带许多小孔的玻璃球泡,其主要作用是(3)析出固体的反应液经减压蒸发、冷却结晶、减压抽滤、洗涤、25℃~30℃干燥,可进一步获得
 固体。其中减压蒸发是为了
固体。其中减压蒸发是为了(4)长期放置的
 晶体会部分氧化而发生变质,验证产品是否变质时所需的试剂是
晶体会部分氧化而发生变质,验证产品是否变质时所需的试剂是 溶于水即生成
溶于水即生成 )
)(5)某机构通过下述方法检测变质样品中抗氧化剂
 残留的含量,步骤如下:
残留的含量,步骤如下:步骤一:取配制后的样品溶液
 于锥形瓶中(假设其他杂质不反应)。
于锥形瓶中(假设其他杂质不反应)。步骤二:用
 的碘标准液滴定至终点,消耗碘标准液
的碘标准液滴定至终点,消耗碘标准液 。
。滴定反应的离子方程式为
 的残留量为
的残留量为 。
。
您最近一年使用:0次



