| 选项 | 实验操作 | 现象 | 结论 |
| A | 将 样品溶于稀 样品溶于稀 ,滴加KSCN溶液 ,滴加KSCN溶液 | 观察到溶液变红 |  样品已氧化变质 样品已氧化变质 |
| B | 将乙醇和浓硫酸混合溶液加热至170℃,将产生的气体通入溴水中 | 溴水褪色 | 有乙烯生成 |
| C | 取少量酸催化后的淀粉水解液于试管中,先加入过量氢氧化钠溶液中和酸,再加少量碘水 | 溶液未变蓝 | 淀粉已经完全水解 |
| D | 向盛有 溶液的试管中滴加碳酸氢钠溶液 溶液的试管中滴加碳酸氢钠溶液 | 产生白色沉淀 |  结合氢离子的能力比 结合氢离子的能力比 强 强 |
| A.A | B.B | C.C | D.D |
①取mg CrCl3产品,在强碱性条件下,加入过量30%H2O2溶液,小火加热使CrCl3完全转化为CrO
 ,继续加热一段时间;
,继续加热一段时间;②冷却后,滴入适量的稀硫酸和浓磷酸,使CrO
 转化为Cr2O
转化为Cr2O ,加适量的蒸馏水配成250.00mL溶液;
,加适量的蒸馏水配成250.00mL溶液;③取25.00mL溶液,用新配制的
 的NH4)2Fe(SO4)2标准溶液滴定至终点,重复3次,平均消耗NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O
的NH4)2Fe(SO4)2标准溶液滴定至终点,重复3次,平均消耗NH4)2Fe(SO4)2标准溶液VmL(已知Cr2O 被
被 还原为Cr3+)。
还原为Cr3+)。则样品中CrCl3 (摩尔质量为M g·molˉ1)的质量分数为
 而变质。
而变质。(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入
 已经变质。
已经变质。(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。

①A中发生反应离子方程式为
②将仪器连接好以后,必须进行的第一步操作是
③写出装置C中发生的所有反应的化学方程式
④D中NaOH溶液的作用
⑤实验结束时,读取实验中生成气体的体积时,不合理的是
A.直接读取气体体积,不需冷却到室温
B.上下移动量筒,使得E、F中液面高度相同
C.视线与凹液面的最低点相平读取量筒中水的体积
⑥读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
 (
(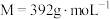 )。摩尔盐是浅蓝绿色晶体,溶于水,但在水中溶解度比硫酸亚铁和硫酸铵都要小,几乎不溶于乙醇,在空气中比硫酸亚铁稳定。以下是摩尔盐的制备步骤。
)。摩尔盐是浅蓝绿色晶体,溶于水,但在水中溶解度比硫酸亚铁和硫酸铵都要小,几乎不溶于乙醇,在空气中比硫酸亚铁稳定。以下是摩尔盐的制备步骤。Ⅰ.把30%
 溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的
溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的 溶液装入右边广口瓶中。
溶液装入右边广口瓶中。Ⅱ.在锥形瓶中用处理过的铁屑和稀
 反应制取
反应制取 。
。Ⅲ.将硫酸亚铁溶液与硫酸铵溶液混合,结晶,过滤,用乙醇洗涤后再低温烘干,得到摩尔盐。

(1)装硫酸的仪器的名称是
(2)用
 溶液洗涤废铁屑的目的是
溶液洗涤废铁屑的目的是(3)Fe屑和稀
 反应产生的氢气可赶走装置中的氧气及
反应产生的氢气可赶走装置中的氧气及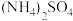 溶液中的溶解氧,操作时应先关闭活塞
溶液中的溶解氧,操作时应先关闭活塞(4)摩尔盐中铵离子检验方法是
(5)步骤Ⅲ过滤后用乙醇洗涤后再低温烘干。用乙醇洗涤的原因是
(6)取10.00g所制得的固体于小烧杯中,加入适量稀硫酸,溶解后在
 容量瓶中定容。取定容后溶液
容量瓶中定容。取定容后溶液 于锥形瓶中,用
于锥形瓶中,用 的
的 溶液滴定至终点。平行操作三次,消耗
溶液滴定至终点。平行操作三次,消耗 溶液的体积分别为
溶液的体积分别为 、
、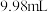 、
、 。此样品中
。此样品中 含量最接近
含量最接近A.11% B.12% C.13% D.14%
导致该测定结果比理论值偏低的可能原因是
A.配摩尔盐溶液定容时俯视刻度线 B.取摩尔盐溶液的滴定管没有润洗
C.滴定用的锥形瓶洗净后未干燥 D.高锰酸钾部分变质
(7)将摩尔盐隔绝空气加热到773K时会分解,分解产物有氧化铁、硫的氧化物、氨气和水。写出该反应的化学方程式
5 . (1)实验室有一瓶久置的亚硫酸钠溶液,同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
【提出问题】该溶液中溶质成分是什么?该溶液中亚硫酸钠的物质的量浓度是多少?
【查阅资料】 有较强还原性,在空气中易被氧气氧化
有较强还原性,在空气中易被氧气氧化
【作出猜想】猜想 :没有变质,成分是
:没有变质,成分是
猜想 :完全变质,成分是
:完全变质,成分是
猜想 :部分变质,成分是
:部分变质,成分是 和
和
【实验探究Ⅰ】
(1)甲组设计实验探究溶液是否变质
甲组 | 实验操作 | 现象 | 结论 |
步骤 | 取少量样品于试管中加入过量稀盐酸 | 产生气泡 | 溶液中含有 |
步骤 | 另取样品于试管中,滴加足量氯化钡溶液,再滴加足量稀盐酸 | 溶液中含有 |
实验结论:样品部分变质。样品在空气中变质的化学方程式:
【实验探究Ⅱ】
(2)乙组设计如下实验测定
 溶液物质的量浓度。
溶液物质的量浓度。①连好装置并检查装置气密性,在锥形瓶中放入 该样品,通入
该样品,通入 。
。
②称量C装置的质量为 。
。
③关闭活塞 ,用注射器推入浓硫酸至不再产生气泡,注射器可以换为
,用注射器推入浓硫酸至不再产生气泡,注射器可以换为
④打开活塞 ,再缓缓鼓入一定量的
,再缓缓鼓入一定量的 ,继续通入
,继续通入 的作用是
的作用是
⑤再次称量C装置的质量为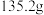 。
。

⑥计算出原溶液中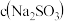 =
= 装置,实验结果将
装置,实验结果将 填“偏大”“不变”或“偏小”
填“偏大”“不变”或“偏小” 。
。
方案一:
(1)研究小组同学准备用 NaOH 固体配制240mL1.0
 的NaOH溶液。
的NaOH溶液。①本实验必须用到的玻璃仪器有:量筒、胶头滴管、烧杯、
②要配制出此溶液,研究小组同学应用托盘天平称出
③在配制过程中,小组同学的其他操作都是正确的,但下列操作中会引起所配制溶液浓度偏高的是
A. NaOH固体在称量前已部分变质
B. 有少量NaOH溶液残留在烧杯里
C. 定容时,俯视容量瓶的刻度线
D. 定容摇匀后,发现溶液凹液面最低处低于刻度线,用胶头滴管补水至刻度线
(2)称取8.1g 铝镁合金粉末样品,溶于VmL1.0
 的NaOH溶液中,充分反应,过滤、洗涤、干燥、称量固体,该步骤中若未洗涤固体,测得铝的质量分数将
的NaOH溶液中,充分反应,过滤、洗涤、干燥、称量固体,该步骤中若未洗涤固体,测得铝的质量分数将方案二:
将5.1g 铝镁合金与足量稀硫酸反应,测定生成气体的体积。
(3)同学们拟选用下图实验装置完成实验:
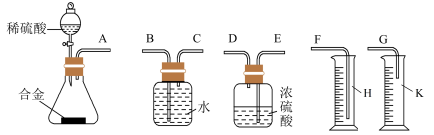
①你认为最简易的装置的连接顺序是:A接______,_______接______,______接______(填接口字母,可不填满)。
②实验结束时,在测量实验中生成氢气的体积时,你认为合理的是
A.待实验装置冷却后再读数
B.上下移动量筒H,使其中液面与广口瓶中液面相平
C.视线与凹液面的最低点水平相切,读取量筒中水的体积
D.上下移动量筒K,使其中液面与广口瓶中液面相平
(4)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:
①稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;
②实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小,于是他们设计了如图所示的实验装置:
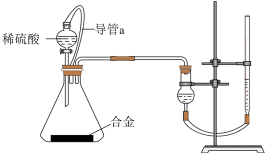
①装置中导管a的作用是
②实验后测得生成的氢气在标准状况下的体积为5.6 L,则铝的质量分数为
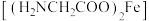 是一种补血剂,工业上用赤铁矿(含少量铝、铜、锰的氧化物)制备甘氨酸亚铁的流程图如下:
是一种补血剂,工业上用赤铁矿(含少量铝、铜、锰的氧化物)制备甘氨酸亚铁的流程图如下:
已知:甘氨酸
 易溶于水,微溶于乙醇,具有两性,例如甘氨酸可与碳酸钠反应生成
易溶于水,微溶于乙醇,具有两性,例如甘氨酸可与碳酸钠反应生成 (
( )
)回答下列问题:
(1)“碱浸”去除的元素是
(2)“还原”时的离子方程式是
(3)“沉淀”的离子方程式是
(4)柠檬酸的作用是防止
 氧化,则“反应”的化学方程式为
氧化,则“反应”的化学方程式为(5)
 也是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是
也是一种常用的补血剂,在空气中易变质,检验其是否变质的试剂是 的含量。
的含量。①配制:用分析天平称取
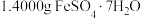 样品,再用煮沸并冷却的蒸馏水配制
样品,再用煮沸并冷却的蒸馏水配制 溶液。配制时除量筒外还需要的定量仪器是
溶液。配制时除量筒外还需要的定量仪器是②以下操作,会导致所配溶液浓度偏大的是
A.配溶液所用
 晶体已部分失去结晶水
晶体已部分失去结晶水B.转移前,容量瓶内有少量蒸馏水
C.定容时俯视刻度线
D.定容时液面超过刻度线,立即用胶头滴管吸出
E.摇匀后液面低于刻度线
③滴定:用酸化的
 溶液滴定
溶液滴定取
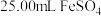 溶液于锥形瓶中,用
溶液于锥形瓶中,用 的
的 溶液滴定至
溶液滴定至 溶液恰好完全反应,消耗
溶液恰好完全反应,消耗 溶液
溶液 ,则样品中
,则样品中 的含量为
的含量为实验操作和现象 | 结论 | |
| A | 取某无色溶液做焰色试验观察到焰色为黄色 | 该溶液只含 ,无 ,无 |
| B | 向某物质的水溶液中加入盐酸能产生无色无味气体 | 该溶液中一定含有 |
| C | 取少量高锰酸钾溶液于试管中,加入氯化亚铁样品,高锰酸钾溶液褪色 | 该样品一定未变质 |
| D | 向淀粉碘化钾溶液中滴加氯水后溶液变蓝 | Cl的非金属性强于I |
| A.A | B.B | C.C | D.D |
(1)探究一包Na2O2样品是否已经变质:取少量样品,加水将其溶解,加入
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了mg样品,并设计用下图装置来测定过氧化钠的质量分数。
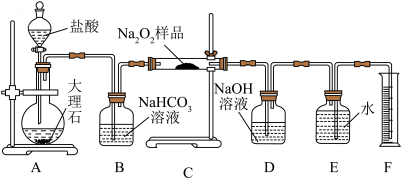
②将仪器连接好以后,必须进行的第一步操作是
③写出装置C中发生的主要反应的化学方程式:
④装置D的作用是
⑤实验结束后,装置F中水的体积为VmL,已知氧气的密度为ρg·mL-1,样品中Na2O2质量分数为
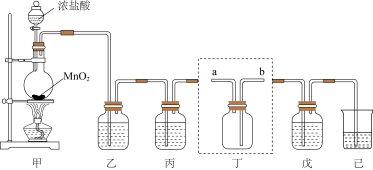
回答下列问题:
(1)装置甲中发生反应的离子方程式为
(2)装置乙、丙中盛装的试剂分别为是
(3)装置丁用来收集纯净且干燥的氯气,进气口为
(4)装置戊中盛装石灰乳用来制备漂白粉,则装置戊中发生反应的化学方程式为
(5)漂白粉长时间暴露在空气中容易发生变质,为了判断一份久置的漂白粉是否变质及变质程度,甲、乙两位同学分别设计实验进行验证:甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊:他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。
已知:
 溶液呈碱性:
溶液呈碱性: ;
;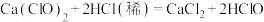
①漂白粉中的
 能与空气中的
能与空气中的 和水蒸气反应,从而发生变质,写出该反应的化学方程
和水蒸气反应,从而发生变质,写出该反应的化学方程②乙同学认为甲同学的实验无法证明漂白粉是否变质,原因是
③由乙同学的实验可以证明漂白粉
(6)装置己的作用是吸收多余的氯气,可选用试剂______。(填标号)。
| A.稀硫酸 | B. | C. | D. |



