解题方法
1 . 已知:元素A、B、C、D、E、F的原子序数依次增大且在前四周期均有分布,其中A、B、C、D、E为序数不大于20的主族元素。B的一种核素常用于测定文物的年代;C是地壳中含量最高的金属元素;D原子的最外层电子数等于B、C原子的最外层电子数之和;元素E与A同族,且其焰色实验的火焰不是黄色;F是用途最广泛的金属,它的一种氧化物可以作磁性材料。请根据上述信息回答下列问题。
(1)D的原子结构示意图为________ 。B元素最高价氧化物的电子式为________ 。
(2)A元素与B元素形成的化合物属________ 于(填“离子”或“共价”)化合物;A元素与E元素形成的化合物属于________ (填“离子”或“共价”)化合物。
(3)F元素的单质可以在D元素的单质中燃烧,其产物与水反应可以得到能产生丁达尔效应的分散系,写出该化学方程式:________ 。
(4)写出证明D元素的非金属性大于B元素的化学方程式:________ 。
(5)C、D、E的简单离子半径由大到小的顺序为________ (填离子符号)。
(6)E元素的一种氧化物G,其阴阳离子个数比为 ,G的化学式为
,G的化学式为________ ,G与水反应是潜艇供氧的方式之一,写出其化学方程式:________ 。
(1)D的原子结构示意图为
(2)A元素与B元素形成的化合物属
(3)F元素的单质可以在D元素的单质中燃烧,其产物与水反应可以得到能产生丁达尔效应的分散系,写出该化学方程式:
(4)写出证明D元素的非金属性大于B元素的化学方程式:
(5)C、D、E的简单离子半径由大到小的顺序为
(6)E元素的一种氧化物G,其阴阳离子个数比为
 ,G的化学式为
,G的化学式为
您最近一年使用:0次
名校
2 . 氢气是一种理想的绿色清洁能源,氢气的制取是氢能源利用领域的研究热点。
(1)碱金属氢化物制氢。以一种制氢储氢材料氢化钠(NaH)在室温下结合 制氢为例,反应为
制氢为例,反应为 。
。
①NaH的电子式为___________ ;
②在化学方程式上标出该反应中电子转移的方向与数目___________ 。
(2)甲烷重整制氢。主要反应为: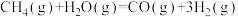 ;
;
① 中氢元素的质量分数为
中氢元素的质量分数为___________ ,是含氢量最高的有机物;甲烷重整制氢是我国目前最主要的制氢来源。
②碳元素在周期表中的位置为___________ ;当1个碳原子与其他4个原子连接时,这个碳原子将采取___________ (填“空间构型”)取向与之成键形成稳定结构,使得烷烃性质稳定。
③汽油的辛烷值的测定是以异辛烷和正庚烷为标准燃料进行的,它们互为___________ ;该异辛烷的结构简式为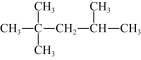 ,用系统命名法命名该有机物
,用系统命名法命名该有机物___________ ;写出同时满足下列条件的正庚烷的一种同分异构体的结构简式:___________ (a.一个支链,b.该物质在光照下与氯气取代的一氯代物有3种)。
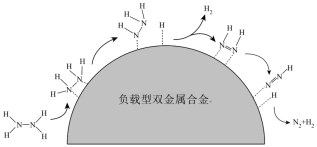
(3)肼催化分解制氢。在温和条件下,负载型双金属合金催化肼( )迅速分解,并且制氢选择性可达100%,可能机理如图所示,(图上“虚线”表示吸附在催化剂上)
)迅速分解,并且制氢选择性可达100%,可能机理如图所示,(图上“虚线”表示吸附在催化剂上)  催化分解制氢的总反应方程式为
催化分解制氢的总反应方程式为___________ 。
(1)碱金属氢化物制氢。以一种制氢储氢材料氢化钠(NaH)在室温下结合
 制氢为例,反应为
制氢为例,反应为 。
。①NaH的电子式为
②在化学方程式上标出该反应中电子转移的方向与数目
(2)甲烷重整制氢。主要反应为:
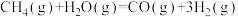 ;
;
①
 中氢元素的质量分数为
中氢元素的质量分数为②碳元素在周期表中的位置为
③汽油的辛烷值的测定是以异辛烷和正庚烷为标准燃料进行的,它们互为
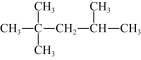 ,用系统命名法命名该有机物
,用系统命名法命名该有机物(3)肼催化分解制氢。在温和条件下,负载型双金属合金催化肼(
 )迅速分解,并且制氢选择性可达100%,可能机理如图所示,(图上“虚线”表示吸附在催化剂上)
)迅速分解,并且制氢选择性可达100%,可能机理如图所示,(图上“虚线”表示吸附在催化剂上)  催化分解制氢的总反应方程式为
催化分解制氢的总反应方程式为
您最近一年使用:0次
2023-04-22更新
|
195次组卷
|
2卷引用:江苏省黄埭中学2022-2023学年高一下学期期中调研测试化学试题
名校
解题方法
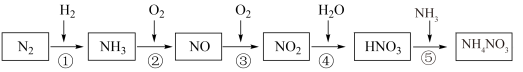
3 . 氮元素及其化合物的转化关系如图所示:___________ ,写出 的电子式
的电子式___________ 。
(2)浓、稀 的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:
的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:___________ 。
(3)氮氧化物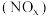 是大气污染物之一,处理
是大气污染物之一,处理 对于环境保护具有重要的意义。在一定条件下
对于环境保护具有重要的意义。在一定条件下 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。 ,反应的化学方程式为
,反应的化学方程式为___________ ;装置B内的试剂是___________ 。
②在装置 中
中 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中  和
和 的物质的量之比为
的物质的量之比为___________ 。
③工厂里常采用 溶液吸收
溶液吸收 的混合气体,使其转化为化工产品
的混合气体,使其转化为化工产品 ,试写出其化学方程式:
,试写出其化学方程式:___________ 。
④用不同浓度的 溶液吸收
溶液吸收 含量不同的尾气,关系如图:(
含量不同的尾气,关系如图:( 表示尾气里
表示尾气里 中
中 的含量)
的含量) 含量越大,氮氧化物的吸收率越大,当
含量越大,氮氧化物的吸收率越大,当 小于
小于 时,加入
时,加入  能提升氮氧化物的吸收率,原因是
能提升氮氧化物的吸收率,原因是___________ 。
(4) 是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:
是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:___________ (写出操作步骤、现象和结论)。
 的电子式
的电子式(2)浓、稀
 的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:
的性质既相似又有差别,写出足量的铁与稀硝酸反应的离子方程式:(3)氮氧化物
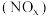 是大气污染物之一,处理
是大气污染物之一,处理 对于环境保护具有重要的意义。在一定条件下
对于环境保护具有重要的意义。在一定条件下 可将
可将 还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。
还原。甲同学在实验室对该反应进行了探究。实验设计如图(部分夹持装置省略)。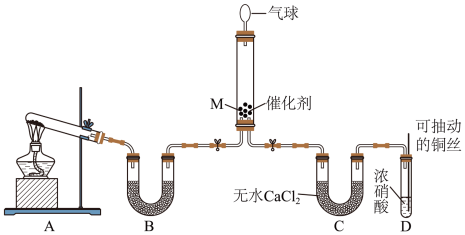
 ,反应的化学方程式为
,反应的化学方程式为②在装置
 中
中 和
和 充分反应,生成两种对环境友好的物质,该反应中
充分反应,生成两种对环境友好的物质,该反应中  和
和 的物质的量之比为
的物质的量之比为③工厂里常采用
 溶液吸收
溶液吸收 的混合气体,使其转化为化工产品
的混合气体,使其转化为化工产品 ,试写出其化学方程式:
,试写出其化学方程式:④用不同浓度的
 溶液吸收
溶液吸收 含量不同的尾气,关系如图:(
含量不同的尾气,关系如图:( 表示尾气里
表示尾气里 中
中 的含量)
的含量)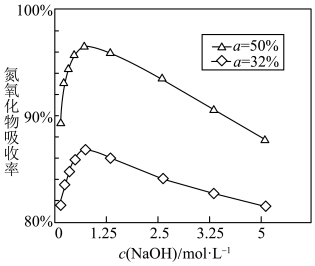
 含量越大,氮氧化物的吸收率越大,当
含量越大,氮氧化物的吸收率越大,当 小于
小于 时,加入
时,加入  能提升氮氧化物的吸收率,原因是
能提升氮氧化物的吸收率,原因是(4)
 是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:
是农业生产中常用的一种氮肥。实验室中检验某种化肥是铵态氮肥的方法是:
您最近一年使用:0次
4 . A、B、C、D、E、F、G的原子序数依次增大的元素,A、D元素的原子最外层电子数相同,A元素的一种原子没有中子;B的一种同位素可用于考古断代;C是地壳中含量最多的一种元素;D元素的阳离子电子层结构与氖原子相同;E的最外层电子数是电子层数的2倍;F的单质具有强氧化性。G是用途最广泛的金属元素,它的单质能被磁铁所吸引;试回答以下问题:
(1)ACD形成的化合物含的化学键有___________ 。
(2)D单质与C单质在加热条件下反应产物的电子式___________ ,该物质与 反应的离子方程式
反应的离子方程式___________ 。
(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性。则甲、乙反应的化学方程式为___________ 。
(4)E的最高价氧化物对应水合物的浓溶液在加热条件下加入过量的G单质,反应的化学方程式为___________
(5)用电子式写出 的形成过程
的形成过程___________ 。
(1)ACD形成的化合物含的化学键有
(2)D单质与C单质在加热条件下反应产物的电子式
 反应的离子方程式
反应的离子方程式(3)化合物甲、乙由A、B、C、D中的三种或四种组成的常见物质,且甲、乙的水溶液均呈碱性。则甲、乙反应的化学方程式为
(4)E的最高价氧化物对应水合物的浓溶液在加热条件下加入过量的G单质,反应的化学方程式为
(5)用电子式写出
 的形成过程
的形成过程
您最近一年使用:0次
名校
解题方法
5 . 甲、乙、丙、丁、戊分别是1-18号元素中的五种,且原子序数依次增大,甲元素丰度最大的核素中没有中子;乙元素的原子最外层电子数是内层电子数的两倍;丙为地壳中含量最多的元素;丁的最外层电子数与甲相同;戊的L层电子数为其电子总数的一半。
(1)写出丙元素原子的结构示意图___________ ,其原子在化学反应中容易(得到或失去)_________ 电子而达到稳定结构,写出该原子达到稳定结构后的微粒的电子式___________ ;
(2)戊元素在自然界中有四种稳定的核素,其中子数分别为16、17、18、20,各核素的丰度依次为95.02%、0.75%、4.21%和0.02%,其中中子数为18的核素的符号为___________ ,戊元素的近似相对原子质量为___________ (保留2为小数);
(3)上述五种元素的原子形成的简单离子中电子层结构相同的是(写离子符号)___________ ;
(4)写出甲元素的三种核素的名称___________ ,甲和丁元素能形成化合物,试写出化学式并标出各元素的化合价___________ 。
(1)写出丙元素原子的结构示意图
(2)戊元素在自然界中有四种稳定的核素,其中子数分别为16、17、18、20,各核素的丰度依次为95.02%、0.75%、4.21%和0.02%,其中中子数为18的核素的符号为
(3)上述五种元素的原子形成的简单离子中电子层结构相同的是(写离子符号)
(4)写出甲元素的三种核素的名称
您最近一年使用:0次
6 .  为原子序数依次增大的六种短周期主族元素。
为原子序数依次增大的六种短周期主族元素。 是原子半径最小的元素;
是原子半径最小的元素; 原子最外层电子数是核外电子层数的3倍;
原子最外层电子数是核外电子层数的3倍; 是短周期中金属性最强的元素;
是短周期中金属性最强的元素; 是地壳中含量最多的金属元素;
是地壳中含量最多的金属元素; 的最高正价与最低负价代数和为4。回答下列问题:
的最高正价与最低负价代数和为4。回答下列问题:
(1)用电子式表示
 的形成过程:
的形成过程:(2)W在周期表中的位置是
(3)ZYX的电子式为
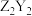 中含有的化学键类型为
中含有的化学键类型为(4)
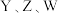 三种元素对应的简单离子半径由大到小的顺序是
三种元素对应的简单离子半径由大到小的顺序是(5)下列说法能证明非金属性
 强于
强于 的是
的是a.简单阴离子的还原性: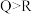 b.简单氢化物热稳定性:
b.简单氢化物热稳定性:
c.氧化物对应的水化物的酸性: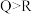 d.
d.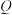 的单质能从
的单质能从 溶液中置换出
溶液中置换出 单质
单质
(6)
 的单质与
的单质与 的最高价氧化物对应的水化物反应的化学方程式为
的最高价氧化物对应的水化物反应的化学方程式为
您最近一年使用:0次
2024-03-29更新
|
167次组卷
|
2卷引用:山西省部分学校2023-2024学年高一上学期1月期末化学试题
7 . 烟道气中含有 ,通过一系列变化可得重要的无机化合物M(仅含两种元素,相对分子质量为184)。
,通过一系列变化可得重要的无机化合物M(仅含两种元素,相对分子质量为184)。

(1)写出 的电子式
的电子式___________ ;
(2)下列叙述正确的是___________ ;
A.烟道气中的 含量可用一定体积、浓度的酸性高锰酸钾溶液测定
含量可用一定体积、浓度的酸性高锰酸钾溶液测定
B. 是橡胶硫化剂,橡胶硫化程度越高,弹性越好
是橡胶硫化剂,橡胶硫化程度越高,弹性越好
C. 可与
可与 发生反应,能作为
发生反应,能作为 的脱水剂
的脱水剂
D. 固体中含阳离子
固体中含阳离子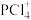 和阴离子
和阴离子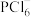 ,
,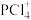 空间构型为正四面体
空间构型为正四面体
E. 易溶于
易溶于 ,则
,则 为非极性分子
为非极性分子
(3) 与过量
与过量 反应的化学方程式
反应的化学方程式___________ ;
(4) 与
与 反应除生成M外,同时有淡黄色固体和一种盐。则M的分子式为
反应除生成M外,同时有淡黄色固体和一种盐。则M的分子式为___________ ;
(5)设计实验检验 与足量NaOH溶液反应生成的阴离子
与足量NaOH溶液反应生成的阴离子___________ 。
 ,通过一系列变化可得重要的无机化合物M(仅含两种元素,相对分子质量为184)。
,通过一系列变化可得重要的无机化合物M(仅含两种元素,相对分子质量为184)。
(1)写出
 的电子式
的电子式(2)下列叙述正确的是
A.烟道气中的
 含量可用一定体积、浓度的酸性高锰酸钾溶液测定
含量可用一定体积、浓度的酸性高锰酸钾溶液测定B.
 是橡胶硫化剂,橡胶硫化程度越高,弹性越好
是橡胶硫化剂,橡胶硫化程度越高,弹性越好C.
 可与
可与 发生反应,能作为
发生反应,能作为 的脱水剂
的脱水剂D.
 固体中含阳离子
固体中含阳离子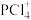 和阴离子
和阴离子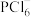 ,
,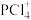 空间构型为正四面体
空间构型为正四面体E.
 易溶于
易溶于 ,则
,则 为非极性分子
为非极性分子(3)
 与过量
与过量 反应的化学方程式
反应的化学方程式(4)
 与
与 反应除生成M外,同时有淡黄色固体和一种盐。则M的分子式为
反应除生成M外,同时有淡黄色固体和一种盐。则M的分子式为(5)设计实验检验
 与足量NaOH溶液反应生成的阴离子
与足量NaOH溶液反应生成的阴离子
您最近一年使用:0次
名校
8 . 利用如图所示的“价-类”二维图,可以从物质类别、化合价角度认识含氯元素的物质的性质及其转化关系,图中甲~辛均为含氯元素的物质。回答下列问题:
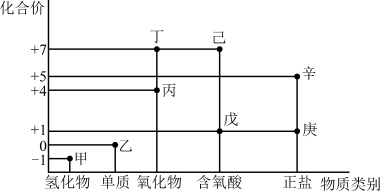
(1)将新制乙的水溶液滴加几滴到干燥的有色纸条上观察到的现象是_____ 。
(2)戊的结构式为______ ;甲、乙、丙、戊中,属于非电解质的是______ (填化学式)。
(3)丙是目前国际上公认的新一代的高效、广谱、安全的杀菌、保鲜剂,丙在杀菌消毒过程中会产生副产物亚氯酸盐(ClO ),需将其转化为Cl-除去。下列试剂中,可将ClO
),需将其转化为Cl-除去。下列试剂中,可将ClO 转化为Cl-的是
转化为Cl-的是_____ (填字母序号)。
a.Fe2(SO4)3 b.HClO4 c.SO2 d.KMnO4
(4)庚是“84”消毒液的有效成分,能有效灭菌,某化学社团模拟生产厂家配制了500mL“84消毒液”,并在瓶体贴上标签,如图所示,回答下列问题:
①写出氯气和NaOH溶液生产此消毒液的离子方程式______ ;该“84消毒液”有效成分的物质的量浓度为_____ (结果保留1位小数)。
②“84消毒液”与稀硫酸混合使用可增强消毒能力,该社团成员用18.0mol/L的浓硫酸配制90mL 0.90mol/L的稀硫酸用于增强“84消毒液”的消毒能力,需要量取上述浓硫酸的体积为_____ mL(结果保留1位小数).若所配制的稀硫酸浓度大于0.90mol/L,则可能的原因是_____ 。
A.配制前,容量瓶未干燥
B.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
C.浓硫酸溶解后未恢复到室温,立即转移至容量瓶定容
D.转移硫酸溶液至容量瓶时,有少量溶液溅出
E.定容时,仰视容量瓶刻度线进行定容

(1)将新制乙的水溶液滴加几滴到干燥的有色纸条上观察到的现象是
(2)戊的结构式为
(3)丙是目前国际上公认的新一代的高效、广谱、安全的杀菌、保鲜剂,丙在杀菌消毒过程中会产生副产物亚氯酸盐(ClO
 ),需将其转化为Cl-除去。下列试剂中,可将ClO
),需将其转化为Cl-除去。下列试剂中,可将ClO 转化为Cl-的是
转化为Cl-的是a.Fe2(SO4)3 b.HClO4 c.SO2 d.KMnO4
(4)庚是“84”消毒液的有效成分,能有效灭菌,某化学社团模拟生产厂家配制了500mL“84消毒液”,并在瓶体贴上标签,如图所示,回答下列问题:
| 84消毒液 有效成分 NaClO 规格 500mL 质量分数 25% 密度 1.19g•cm-3 |
②“84消毒液”与稀硫酸混合使用可增强消毒能力,该社团成员用18.0mol/L的浓硫酸配制90mL 0.90mol/L的稀硫酸用于增强“84消毒液”的消毒能力,需要量取上述浓硫酸的体积为
A.配制前,容量瓶未干燥
B.用量筒量取浓硫酸时,仰视刻度线取浓硫酸
C.浓硫酸溶解后未恢复到室温,立即转移至容量瓶定容
D.转移硫酸溶液至容量瓶时,有少量溶液溅出
E.定容时,仰视容量瓶刻度线进行定容
您最近一年使用:0次
解题方法
9 . 下表为元素周期表的一部分,请根据元素①~⑧所处的位置回答下列问题:
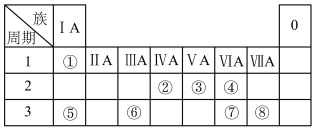
(1)元素④⑤⑧的离子半径由大到小的顺序为_______ (用离子符号表示)。
(2)元素⑦的原子结构示意图为_______ ,元素④⑦的最简单氢化物的稳定性关系为_______ (用化学式表示)。
(3)由元素④⑤组成原子个数比为1:1的化合物中含_______ (填“离子键”、“共价键”或“离子键和共价键”),将78g该化合物投入98g水中,所得溶液的质量分数为_______ 。
(4)元素②⑦⑧的最高价含氧酸的酸性最强的是_______ (填化学式),该酸与元素⑥的最高价氧化物对应的水化物反应的离子方程式是_______ 。
(5)由元素①③组成的含 和
和 的分子的电子式分别是
的分子的电子式分别是_______ 、_______ 。

(1)元素④⑤⑧的离子半径由大到小的顺序为
(2)元素⑦的原子结构示意图为
(3)由元素④⑤组成原子个数比为1:1的化合物中含
(4)元素②⑦⑧的最高价含氧酸的酸性最强的是
(5)由元素①③组成的含
 和
和 的分子的电子式分别是
的分子的电子式分别是
您最近一年使用:0次
解题方法
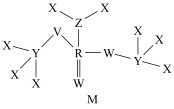
10 . X、Y、Z、W、R、V是原子序数依次增大的短周期主族元素,Y形成的一种氧化物是常见的温室气体,Z、W是空气中含量排前二的元素,W与V、Z与R均为同主族元素,六种元素形成的一种化合物M的结构如图所示。请回答下列问题:______ ;R的原子结构示意图为_______ ;Z的最简单氢化物的化学式为______ 。
(2)原子半径:Y_____ (填“>”“<”或“=”,下同)W;非金属性:V____ W;R的K层电子总数与L层电子总数之比为_____ (填最简整数比)。
(3)下列说法正确的是_______(填标号)。
(2)原子半径:Y
(3)下列说法正确的是_______(填标号)。
| A.M分子中所有原子均满足8电子稳定结构 |
| B.仅由X、Z、W元素形成的化合物可能为离子化合物 |
C.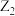 常用作保护气 常用作保护气 |
| D.R元素的氧化物对应的水化物为强酸 |
您最近一年使用:0次



