名校
解题方法
1 . X、Y、Z、M、Q、R皆为周期表中前20号元素,其原子半径与主要化合价的关系如图所。 电子式为
电子式为_________ 。
(2)比较Y和Z的简单氢化物,更稳定的是_________ (填化学式)。
(3)已知Q位于第三周期,则R在元素周期表中的位置是_________ 。
(4)下列推断正确的是_________ (填“序号”)。
a.简单离子半径: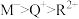
b.由X、Y、Z三种元素组成的化合物可能是盐或碱
c.Z与M的最高价氧化物对应水化物均为强酸
(5)M的单质通入淀粉-KI溶液,溶液变蓝,写出该反应的离子方程式_________ ;比较 和M的阴离子,还原性更强的是
和M的阴离子,还原性更强的是_________ (填离子符号),从原子结构的角度解释原因_________ 。
 电子式为
电子式为(2)比较Y和Z的简单氢化物,更稳定的是
(3)已知Q位于第三周期,则R在元素周期表中的位置是
(4)下列推断正确的是
a.简单离子半径:
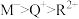
b.由X、Y、Z三种元素组成的化合物可能是盐或碱
c.Z与M的最高价氧化物对应水化物均为强酸
(5)M的单质通入淀粉-KI溶液,溶液变蓝,写出该反应的离子方程式
 和M的阴离子,还原性更强的是
和M的阴离子,还原性更强的是
您最近一年使用:0次
名校
解题方法
2 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经一百多年。元素周期表体现了元素位、构、性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题:
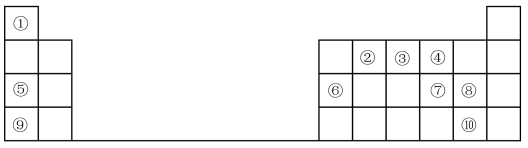
(1)元素②在周期表中的位置___________
(2)元素⑤和⑨的最高价氧化物的水化物中,碱性较强的是___________ (填化学式)。
(3)元素①与⑦可形成18电子分子,请用电子式表示该分子的形成过程:___________ 。
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是___________ (用离子符号表示),
(5)元素⑨的最高价氧化物的水化物与元素⑥的单质反应的化学方程式为:___________ 。
(6)元素的非金属性⑩___________ ⑧(填“>”或“<”);下列事实不能 证明上述结论的是___________ 。
A.元素⑧的单质与⑩的气态氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的气态氢化物的水溶液的酸性比元素⑩的弱
C.元素⑧和⑩的气态氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物的水化物的酸性比元素⑩的强
E.元素⑧的气态氢化物的还原性比元素⑩的弱

(1)元素②在周期表中的位置
(2)元素⑤和⑨的最高价氧化物的水化物中,碱性较强的是
(3)元素①与⑦可形成18电子分子,请用电子式表示该分子的形成过程:
(4)元素⑦⑧⑨的简单离子半径由大到小的顺序是
(5)元素⑨的最高价氧化物的水化物与元素⑥的单质反应的化学方程式为:
(6)元素的非金属性⑩
A.元素⑧的单质与⑩的气态氢化物的水溶液反应,溶液变为橙黄色
B.元素⑧的气态氢化物的水溶液的酸性比元素⑩的弱
C.元素⑧和⑩的气态氢化物受热分解,前者的分解温度高
D.元素⑧的最高价氧化物的水化物的酸性比元素⑩的强
E.元素⑧的气态氢化物的还原性比元素⑩的弱
您最近一年使用:0次
2024-02-13更新
|
146次组卷
|
2卷引用:安徽省淮北市第一中学2023-2024学年高一下学期开学考试 化学试卷
3 . 下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
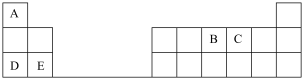
完成下列填空(填元素符号或化学式):
(1)元素C在元素周期表中的位置是__________ ,B、C、E三种元素原子半径从大到小的顺序是__________ ;
(2)D简单离子的结构示意图为______________ ,D的金属性________ E的金属性(填“大于”“小于”“等于”)。D单质在空气中燃烧可生成淡黄色粉末 ,
, 的电子式为
的电子式为___________ ,D的最高价氧化物对应的水化物中含有的化学键类型有_________ 。
(3)将 、
、 的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入
的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入 的盐酸,所加盐酸的体积与产生
的盐酸,所加盐酸的体积与产生 的体积(标准状况)关系如图所示。
的体积(标准状况)关系如图所示。
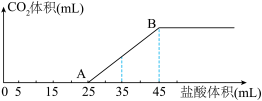
已知:逐滴将盐酸加入碳酸钠溶液中时,盐酸先与碳酸钠反应生成碳酸氢钠。
①AB段发生反应的离子方程式为____________ 。
②原固体混合物中 与
与 的物质的量之比为
的物质的量之比为____________ 。

完成下列填空(填元素符号或化学式):
(1)元素C在元素周期表中的位置是
(2)D简单离子的结构示意图为
 ,
, 的电子式为
的电子式为(3)将
 、
、 的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入
的固体混合物完全溶于水,配制成溶液,然后向该溶液中逐滴加入 的盐酸,所加盐酸的体积与产生
的盐酸,所加盐酸的体积与产生 的体积(标准状况)关系如图所示。
的体积(标准状况)关系如图所示。
已知:逐滴将盐酸加入碳酸钠溶液中时,盐酸先与碳酸钠反应生成碳酸氢钠。
①AB段发生反应的离子方程式为
②原固体混合物中
 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
名校
解题方法
4 . 1869年俄国化学家门捷列夫制出第一张 元素周期表,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。针对下表中的短周期元素,回答以下问题:______ 。
(2)①和④形成的10电子阳离子的电子式______ ,由①⑤⑧三种元素组成的具有漂白性物质的结构式______ 。
(3)⑥和⑦的最高价氧化物对应水化物之间反应的化学方程式______ 。
(4)下列能比较元素②和③金属性强弱的实验事实是(填字母)______ 。
a.在化合物中②的化合价比③的低 b.②的单质能与冷水剧烈反应而③的单质不能
c.②的最高价氧化物对应水化物的碱性比③强 d.②单质的熔点比③单质的低
(5)与第三周期主族元素的离子半径相对大小相符的曲线标号______ 。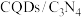 纳米复合物)能以太阳光为能源,使水分解获得
纳米复合物)能以太阳光为能源,使水分解获得 ,其原理如图所示。反应①的化学方程式是
,其原理如图所示。反应①的化学方程式是______ 。

(2)①和④形成的10电子阳离子的电子式
(3)⑥和⑦的最高价氧化物对应水化物之间反应的化学方程式
(4)下列能比较元素②和③金属性强弱的实验事实是(填字母)
a.在化合物中②的化合价比③的低 b.②的单质能与冷水剧烈反应而③的单质不能
c.②的最高价氧化物对应水化物的碱性比③强 d.②单质的熔点比③单质的低
(5)与第三周期主族元素的离子半径相对大小相符的曲线标号
a. b.
b. c.
c.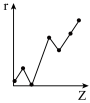 d.
d.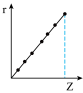
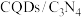 纳米复合物)能以太阳光为能源,使水分解获得
纳米复合物)能以太阳光为能源,使水分解获得 ,其原理如图所示。反应①的化学方程式是
,其原理如图所示。反应①的化学方程式是
您最近一年使用:0次
5 . 在研究前18号元素时发现,随原子序数递增可以将它们排成如图所示的蜗牛形状。图中每个点代表一种元素,其中①代表氢元素。___________ 键(填“离子”或“共价”);
(2)写出由元素①、②、③形成的化合物的电子式___________ 。
(3)Li和元素③在同一族,现代航天工业中选择用 做供氧剂的原因是
做供氧剂的原因是___________ 。
(4)元素④在元素周期表中的位置是___________ 。
(5)自然界磷元素只存在一种稳定的核素 。约里奧-居里夫妇在核反应中用α粒子轰击
。约里奧-居里夫妇在核反应中用α粒子轰击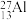 ,得到另一种核素
,得到另一种核素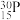 。
。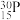 与
与 的关系是
的关系是___________ 。
(6)请设计实验验证元素④的非金属性弱于元素⑤的非金属性___________ (用离子方程式表示)。
(7)向由元素②、③、⑤按原子个数比1∶1∶1组成的化合物水溶液中滴入石蕊试液,溶液变成蓝色,一段时间后溶液颜色褪去,请解释原因___________ 。

(2)写出由元素①、②、③形成的化合物的电子式
(3)Li和元素③在同一族,现代航天工业中选择用
 做供氧剂的原因是
做供氧剂的原因是(4)元素④在元素周期表中的位置是
(5)自然界磷元素只存在一种稳定的核素
 。约里奧-居里夫妇在核反应中用α粒子轰击
。约里奧-居里夫妇在核反应中用α粒子轰击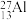 ,得到另一种核素
,得到另一种核素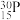 。
。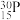 与
与 的关系是
的关系是(6)请设计实验验证元素④的非金属性弱于元素⑤的非金属性
(7)向由元素②、③、⑤按原子个数比1∶1∶1组成的化合物水溶液中滴入石蕊试液,溶液变成蓝色,一段时间后溶液颜色褪去,请解释原因
您最近一年使用:0次
解题方法
6 . 2024年是元素周期表诞生155周年,元素周期表(律)在学习、研究和生产实践中有很重要的作用。部分元素在元素周期表中的位置如图所示。请回答:
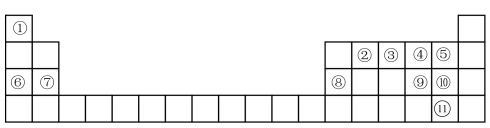
(1)元素③在周期表中的位置为______ 。
(2)元素④的一种核素的中子数是10,表示该核素的符号为_______ 。
(3)元素①和②形成的五原子分子的空间结构为________ 。
(4)⑨⑩⑪三种元素的最高价氧化物对应的水化物中,酸性最强的是_____ (填化学式)。
(5)⑤和⑦两种元素形成的化合物有重要的用途。用电子式表示该化合物的形成过程为_______ 。
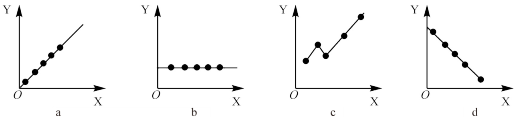
(6)下图分别表示元素的某种结构或性质与核电荷数的关系(X为核电荷数,Y为元素的有关结构或性质),下列说法正确的是________。(用选项字母表示)。

(1)元素③在周期表中的位置为
(2)元素④的一种核素的中子数是10,表示该核素的符号为
(3)元素①和②形成的五原子分子的空间结构为
(4)⑨⑩⑪三种元素的最高价氧化物对应的水化物中,酸性最强的是
(5)⑤和⑦两种元素形成的化合物有重要的用途。用电子式表示该化合物的形成过程为
(6)下图分别表示元素的某种结构或性质与核电荷数的关系(X为核电荷数,Y为元素的有关结构或性质),下列说法正确的是________。(用选项字母表示)。

| A.a图表示元素④⑤⑥⑦⑧的离子半径变化趋势 |
| B.b图表示元素⑤所在主族元素的最高化合价的变化趋势 |
C. 图表示元素①所在主族金属单质密度的变化趋势 图表示元素①所在主族金属单质密度的变化趋势 |
| D.d图表示⑥⑦⑧⑨⑩五种元素的电子层数的变化趋势 |
您最近一年使用:0次
7 . 1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年,元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。人体必需的一些元素在周期表中的分布情况如下:
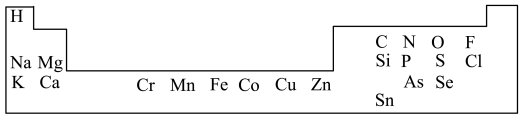
(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是______ 。 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为______ 。
(2)第三周期半径最小的简单离子为______ 。
(3)钙元素和磷元素促进了我们骨骼发育与牙齿的正常生长。从物质分类的角度看,羟基磷灰石 属于
属于______ (填“酸”、“碱”、“盐”或“氧化物”)。Ca与Mg在元素周期表同一族,化学性质相似同时也有递变性,试写出Ca与 反应的化学方程式:
反应的化学方程式:____________ 。
(4)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是______ ,原子序数为______ 。
(5)由元素C和O形成的三核直线形分子的结构式为______ 。
(6)用电子式表示元素Na和S的原子形成的化合物(该化合物含有三个原子核)的形成过程:____________ 。
(7)能比较元素S和Cl非金属性强弱的实验事实是______ (填字母)。
a. 的酸性比HCl的酸性弱
的酸性比HCl的酸性弱
b.单质 与
与 化合比单质S与
化合比单质S与 化合容易,且HCl的稳定性比
化合容易,且HCl的稳定性比 的强
的强
c.向 的水溶液中通入少量
的水溶液中通入少量 可置换出单质S
可置换出单质S

(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是
 是一种绿色氧化剂,电子式为
是一种绿色氧化剂,电子式为(2)第三周期半径最小的简单离子为
(3)钙元素和磷元素促进了我们骨骼发育与牙齿的正常生长。从物质分类的角度看,羟基磷灰石
 属于
属于 反应的化学方程式:
反应的化学方程式:(4)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se在元素周期表中的位置是
(5)由元素C和O形成的三核直线形分子的结构式为
(6)用电子式表示元素Na和S的原子形成的化合物(该化合物含有三个原子核)的形成过程:
(7)能比较元素S和Cl非金属性强弱的实验事实是
a.
 的酸性比HCl的酸性弱
的酸性比HCl的酸性弱b.单质
 与
与 化合比单质S与
化合比单质S与 化合容易,且HCl的稳定性比
化合容易,且HCl的稳定性比 的强
的强c.向
 的水溶液中通入少量
的水溶液中通入少量 可置换出单质S
可置换出单质S
您最近一年使用:0次
名校
8 . (I)如表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
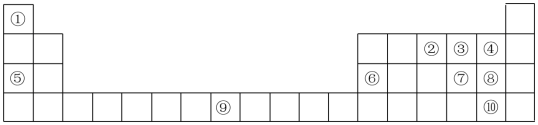
(1)元素②和④的简单氢化物反应生成化合物的电子式为_______ 。
(2)元素⑤和③的单质加热生成产物中含有的化学键类型为_______ 。
(3)元素⑨在周期表中的位置是_______ 。
(II)L、M、N、Q、R、T分别代表上述十种元素之一,其原子半径及主要化合价关系如表:
(4)写出M最高价氧化物对应的水化物与N的最高价含氧酸反应的化学方程式:_______ 。
(5)L、M、Q、R四种元素形成的简单离子半径从大到小的顺序为_______ (用相应的离子符号表示)。

(1)元素②和④的简单氢化物反应生成化合物的电子式为
(2)元素⑤和③的单质加热生成产物中含有的化学键类型为
(3)元素⑨在周期表中的位置是
(II)L、M、N、Q、R、T分别代表上述十种元素之一,其原子半径及主要化合价关系如表:
| 元素代号 | L | M | N | Q | R | T |
| 原子半径/nm | 0.186 | 0.143 | 0.099 | 0.114 | 0.104 | 0.066 |
| 主要化合价 | +1 | +3 | +7、-1 | +7、-1 | +6、-2 | -2 |
(5)L、M、Q、R四种元素形成的简单离子半径从大到小的顺序为
您最近一年使用:0次
名校
解题方法
9 . a、b、c、d、e、f为前20号主族元素,其最高正化合价或最低负化合价与原子序数的关系如图所示:
(1)e在元素周期表中的位置是_______ 。
(2)写出b的简单氢化物的电子式_______ ,f的最高价氧化物的水化物含_______ 键(填字母)。
A.离子键 B.极性非价键 C.非极性共价键
(3)d单质与c的最高价氧化物的水化物是家庭厨卫管道疏通剂的主要成分,疏通管道时发生反应的化学方程式是_______ 。
(4)①用电子式表示化合物ce的形成过程______ 。
②b、c、d元素所形成离子的半径从大到小的顺序为:_______ (用离子符号表示)。
(5)化合物fb2可与水缓慢反应,常用作鱼塘的供氧剂,同时生成一种碱,试写出其反应的化学方程式是_______ 。

(1)e在元素周期表中的位置是
(2)写出b的简单氢化物的电子式
A.离子键 B.极性非价键 C.非极性共价键
(3)d单质与c的最高价氧化物的水化物是家庭厨卫管道疏通剂的主要成分,疏通管道时发生反应的化学方程式是
(4)①用电子式表示化合物ce的形成过程
②b、c、d元素所形成离子的半径从大到小的顺序为:
(5)化合物fb2可与水缓慢反应,常用作鱼塘的供氧剂,同时生成一种碱,试写出其反应的化学方程式是
您最近一年使用:0次
2024-02-26更新
|
159次组卷
|
2卷引用:河北省石家庄市第一中学西校区2023-2024高一上学期期末考试化学试题
10 . 如下图所示,分别是前三周期主族元素原子半径与第一电离能的关系曲线。回答下列问题:
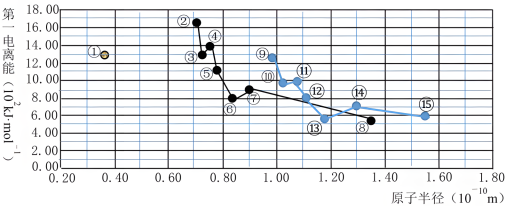
(1)图中编号为①⑥⑨的元素的元素符号分别是________ 、________ 、________ 。
(2)编号为⑮的元素原子的基态核外电子排布式为________ 。编号为⑬的元素原子的价层电子轨道表示式为________ 。元素②③⑭⑮对应的最简单离子半径由大到小的顺序为________ (用离子符号表示)。
(3)编号为⑨的元素在元素周期表中的位置为________ ,由它的原子和编号为⑮的元素的原子形成化合物的过程,用电子式可表示为________ 。
(4)由编号为①④⑤三种元素组成的一种结构式为 的物质,其中Y元素的化合价为
的物质,其中Y元素的化合价为________ 。该物质的电子式是________ 。

(1)图中编号为①⑥⑨的元素的元素符号分别是
(2)编号为⑮的元素原子的基态核外电子排布式为
(3)编号为⑨的元素在元素周期表中的位置为
(4)由编号为①④⑤三种元素组成的一种结构式为
 的物质,其中Y元素的化合价为
的物质,其中Y元素的化合价为
您最近一年使用:0次



