1 . 设 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.标准状况下,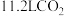 中含有的分子数为 中含有的分子数为 |
B. 与足量的硫酸反应转移的电子数为 与足量的硫酸反应转移的电子数为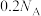 |
C. 溶液中 溶液中 数为 数为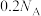 |
D.常温常压下,1.6g由氧气和臭氧组成的混合物中含有的氧原子数目为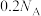 |
您最近一年使用:0次
解题方法
2 . 某500 mL的Na2SO4溶液中含9.2 g Na+,加水稀释为1 L的溶液,取出其中10 mL,则Na+物质的量浓度为
| A.0.4 mol/L | B.0.03 mol/L | C.0.2 mol/L | D.0.8 mol/L |
您最近一年使用:0次
2023-07-31更新
|
93次组卷
|
2卷引用:陕西省延安市宜川中学2020-2021学年高一上学期期末考试化学试题
3 . 将相对分子质量为M的气体化合物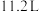 (标准状况)溶于
(标准状况)溶于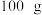 水中,得到溶质质量分数为w的溶液,物质的量浓度为
水中,得到溶质质量分数为w的溶液,物质的量浓度为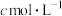 ,密度为
,密度为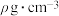 。下列说法正确的是
。下列说法正确的是
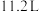 (标准状况)溶于
(标准状况)溶于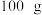 水中,得到溶质质量分数为w的溶液,物质的量浓度为
水中,得到溶质质量分数为w的溶液,物质的量浓度为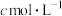 ,密度为
,密度为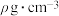 。下列说法正确的是
。下列说法正确的是A.相对分子质量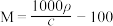 | B.溶液密度 |
C.质量分数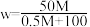 | D.物质的量浓度 |
您最近一年使用:0次
解题方法
4 . 把300ml有BaCl2和AlCl3的混合溶液分成3等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入等体积4bmol/L氢氧化钠溶液,恰好使产生的沉淀溶解。则该混合溶液中氯离子浓度为
| A.20a+3b | B.20a/3+b | C.2a+3b | D.10a+2b |
您最近一年使用:0次
解题方法
5 . 现有五种物质:①钠、②新制氯水、③FeCl3、④NaOH、⑤漂白粉,按要求回答下列问题:
(1)上述物质中属于电解质的是_______ (填序号)。
(2)将①长时间放置在潮湿的空气中,最终生成的物质是_______ (填化学式)。
(3)将0.5L 1mol/L③的溶液加水稀释至1L,所得溶液中氯离子的物质的量浓度为_______ mol/L。
(4)实验室制备物质⑤发生反应的化学方程式为_______ 。
(5)实验室欲用固体④配制1.0mol/L的NaOH溶液480mL。
i.配制溶液所需仪器除托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要的玻璃仪器是_______ 。
ii.下列操作会导致所配溶液浓度偏高的是_______ (填字母)。
A.称量所用砝码已生锈
B.溶解、转移溶液后没有洗涤烧杯和玻璃棒
C.定容时俯视
D.定容时,液面超过容量瓶颈上的刻度线,用胶头滴管将过量的液体吸出
(1)上述物质中属于电解质的是
(2)将①长时间放置在潮湿的空气中,最终生成的物质是
(3)将0.5L 1mol/L③的溶液加水稀释至1L,所得溶液中氯离子的物质的量浓度为
(4)实验室制备物质⑤发生反应的化学方程式为
(5)实验室欲用固体④配制1.0mol/L的NaOH溶液480mL。
i.配制溶液所需仪器除托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要的玻璃仪器是
ii.下列操作会导致所配溶液浓度偏高的是
A.称量所用砝码已生锈
B.溶解、转移溶液后没有洗涤烧杯和玻璃棒
C.定容时俯视
D.定容时,液面超过容量瓶颈上的刻度线,用胶头滴管将过量的液体吸出
您最近一年使用:0次
名校
6 . 设NA为阿伏伽德罗常数的值,下列说法不正确的是
| A.标准状况下,2.24 L Cl2与足量铁粉反应转移的电子数为0.2 NA |
| B.2.8 g CO和N2的混合气中,所含原子总数为0.2 NA |
C.物质的量浓度为0.5 mol·L-1Al2(SO4)3溶液中,含有SO 数目为1.5 NA 数目为1.5 NA |
| D.2.3 g Na完全与氧气反应生成氧化钠和过氧化钠,失去的电子数为0.1 NA |
您最近一年使用:0次
2023-05-04更新
|
418次组卷
|
2卷引用:陕西省西安市长安区第一中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
7 . 6.5g锌投入足量的稀硫酸溶液,充分反应,测得溶液体积为200mL。计算:
(1)标准状况下生成H2的体积___________ 。
(2)所得ZnSO4溶液溶质物质的量浓度___________ 。
(1)标准状况下生成H2的体积
(2)所得ZnSO4溶液溶质物质的量浓度
您最近一年使用:0次
2023-05-04更新
|
169次组卷
|
2卷引用:陕西省西安市长安区第一中学2022-2023学年高二上学期期末考试化学试题(文科)
名校
解题方法
8 . 请根据所学知识,回答下列问题:
I.金属及其化合物在生产生活中有着广泛的应用。
(1)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现_______ 性;_______ (填“能”或“不能”)用氢氧化钠溶液代替。
(2)将Cu与稀硫酸混合,二者不能反应,滴入 后,溶液很快变成蓝色,该反应的化学方程式为
后,溶液很快变成蓝色,该反应的化学方程式为_______ 。
(3)利用 溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀掉,从而制作印刷电路板的原理用离子方程式表示为
溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀掉,从而制作印刷电路板的原理用离子方程式表示为_______ 。
(4)在潜水艇和消防员的呼吸面具中常装有 固体,工作时所发生的化学方程式为
固体,工作时所发生的化学方程式为_______ 。
II.物质的量是学习化学的基础。
(5)19g某二价金属的氯化物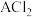 中含有
中含有 ,金属A的相对原子质量是
,金属A的相对原子质量是_______ 。
(6)现有标准状况下CO和 混合气体6.72L,其质量为10g,则此混合气体中,CO和
混合气体6.72L,其质量为10g,则此混合气体中,CO和 的物质的量之比是
的物质的量之比是_______ 。
(7)将 的氯化钡溶液与
的氯化钡溶液与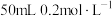 的氯化钠溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中氯离子的浓度是
的氯化钠溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中氯离子的浓度是_______ 。
I.金属及其化合物在生产生活中有着广泛的应用。
(1)胃舒平(主要成分为氢氧化铝)可用于治疗胃酸过多,氢氧化铝体现
(2)将Cu与稀硫酸混合,二者不能反应,滴入
 后,溶液很快变成蓝色,该反应的化学方程式为
后,溶液很快变成蓝色,该反应的化学方程式为(3)利用
 溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀掉,从而制作印刷电路板的原理用离子方程式表示为
溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀掉,从而制作印刷电路板的原理用离子方程式表示为(4)在潜水艇和消防员的呼吸面具中常装有
 固体,工作时所发生的化学方程式为
固体,工作时所发生的化学方程式为II.物质的量是学习化学的基础。
(5)19g某二价金属的氯化物
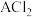 中含有
中含有 ,金属A的相对原子质量是
,金属A的相对原子质量是(6)现有标准状况下CO和
 混合气体6.72L,其质量为10g,则此混合气体中,CO和
混合气体6.72L,其质量为10g,则此混合气体中,CO和 的物质的量之比是
的物质的量之比是(7)将
 的氯化钡溶液与
的氯化钡溶液与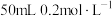 的氯化钠溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中氯离子的浓度是
的氯化钠溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中氯离子的浓度是
您最近一年使用:0次
9 . 利用氧化还原反应将废水中的有害物质转变为无毒物质、难溶物质或易挥发除去的物质,是废水处理中的重要方法之一、在酸性条件下,向含铬废水中加入FeSO4,可将 还原为Cr3+:
还原为Cr3+: +6Fe2++14H+=2Cr3++6Fe3++7H2O,再加入熟石灰进行中和,最终将Cr3+转变为Cr(OH)3沉淀而从废水中除去。请回答下列问题:
+6Fe2++14H+=2Cr3++6Fe3++7H2O,再加入熟石灰进行中和,最终将Cr3+转变为Cr(OH)3沉淀而从废水中除去。请回答下列问题:
(1)方程式中氧化剂和还原剂的物质的量之比为_______ ;
(2)熟石灰的化学式是_______ ,中和时发生反应的离子方程式为_______ ;
(3)Cr3+和熟石灰反应生成Cr(OH)3沉淀的离子反应方程式为_______ ;
(4)若处理含铬废水100mL需要0.15mol/LFeSO4溶液25ml,则此废水中铬离子浓度为____ 。
 还原为Cr3+:
还原为Cr3+: +6Fe2++14H+=2Cr3++6Fe3++7H2O,再加入熟石灰进行中和,最终将Cr3+转变为Cr(OH)3沉淀而从废水中除去。请回答下列问题:
+6Fe2++14H+=2Cr3++6Fe3++7H2O,再加入熟石灰进行中和,最终将Cr3+转变为Cr(OH)3沉淀而从废水中除去。请回答下列问题:(1)方程式中氧化剂和还原剂的物质的量之比为
(2)熟石灰的化学式是
(3)Cr3+和熟石灰反应生成Cr(OH)3沉淀的离子反应方程式为
(4)若处理含铬废水100mL需要0.15mol/LFeSO4溶液25ml,则此废水中铬离子浓度为
您最近一年使用:0次
10 . 设 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.常温常压下,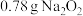 中含有 中含有 的数目为 的数目为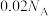 |
B.标准状况下,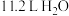 中含有的分子数为 中含有的分子数为 |
C. 的 的 溶液中含 溶液中含 的数目为 的数目为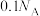 |
D.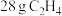 和 和 的混合气体中,含有H原子的数目为 的混合气体中,含有H原子的数目为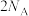 |
您最近一年使用:0次



