2010·上海宝山·二模
解题方法
1 . vmL密度为 g/cm3的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶质的质量分数为W%,物质的量浓度为cmol/L,那么下列关系式正确的是
g/cm3的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶质的质量分数为W%,物质的量浓度为cmol/L,那么下列关系式正确的是
 g/cm3的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶质的质量分数为W%,物质的量浓度为cmol/L,那么下列关系式正确的是
g/cm3的某溶液中,含有相对分子质量为M的溶质m g,该溶液中溶质的质量分数为W%,物质的量浓度为cmol/L,那么下列关系式正确的是A.c= | B.c=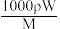 | C.W%=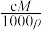 | D.m=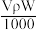 |
您最近一年使用:0次
2011·上海·零模
2 . 若NA表示阿伏加 德罗常数,下列说法正确的是( )
| A.1 mol Cl2作为氧化剂得到的电子数为NA |
| B.25℃时,l L pH=13的Ba(OH)2 溶液中含有Ba2+的数目为0.1 NA |
| C.在0℃,101kPa时,22.4L氢气中含有NA个氢原子 |
| D.在标准状况下,22.4L空气中约有NA个气体分子 |
您最近一年使用:0次
2012·上海松江·三模
3 . 在100克水中溶解了22.4LHCl(标准状况下)气体后形成的溶液,对该溶液的判断正确的是
| A.所得的溶液的体积为22.5L |
| B.该溶液物质的量浓度为10.00mol·L−1 |
| C.根据题中数据,无法求得该溶液物质的量的浓度 |
| D.该溶液中溶质的质量百分比浓度因溶液的密度未知而无法求得 |
您最近一年使用:0次
12-13高三上·上海虹口·阶段练习
解题方法
4 . 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
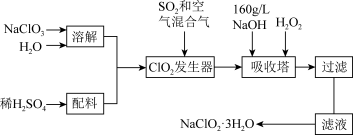
已知:① 纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全;
② NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
(1)ClO2发生器中鼓入空气的作用可能是_________ (填序号)。
a 将SO2氧化成SO3,增强酸性 b 稀释ClO2以防止爆炸 c 将NaClO3氧化成ClO2
(2)160 g/L NaOH溶液的物质的量浓度为_________ 。若要计算该溶液的质量分数,还需要的一个条件是______ (用文字说明)。
(3)吸收塔内的反应的化学方程式为__________ 。吸收塔的温度不能超过20℃,其目的是______ 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是_______ 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是_________ (填序号)。
a Na2O2 b Na2S c FeCl2 d PbO(悬浊液)
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是_________ (填序号)。
a 蒸馏 b 蒸发 c 灼烧 d 过滤 e 冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是__________________ (填操作名称)。

已知:① 纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全;
② NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
(1)ClO2发生器中鼓入空气的作用可能是
a 将SO2氧化成SO3,增强酸性 b 稀释ClO2以防止爆炸 c 将NaClO3氧化成ClO2
(2)160 g/L NaOH溶液的物质的量浓度为
(3)吸收塔内的反应的化学方程式为
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是
a Na2O2 b Na2S c FeCl2 d PbO(悬浊液)
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是
a 蒸馏 b 蒸发 c 灼烧 d 过滤 e 冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是
您最近一年使用:0次
5 . 设NA为阿伏加 德罗常数的值。下列说法正确的是( )
| A.71gCl2溶于足量水中,Cl-的数量为NA |
| B.46g乙醇中含有共价键的数量为7NA |
| C.25℃时,1LpH=2的H2SO4溶液中含H+的总数为0.02NA |
| D.标准状况下,2.24LCO2与足量Na2O2反应转移的电子数为0.1NA |
您最近一年使用:0次
2014·上海崇明·二模
解题方法
6 . NA表示阿伏加 德罗常数,下列判断正确的是( )
| A.6.8g熔融的KHSO4中含有阳离子数0.05NA |
| B.1mol冰醋酸和lmol乙醇经催化加热反应可生成H2O分子数为NA |
| C.25℃时,pH=13的Ba(OH)2溶液中含有的OH-数为0.1NA |
| D.常温常压下,17g羟基中含有的电子数为9NA |
您最近一年使用:0次
2014·上海·零模
解题方法
7 . 苯分子等芳香烃化合物里的氢原子被硫酸分子里的磺酸基(—SO3H)所取代的反应,称为磺化反应。浓硫酸有时也用SO3代替浓硫酸,其优点是____________________ 、____________________________________ 。(至少写出两点),用浓硫酸吸收SO3可得发烟硫酸(H2SO4·SO3)。某化工厂用1.5m3 98.3%的浓硫酸(密度为1.84g/mL)吸收SO3形成发烟硫酸,再与水混合,可得到95%的硫酸(密度为1.79g/mL)_____________ m3(保留2位小数)。
您最近一年使用:0次
名校
解题方法
8 . 20℃时,饱和NaCl溶液的密度为ρ g/cm3,物质的量浓度为c mol/L,则下列说法中错误的是
| A.温度低于20℃时,饱和NaCl溶液的浓度小于c mol/L |
B.20℃时,饱和NaCl溶液的质量分数为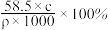 |
| C.20℃时,密度小于ρ g/cm3的NaCl溶液是不饱和溶液 |
D.20℃时,饱和NaCl溶液的溶解度 |
您最近一年使用:0次
2020-03-24更新
|
213次组卷
|
18卷引用:辽宁省沈阳市东北育才学校2019届高三上学期第三次模拟化学试题
辽宁省沈阳市东北育才学校2019届高三上学期第三次模拟化学试题2017届江西省上高二中高三上第一次月考(开学考试)化学2017届河北省衡水中学高三上期中化学卷湖北省孝感高级中学2018届高三9月摸底考试化学试题湖北省襄阳市第四中学2017-2018学年高一10月月考化学试题【全国百强校】福建省泉州第五中学2017届高三上学期期中检测化学试题(已下线)学科网2019年高考化学一轮复习讲练测1.2 物质的量浓度 测【全国百强校】重庆市巴蜀中学2019届高三上学期期中复习化学试题【市级联考】吉林省东辽市2019届高三上学期期中考试化学试题【百强校】黑龙江省牡丹江市第一高级中学2019届高三上学期期末考试化学试题河南省南阳市第一中学2020届高三上学期第一次月考化学试题辽宁省大连海湾高级中学2019-2020学年高三上学期期中考试化学试题(已下线)上海市青浦区2014届高三上学期期末考试(即一模)化学试题(已下线)【南昌新东方】2019 雷氏学校 高一上第一次月考福建省永安市第三中学2021届高三9月月考化学试题河南省南阳市第一中学2021届高三上学期第一次月考(8月)化学试题(已下线)【南昌新东方】13. 新建二中 梁莎.黑龙江省鹤岗市第一中学2020-2021学年高二下学期期末考试化学试题
2014·上海奉贤·二模
9 . 硝酸工业尾气中氮氧化物(NO 和NO2)是主要的大气污染物之一,可用氨氧混合气体进行选择性还原处理。其主要反应原理如下:4NO+4NH3+O2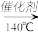 4N2+6H2O 6NO2+8NH3
4N2+6H2O 6NO2+8NH3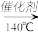 7N2+12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已换算成标准状况),其中NO NO2的物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
7N2+12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已换算成标准状况),其中NO NO2的物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
(1)尾气中氮氧化物的平均相对原子量为_____________ ;尾气中NO的含量为_____ mg/m3。
(2)要处理5m3的尾气,需要氨氧混合气的体积为_______ L。
另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积25%NaOH溶液(密度1.28g/cm3)完全吸收。
(3)NaOH溶液的物质的量浓度为_____________ mol/L,体积为_____ mL。
(4)已知反应后溶液含有0.35molNaNO2。若将尾气NO 和NO2的平均组成用NOx表示,则x=______
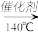 4N2+6H2O 6NO2+8NH3
4N2+6H2O 6NO2+8NH3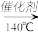 7N2+12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已换算成标准状况),其中NO NO2的物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
7N2+12H2O,某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已换算成标准状况),其中NO NO2的物质的量比为4:1。设尾气中氮氧化物与氨氧混合气恰好完全反应。(1)尾气中氮氧化物的平均相对原子量为
(2)要处理5m3的尾气,需要氨氧混合气的体积为
另一种处理氮氧化物的方法是用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体积25%NaOH溶液(密度1.28g/cm3)完全吸收。
(3)NaOH溶液的物质的量浓度为
(4)已知反应后溶液含有0.35molNaNO2。若将尾气NO 和NO2的平均组成用NOx表示,则x=
您最近一年使用:0次
解题方法
10 . 将Cl2通入100mL NaOH溶液中充分反应,生成0.1mol的NaCl,下列说法正确的是( )
| A.反应后溶液中ClO﹣的个数为0.1NA |
| B.原NaOH浓度为1mol/L |
| C.参加反应的氯气分子为0.1NA |
| D.转移电子为0.2NA |
您最近一年使用:0次



