名校
1 . 设NA为阿伏加德罗常数的值,下列说法正确的是
| A.50 mL 0.1 mol/L CH3COOH溶液和10 mL 0.5 mol/L CH3COOH溶液中所含CH3COOH分子数不相等 |
| B.一定条件下,向密闭容器中充入1 mol N2和3 mol H2充分反应,生成 NH3分子数为2NA |
| C.25 ℃时,pH=9的CH3COONa溶液中水电离出的OH-的数目为10-5NA |
| D.2 L 0.5 mol/L亚硫酸溶液中含有的H+数为2NA |
您最近一年使用:0次
名校
2 . Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3均无剩余。为中和过量的H2SO4,并使Fe元素全部转化为Fe(OH)2沉淀,消耗了200mL4.5mol·L-1的NaOH溶液,则该H2SO4的物质的量浓度为
| A.2.25mol·L-1 | B.2.00mol·L-1 | C.3.00mol·L-1 | D.0.60mol·L-1 |
您最近一年使用:0次
2023-09-06更新
|
400次组卷
|
3卷引用:四川省眉山市彭山区第一中学2023-2024学年高二上学期开学考试化学试题
3 .  表示阿伏加德罗常数的值。下列关于
表示阿伏加德罗常数的值。下列关于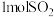 的说法错误的是
的说法错误的是
 表示阿伏加德罗常数的值。下列关于
表示阿伏加德罗常数的值。下列关于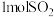 的说法错误的是
的说法错误的是A.质量为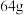 |
B.含硫原子数为 |
C.标准状况下的体积约为 |
D.溶于 水所得溶液中溶质的物质的量浓度为 水所得溶液中溶质的物质的量浓度为 |
您最近一年使用:0次
4 . 设NA为阿伏加德罗常数的值。下列说法正确的是
| A.12 g NaHSO4晶体中阴离子所带电荷数为 0.2NA |
| B.标准状况下,2.24 L CH3Cl中含有共价键的数目为0.4NA |
| C.25℃,pH=13的NaOH溶液中Na+数目为0.1NA |
| D.0.1 mol FeI2与 0.1 mol Cl2反应时转移电子的数目为0.3NA |
您最近一年使用:0次
2022-12-03更新
|
95次组卷
|
2卷引用:四川省邻水实验学校2021-2022学年高二上学期期中考试化学试题
名校
5 . 滴定实验是化学学科中重要的定量实验。请回答下列问题:
I.酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
(1)该学生的实验操作如下:
a.用碱式滴定管取稀NaOH25.00mL,注入锥形瓶中,加入甲基橙做指示剂。
b.用待测定的溶液润洗碱式滴定管。
c.用蒸馏水洗干净滴定管。
d.取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
e.检查滴定管是否漏水。
f.另取锥形瓶,再重复操作一次。
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)_______ →c→_______ →_______ →d→_______ →_______ 。
②某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
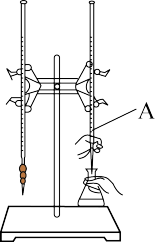
仪器A的名称是_______ ;盐酸的体积读数如下图,则用掉的盐酸体积为_______ mL;
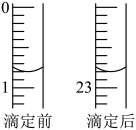
③在g操作中如何确定终点_______ 。
(2)下列操作造成测定结果偏高的是_______(填选项字母)
II.氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol/L的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
(3)滴定时,KMnO4溶液应装在_______ (“酸”或“碱”)式滴定管中,滴定终点时锥形瓶内的颜色变化是_______ 。
(4)该草酸溶液的物质的量浓度为_______ 。
I.酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液。
(1)该学生的实验操作如下:
a.用碱式滴定管取稀NaOH25.00mL,注入锥形瓶中,加入甲基橙做指示剂。
b.用待测定的溶液润洗碱式滴定管。
c.用蒸馏水洗干净滴定管。
d.取下酸式滴定管用标准的HCl溶液润洗后,将标准液注入滴定管刻度“0”以上2~3cm处,再把滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
e.检查滴定管是否漏水。
f.另取锥形瓶,再重复操作一次。
g.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写)
②某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:

仪器A的名称是

③在g操作中如何确定终点
(2)下列操作造成测定结果偏高的是_______(填选项字母)
| A.滴定终点时,俯视滴定管溶液液面 |
| B.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗 |
| C.滴定前,滴定管尖嘴有气泡,滴定后气泡消失 |
| D.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗 |
II.氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol/L的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
| 滴定次数 | 待测液体积(mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
(4)该草酸溶液的物质的量浓度为
您最近一年使用:0次
2022-11-03更新
|
58次组卷
|
2卷引用:四川省遂宁中学校2019-2020学年高二下学期第二次月考化学试题
解题方法
6 . 现有由硝酸钾、硝酸铵、硝酸镁组成的无土栽培液0.2 L,部分离子的浓度如下表所示:
(1)该混合溶液中硝酸镁的物质的量浓度为_______ ,将该混合溶液加水稀释至体积为1 L,稀释后溶液中NO 的物质的量浓度为
的物质的量浓度为_______ 。
(2)混合液中硝酸铵的物质的量为_______ ,硝酸钾的质量为_______ 。
(3)向该溶液中加入_______ mol NaOH可以使Mg2+完全沉淀,写出该反应的化学方程式_______
| 离子种类 | NH | Mg2+ | NO |
| 离子的物质的量浓度( mol·L-1) | 0.2 | 0.1 | 0.6 |
(1)该混合溶液中硝酸镁的物质的量浓度为
 的物质的量浓度为
的物质的量浓度为(2)混合液中硝酸铵的物质的量为
(3)向该溶液中加入
您最近一年使用:0次
2022高二·全国·专题练习
名校
7 . 已知某反应的各物质浓度数据如下:
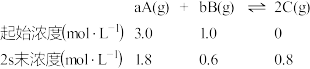
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是
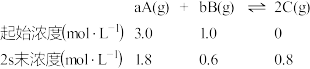
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是
| A.9∶3∶4 | B.3∶1∶2 | C.2∶1∶3 | D.3∶2∶1 |
您最近一年使用:0次
2022-09-11更新
|
544次组卷
|
3卷引用:四川省泸县第五中学2023-2024学年高二上学期10月月考化学试题
四川省泸县第五中学2023-2024学年高二上学期10月月考化学试题(已下线)第05讲 化学反应速率(word讲义)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)吉林省九台龙成实验学校2022-2023学年高二上学期第一次月考化学试题
名校
8 .  表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.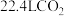 中含有 中含有 个 个 分子 分子 |
B. 的 的 水溶液中含有的氧原子数为 水溶液中含有的氧原子数为 |
C. 的 的 溶液中, 溶液中, 与 与 离子总数为 离子总数为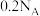 |
D. 和 和 的混合气体 的混合气体 共含有氧原子数为 共含有氧原子数为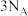 |
您最近一年使用:0次
名校
解题方法
9 . 滴定法是定量测定实验中的重要组成部分。
(1)K2Cr2O7是常用的氧化还原滴定试剂。滴定时应将K2Cr2O7溶液加入______ (填“酸式”或“碱式”)滴定管中;在规格为25 mL的滴定管中,若K2Cr2O7溶液起始读数是5.00 mL,此时滴定管中 的实际体积为
的实际体积为_____ (填序号)。
A.1.5 mL B.20 mL C.大于20 mL D.小于20 mL
(2)如图所示,排除碱式滴定管中气泡的方法应采用操作______ (填“甲”“乙”或“丙”),然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(3)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请完成下列填空:
①由NaOH固体配制0.10 mol/LNaOH标准溶液,需要的仪器有药匙、玻璃棒、____________________ (从图中选择,写出名称)。

②取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
滴定达到终点的标志是___________________________________________ 。根据上述数据,可计算出该盐酸的浓度约为_____________________ (保留两位有效数字)。
③用NaOH标准溶液滴定未知浓度的盐酸时,下列各操作中无误差的是______ (填序号)。
A.用蒸馏水洗净碱式滴定管后,注入NaOH标准溶液进行滴定
B.用蒸馏水洗涤锥形瓶后,再用待测盐酸润洗,而后装入一定体积的盐酸溶液进行滴定
C.用酸式滴定管量取10.00 mL稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和几滴酚酞后进行滴定
D.滴定完毕读数后发现滴定管尖嘴还残余1滴液体
(1)K2Cr2O7是常用的氧化还原滴定试剂。滴定时应将K2Cr2O7溶液加入
 的实际体积为
的实际体积为A.1.5 mL B.20 mL C.大于20 mL D.小于20 mL
(2)如图所示,排除碱式滴定管中气泡的方法应采用操作

(3)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验。请完成下列填空:
①由NaOH固体配制0.10 mol/LNaOH标准溶液,需要的仪器有药匙、玻璃棒、

②取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下:
| 实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
③用NaOH标准溶液滴定未知浓度的盐酸时,下列各操作中无误差的是
A.用蒸馏水洗净碱式滴定管后,注入NaOH标准溶液进行滴定
B.用蒸馏水洗涤锥形瓶后,再用待测盐酸润洗,而后装入一定体积的盐酸溶液进行滴定
C.用酸式滴定管量取10.00 mL稀盐酸放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和几滴酚酞后进行滴定
D.滴定完毕读数后发现滴定管尖嘴还残余1滴液体
您最近一年使用:0次
2021-12-02更新
|
275次组卷
|
4卷引用:四川省宜宾市第四中学校2023-2024学年高二上学期9月月考化学试题
10 . 用 表示阿伏加德罗常数的值,下列叙述不正确的是
表示阿伏加德罗常数的值,下列叙述不正确的是
 表示阿伏加德罗常数的值,下列叙述不正确的是
表示阿伏加德罗常数的值,下列叙述不正确的是A.含有 个氖原子的氖气在标准状况下的体积约为22.4L, 其电子数为 个氖原子的氖气在标准状况下的体积约为22.4L, 其电子数为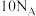 |
B.在常温常压下,11.2L 含有的分子数为 含有的分子数为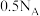 |
C.25℃, ,64g ,64g 中含有的原子数为 中含有的原子数为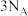 |
D.1L0.5mol/L的 溶液中所含 溶液中所含 数为 数为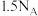 |
您最近一年使用:0次
2021-10-25更新
|
104次组卷
|
2卷引用:四川师范大学附属中学安宁校区2021-2022学年高二上学期期中考试化学试题



