名校
1 . 现有下列10种物质:①铝 ②纯醋酸 ③ ④
④ ⑤
⑤ ⑥红褐色的氢氧化铁胶体 ⑦稀盐酸 ⑧
⑥红褐色的氢氧化铁胶体 ⑦稀盐酸 ⑧ ⑨碳酸钙 ⑩乙醇
⑨碳酸钙 ⑩乙醇
(1)上述物质中能导电的是_________ ,属于电解质的有_____________ (填序号)。
(2)向⑥中逐渐滴加④的溶液,看到的现象是_______________________ 。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为 ,则该反应的化学方程式为
,则该反应的化学方程式为______________________ 。
(4)⑨和⑦混合反应离子方程式为_________ 。
(5)在一定温度下,向不同电解质溶液中加入新物质时溶液电导率( )随新物质加入体积(V)的变化曲线如图所示。分别与图A、图B曲线变化趋势对应一致的是
)随新物质加入体积(V)的变化曲线如图所示。分别与图A、图B曲线变化趋势对应一致的是_____ (填序号)。
②向饱和石灰水中不断通入
③向硝酸溶液中逐滴加入等浓度的氢氧化钾溶液至恰好完全反应
 ④
④ ⑤
⑤ ⑥红褐色的氢氧化铁胶体 ⑦稀盐酸 ⑧
⑥红褐色的氢氧化铁胶体 ⑦稀盐酸 ⑧ ⑨碳酸钙 ⑩乙醇
⑨碳酸钙 ⑩乙醇(1)上述物质中能导电的是
(2)向⑥中逐渐滴加④的溶液,看到的现象是
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为
 ,则该反应的化学方程式为
,则该反应的化学方程式为(4)⑨和⑦混合反应离子方程式为
(5)在一定温度下,向不同电解质溶液中加入新物质时溶液电导率(
 )随新物质加入体积(V)的变化曲线如图所示。分别与图A、图B曲线变化趋势对应一致的是
)随新物质加入体积(V)的变化曲线如图所示。分别与图A、图B曲线变化趋势对应一致的是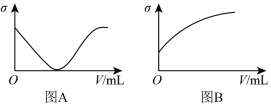
②向饱和石灰水中不断通入

③向硝酸溶液中逐滴加入等浓度的氢氧化钾溶液至恰好完全反应
您最近一年使用:0次
名校
解题方法
2 . 实验室以锈蚀程度很大的废铁屑为原料制备 晶体的流程如下:
晶体的流程如下: 能与
能与 反应生成蓝色沉淀
反应生成蓝色沉淀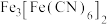 。回答下列问题:
。回答下列问题:
(1)“酸溶”过程中发生的主要反应有:① ;
;
②___________ (用离子方程式表示)
③___________ (用离子方程式表示)
(2)“酸溶”需控制温度在 左右,最佳的加热方式为
左右,最佳的加热方式为___________ 。
(3)“过滤”需要的玻璃仪器除烧杯外还有___________ 。
(4)“氧化”过程可在下图所示装置中进行。___________ 。
②装置 中发生的反应离子方程式为
中发生的反应离子方程式为___________ 。
③B中使用多孔球泡的作用是___________ 。
④证明装置 溶液中
溶液中 已完全被氧化成
已完全被氧化成 的实验方案是
的实验方案是___________ 。
 晶体的流程如下:
晶体的流程如下:
 能与
能与 反应生成蓝色沉淀
反应生成蓝色沉淀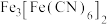 。回答下列问题:
。回答下列问题:(1)“酸溶”过程中发生的主要反应有:①
 ;
;②
③
(2)“酸溶”需控制温度在
 左右,最佳的加热方式为
左右,最佳的加热方式为(3)“过滤”需要的玻璃仪器除烧杯外还有
(4)“氧化”过程可在下图所示装置中进行。
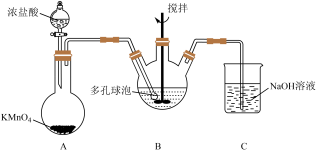
②装置
 中发生的反应离子方程式为
中发生的反应离子方程式为③B中使用多孔球泡的作用是
④证明装置
 溶液中
溶液中 已完全被氧化成
已完全被氧化成 的实验方案是
的实验方案是
您最近一年使用:0次
名校
解题方法
3 . 下列表示对应化学反应的离子方程式正确的是
A.将 通入 通入 溶液: 溶液: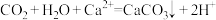 |
B.往氢氧化钠溶液中通入过量 : : |
C.向氢氧化亚铁中加入足量的稀硝酸: |
D.向 溶液中滴加 溶液中滴加 溶液至中性: 溶液至中性: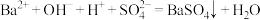 |
您最近一年使用:0次
解题方法
4 . 下列离子方程式正确的是
A.钠与水反应: |
B. 溶液和过量澄清石灰水混合: 溶液和过量澄清石灰水混合: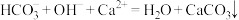 |
C.氯化铁溶液与碘化钾溶液反应: |
D.氯化镁溶液与氨水反应: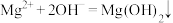 |
您最近一年使用:0次
5 . 几种主族元素在周期表中的位置如图
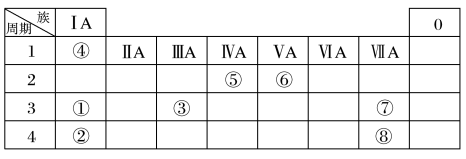
根据上表回答下列问题:
(1)写出⑤和⑧两种元素的名称:___________ 、___________ 。
(2)①和⑦两种元素的形成化合物的电子式是___________ 。
(3)①③⑦三种元素离子半径由大到小的顺序是___________ (用元素符号表示)。
(4)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为___________ ,该元素在周期表中的位置是 ___________ 。
(5)②与③最高价氧化物对应水化物反应的离子方程式为___________ 。
(6)⑦的非金属性强于⑧,下列表述中能证明这一事实的是___________ (填字母)。
a.⑦的氢化物比⑧的氢化物稳定
b.⑦氧化物对应的水化物的酸性强于⑧氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱

根据上表回答下列问题:
(1)写出⑤和⑧两种元素的名称:
(2)①和⑦两种元素的形成化合物的电子式是
(3)①③⑦三种元素离子半径由大到小的顺序是
(4)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为
(5)②与③最高价氧化物对应水化物反应的离子方程式为
(6)⑦的非金属性强于⑧,下列表述中能证明这一事实的是
a.⑦的氢化物比⑧的氢化物稳定
b.⑦氧化物对应的水化物的酸性强于⑧氧化物对应的水化物的酸性
c.⑦的单质能将⑧从其钠盐溶液中置换出来
d.⑦的氢化物酸性比⑧的氢化物酸性弱
您最近一年使用:0次
解题方法
6 . 铅(Pb)元素的主要化合价有+2价和+4价,溶液中铅为+2价(Pb2+或 ,铅单质及其化合物在日常生活和工业生产中具有非常广泛的用途。
,铅单质及其化合物在日常生活和工业生产中具有非常广泛的用途。
(1)Pb3O4 俗名红丹,在涂料工业中用作防锈颜料,Pb3O4中+2价铅和+4价铅的原子个数之比为
(2)Pb、PbO2可用于制造铅蓄电池,铅蓄电池工作时的反应方程式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,该反应中还原产物为
(3)工业上利用铅渣(主要成分是PbO、Pb,以及少量不溶于硝酸的杂质)生产PbSO4的流程如图:
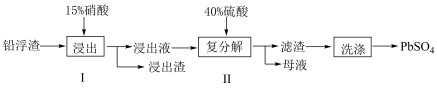
已知步骤1有NO产生,试写出Pb与硝酸反应的化学方程式
(4)血铅是指血液中铅元素的含量。血铅超标会引起机体的神经系统、血液系统、消化系统的一系列异常表现。某人血液中铅的浓度为0.4μg/mL,若转化为物质的量浓度为
您最近一年使用:0次
7 . 某工厂以镍废渣(主要成分为Ni含少量Fe、Fe3O4、Al2O3和不溶性杂质等)为原料制备翠矾(NiSO4•7H2O),其生产工艺如图:
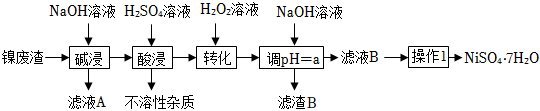
该流程中几种金属离子生成对应氢氧化物沉淀的pH如表:
回答下列问题:
(1)配制NaOH溶液时,下列操作导致溶液浓度偏高的是 ___________。
(2)“滤液A”中主要溶质的化学式为 ___________ 。
(3)“转化”过程中加入H2O2的目的是___________ ,该过程用离子方程式表示为 ___________ ;“转化”过程中温度不宜过高,原因是 ___________ 。
(4)调节pH=a,则a的取值范围是___________ 。证明杂质离子已经被完全除去的实验操作及现象是:取少量滤液B于试管中,___________ 。
(5)“操作1”的具体操作是控制pH、蒸发浓缩、冷却结晶、___________ 、___________ 、干燥。
(6)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH.写出该反应的离子方程式___________ 。

该流程中几种金属离子生成对应氢氧化物沉淀的pH如表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 2.7 | 3.7 |
| Fe2+ | 7.6 | 9.7 |
| Ni2+ | 7.1 | 9.2 |
(1)配制NaOH溶液时,下列操作导致溶液浓度偏高的是 ___________。
| A.容量瓶用蒸馏水洗净之后未干燥,直接用于溶液的配制 |
| B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 |
| C.摇匀后,发现液面低于刻度线,又滴加蒸馏水至与刻度线相切 |
| D.定容时,俯视刻度线 |
(3)“转化”过程中加入H2O2的目的是
(4)调节pH=a,则a的取值范围是
(5)“操作1”的具体操作是控制pH、蒸发浓缩、冷却结晶、
(6)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH.写出该反应的离子方程式
您最近一年使用:0次
8 . 利用分类法研究化学物质可系统、全面认识物质的性质。
Ⅰ.下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO
②HCl、H2O、H2SO4、HNO3
③NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式):
①________ ;②________ ;③________ 。
(2)这三种物质相互作用可生成一种新物质NaHCO3,该反应________ (填“是”或“不是”)氧化还原反应。
(3)写出Cu(OH)2与稀硫酸反应的离子方程式:________________ 。
Ⅱ.现有以下物质:①NaCl晶体;②液态HCl;③熔融KCl;④蔗糖;⑤铜;⑥CO2;⑦H2SO4;⑧KOH固体
(4)以上物质中能导电的是________ 。
(5)以上物质中属于电解质的是________ ,属于非电解质的是________ 。
(6)以上物质中,溶于水能导电的物质是________ 。
Ⅰ.下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO
②HCl、H2O、H2SO4、HNO3
③NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式):
①
(2)这三种物质相互作用可生成一种新物质NaHCO3,该反应
(3)写出Cu(OH)2与稀硫酸反应的离子方程式:
Ⅱ.现有以下物质:①NaCl晶体;②液态HCl;③熔融KCl;④蔗糖;⑤铜;⑥CO2;⑦H2SO4;⑧KOH固体
(4)以上物质中能导电的是
(5)以上物质中属于电解质的是
(6)以上物质中,溶于水能导电的物质是
您最近一年使用:0次
名校
解题方法
9 . 实验小组探究 溶液与KI溶液的反应及其速率,实验过程和现象如表。
溶液与KI溶液的反应及其速率,实验过程和现象如表。
已知:ⅰ. 具有强氧化性,能完全电离,
具有强氧化性,能完全电离, 易被还原为
易被还原为 ;
;
ⅱ.淀粉检测 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝;
即可快速变蓝;
ⅲ. 与
与 发生反应:
发生反应: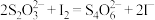
(1)实验1-1的目的是___________ ;
(2)实验1-2中 与KI反应的离子方程式为
与KI反应的离子方程式为___________ ;
为了探究 与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,实验结果如下表
与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,实验结果如下表
(3)加入 溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
猜想1: 先与
先与 反应,使
反应,使 降低;
降低;
猜想2: 先与KI反应,___________。
先与KI反应,___________。
①甲同学提出猜想1的依据:由信息ⅲ推测, 的还原性
的还原性___________ (填“强于”或“弱于”)KI的;
②乙同学根据现有数据证明猜想1不成立,理由是实验2-2与 完全反应后的溶液中
完全反应后的溶液中
___________ 2-1中起始 ,溶液应立即变蓝(填“高于”或“低于”);
,溶液应立即变蓝(填“高于”或“低于”);
③补全猜想2:___________ ;
(4)查阅文献表明猜想2成立。根据实验2-2的数据,计算30s内的平均反应速率
___________  (列出计算式);
(列出计算式);
(5)实验2-2中,30s内未检测到 与
与 反应,可能的原因是
反应,可能的原因是___________ (写出两条)。
 溶液与KI溶液的反应及其速率,实验过程和现象如表。
溶液与KI溶液的反应及其速率,实验过程和现象如表。已知:ⅰ.
 具有强氧化性,能完全电离,
具有强氧化性,能完全电离, 易被还原为
易被还原为 ;
;ⅱ.淀粉检测
 的灵敏度很高,遇低浓度的
的灵敏度很高,遇低浓度的 即可快速变蓝;
即可快速变蓝;ⅲ.
 与
与 发生反应:
发生反应:
| 编号 | 1-1 | 1-2 |
| 实验操作 |  |  |
| 现象 | 无明显现象 | 溶液立即变蓝 |
(1)实验1-1的目的是
(2)实验1-2中
 与KI反应的离子方程式为
与KI反应的离子方程式为为了探究
 与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,实验结果如下表
与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,实验结果如下表| 编号 |  KI溶液/mL KI溶液/mL |   溶液/mL 溶液/mL | 蒸馏水/mL | 0.4%淀粉溶液/滴 |   溶液/mL 溶液/mL | 变色时间/s |
| 2-1 | 2 | 0 | 2.8 | 2 | 0.2 | 立即 |
| 2-2 | 2 | 0.8 | 0.2 | 2 | 2 | 30 |
(3)加入
 溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。猜想1:
 先与
先与 反应,使
反应,使 降低;
降低;猜想2:
 先与KI反应,___________。
先与KI反应,___________。①甲同学提出猜想1的依据:由信息ⅲ推测,
 的还原性
的还原性②乙同学根据现有数据证明猜想1不成立,理由是实验2-2与
 完全反应后的溶液中
完全反应后的溶液中
 ,溶液应立即变蓝(填“高于”或“低于”);
,溶液应立即变蓝(填“高于”或“低于”);③补全猜想2:
(4)查阅文献表明猜想2成立。根据实验2-2的数据,计算30s内的平均反应速率

 (列出计算式);
(列出计算式);(5)实验2-2中,30s内未检测到
 与
与 反应,可能的原因是
反应,可能的原因是
您最近一年使用:0次
解题方法
10 . 将浓度均为 的
的 、
、 、
、 、
、 溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
资料:该“碘钟实验”的总反应为 。反应分A、B两步进行。
。反应分A、B两步进行。
反应A: ;
;
反应B:……
(1)反应B的离子方程式是___________ 。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的 溶液中加入
溶液中加入 溶液和试剂X,溶液变为蓝色。
溶液和试剂X,溶液变为蓝色。
b.再向得到的蓝色溶液中加入 溶液,溶液的蓝色褪去。
溶液,溶液的蓝色褪去。
试剂X是___________ 。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ(溶液浓度均为 )
)
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是 ,实验Ⅲ是
,实验Ⅲ是 。
。
①实验Ⅲ中x、y、z,所对应的数值分别是___________ 、___________ 、___________ 。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是___________ 。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验IV。(溶液浓度均为 )
)
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验IV未产生颜色变化的原因:___________ 。
 的
的 、
、 、
、 、
、 溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。资料:该“碘钟实验”的总反应为
 。反应分A、B两步进行。
。反应分A、B两步进行。反应A:
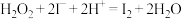 ;
;反应B:……
(1)反应B的离子方程式是
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的
 溶液中加入
溶液中加入 溶液和试剂X,溶液变为蓝色。
溶液和试剂X,溶液变为蓝色。b.再向得到的蓝色溶液中加入
 溶液,溶液的蓝色褪去。
溶液,溶液的蓝色褪去。试剂X是
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ(溶液浓度均为
 )
)| 用量/mL 实验序号 |  溶液 溶液 |  溶液 溶液 |  溶液 溶液 | KI溶液 (含淀粉) |  |
| 实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
| 实验Ⅲ | 5 | 2 |  |  |  |
 ,实验Ⅲ是
,实验Ⅲ是 。
。①实验Ⅲ中x、y、z,所对应的数值分别是
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是
(4)为探究其他因素对该“碘钟实验”的影响,进行实验IV。(溶液浓度均为
 )
)| 用量/mL 实验序号 |  溶液 溶液 |  溶液 溶液 |  溶液 溶液 | KI溶液(含淀粉) |  |
| 实脸IV | 4 | 4 | 9 | 3 | 0 |
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验IV未产生颜色变化的原因:
您最近一年使用:0次



