1 . 三氯化六氨合钴(Ⅲ) 是制备其它三价钴配合物的重要试剂。实验室制备
是制备其它三价钴配合物的重要试剂。实验室制备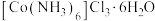 的装置如图所示,具体步骤如下:
的装置如图所示,具体步骤如下: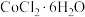 和
和 溶解后转入三颈烧瓶中,加入活性炭作催化剂和吸附剂。
溶解后转入三颈烧瓶中,加入活性炭作催化剂和吸附剂。
II.向三颈烧瓶中滴加过量氨水,充分反应后,搅拌下逐滴加入 溶液,水浴加热至50~60℃充分反应,生成的
溶液,水浴加热至50~60℃充分反应,生成的 吸附在活性炭上。
吸附在活性炭上。
III.经过“一系列”操作,得到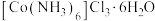 晶体。
晶体。
已知:① 不易被氧化,
不易被氧化, 具有强氧化性;
具有强氧化性; 具有较强还原性,
具有较强还原性, 性质稳定。
性质稳定。
②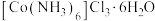 在水中的溶解度随温度的升高而增大,加入浓盐酸有利于
在水中的溶解度随温度的升高而增大,加入浓盐酸有利于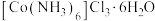 晶体析出。
晶体析出。
回答下列问题:
(1)步骤I中“溶解”需要的主要玻璃仪器为___________ , 有利于步骤II中
有利于步骤II中 与
与 的配位反应,其原理是
的配位反应,其原理是___________ 。
(2)步骤II中加入 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为___________ ,向三颈烧瓶中先滴加氨水后滴加 溶液的原因是
溶液的原因是___________ 。
(3)稀盐酸可将吸附在活性炭上的 溶解。请补充完整步骤III的“一系列”操作:将三颈烧瓶中所得混合物过滤,向滤渣中加入
溶解。请补充完整步骤III的“一系列”操作:将三颈烧瓶中所得混合物过滤,向滤渣中加入___________ 溶解,趁热过滤,冷却后向滤液中加入少量___________ ,边加边搅拌,充分静置后过滤,用___________ 洗涤2~3次,低温干燥。(可选用试剂:稀盐酸、浓盐酸、无水乙醇)
(4)测定产品中钴的含量,进行如下实验:
称取3.5400g产品,加入足量 溶液蒸出
溶液蒸出 ,再加入稀硫酸,将
,再加入稀硫酸,将 全部转化为
全部转化为 ,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入指示剂和过量的
,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入指示剂和过量的 溶液,用
溶液,用
 标准溶液滴定至终点,消耗标准溶液12.00mL。加入的指示剂为
标准溶液滴定至终点,消耗标准溶液12.00mL。加入的指示剂为___________ ,产品中钴元素的质量分数为___________ 。(已知: 、
、 )
)
 是制备其它三价钴配合物的重要试剂。实验室制备
是制备其它三价钴配合物的重要试剂。实验室制备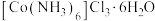 的装置如图所示,具体步骤如下:
的装置如图所示,具体步骤如下: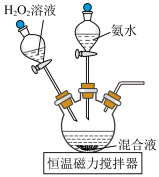
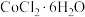 和
和 溶解后转入三颈烧瓶中,加入活性炭作催化剂和吸附剂。
溶解后转入三颈烧瓶中,加入活性炭作催化剂和吸附剂。II.向三颈烧瓶中滴加过量氨水,充分反应后,搅拌下逐滴加入
 溶液,水浴加热至50~60℃充分反应,生成的
溶液,水浴加热至50~60℃充分反应,生成的 吸附在活性炭上。
吸附在活性炭上。III.经过“一系列”操作,得到
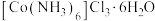 晶体。
晶体。已知:①
 不易被氧化,
不易被氧化, 具有强氧化性;
具有强氧化性; 具有较强还原性,
具有较强还原性, 性质稳定。
性质稳定。②
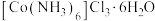 在水中的溶解度随温度的升高而增大,加入浓盐酸有利于
在水中的溶解度随温度的升高而增大,加入浓盐酸有利于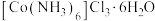 晶体析出。
晶体析出。回答下列问题:
(1)步骤I中“溶解”需要的主要玻璃仪器为
 有利于步骤II中
有利于步骤II中 与
与 的配位反应,其原理是
的配位反应,其原理是(2)步骤II中加入
 溶液时发生反应的离子方程式为
溶液时发生反应的离子方程式为 溶液的原因是
溶液的原因是(3)稀盐酸可将吸附在活性炭上的
 溶解。请补充完整步骤III的“一系列”操作:将三颈烧瓶中所得混合物过滤,向滤渣中加入
溶解。请补充完整步骤III的“一系列”操作:将三颈烧瓶中所得混合物过滤,向滤渣中加入(4)测定产品中钴的含量,进行如下实验:
称取3.5400g产品,加入足量
 溶液蒸出
溶液蒸出 ,再加入稀硫酸,将
,再加入稀硫酸,将 全部转化为
全部转化为 ,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入指示剂和过量的
,然后将溶液配制成250mL,取25.00mL于锥形瓶中,加入指示剂和过量的 溶液,用
溶液,用
 标准溶液滴定至终点,消耗标准溶液12.00mL。加入的指示剂为
标准溶液滴定至终点,消耗标准溶液12.00mL。加入的指示剂为 、
、 )
)
您最近一年使用:0次
名校
解题方法
2 . 下列物质性质实验对应的离子方程式书写正确的是
A.漂白粉溶液吸收 后产生白色沉淀: 后产生白色沉淀: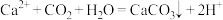 |
B. 溶于氢碘酸: 溶于氢碘酸: |
C. 溶液与稀硫酸反应: 溶液与稀硫酸反应: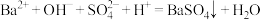 |
D.用 溶液处理锅炉水垢: 溶液处理锅炉水垢: |
您最近一年使用:0次
名校
3 . 同学们测定和探究影响反应速率的因素,设计了如下系列实验。
I.某小组利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计如下实验(忽略溶液混合过程中的体积变化):
(1) 和稀硫酸反应的离子方程式为
和稀硫酸反应的离子方程式为___________ 。
(2)其他条件不变时,探究温度对化学反应速率的影响,应选择实验___________ (填实验编号)
(3)通过对比实验a和c,可探究___________ 对反应速率的影响。该小组发现实验c存在不科学性,请提出对实验c的改进方案___________ 。
Ⅱ.某同学用等质量的锌粉先后与过量1mol⋅L-1的盐酸和同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出气体的体积随反应时间的变化曲线图(如图所示)。___________ 1mol·L-1(填“>”“=”或“<”),若用1mol·L-1硫酸代替上述实验中的1mol·L-1盐酸,二者的反应速率___________ 相同(填“是”或“不”)。
(5)为控制反应速率,防止因反应过快而难以测量 体积,且不改变生成
体积,且不改变生成 的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是___________。
的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是___________。
I.某小组利用控制变量法探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计如下实验(忽略溶液混合过程中的体积变化):
| 实验编号 | T/K |  溶液 溶液 | 稀 溶液 溶液 | ||
| c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
| a | 298 | 0.1 | 10 | 0.2 | 10 |
| b | 323 | 0.1 | 10 | 0.2 | 10 |
| c | 298 | 0.1 | 10 | 0.2 | 5 |
(1)
 和稀硫酸反应的离子方程式为
和稀硫酸反应的离子方程式为(2)其他条件不变时,探究温度对化学反应速率的影响,应选择实验
(3)通过对比实验a和c,可探究
Ⅱ.某同学用等质量的锌粉先后与过量1mol⋅L-1的盐酸和同体积、未知浓度的盐酸反应,记录相关数据,并作出这两个反应过程中放出气体的体积随反应时间的变化曲线图(如图所示)。

(5)为控制反应速率,防止因反应过快而难以测量
 体积,且不改变生成
体积,且不改变生成 的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是___________。
的量,事先在盐酸中加入等体积的下列溶液以减慢反应速率。下列试剂中,不可行的是___________。| A.蒸馏水 | B.KCl溶液 | C. 溶液 溶液 | D. 溶液 溶液 |
您最近一年使用:0次
真题
解题方法
4 . 对于下列过程中发生的化学反应,相应离子方程式正确的是
A.试管壁上的银镜用稀硝酸清洗: |
B.工业废水中的 用 用 去除: 去除: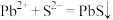 |
C.海水提溴过程中将溴吹入 吸收塔: 吸收塔: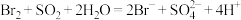 |
D.用草酸标准溶液测定高锰酸钾溶液的浓度: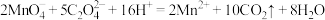 |
您最近一年使用:0次
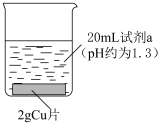
5 . 某研究性学习小组为探究含 的盐溶液与
的盐溶液与 的反应,设计并进行了如下实验。
的反应,设计并进行了如下实验。
已知:ⅰ. 、
、 是难溶于水的白色固体;
是难溶于水的白色固体;
ⅱ.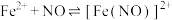 (棕色)。
(棕色)。
(1)Ⅰ、Ⅱ、Ⅲ溶液 均约为1.3,溶液显酸性且
均约为1.3,溶液显酸性且 相近的原因
相近的原因________ 。
(2)小组同学取 实验Ⅰ中反应2天后的溶液于试管中,加入2滴
实验Ⅰ中反应2天后的溶液于试管中,加入2滴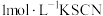 溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中
溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中 可能已反应完,
可能已反应完, 可能在该条件下被
可能在该条件下被 氧化。并通过实验证实了其猜想,其实验方案是:向
氧化。并通过实验证实了其猜想,其实验方案是:向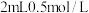
________ (填化学式)和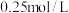
________ 的混合溶液中,加入2滴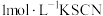 溶液,观察实验现象。该条件下
溶液,观察实验现象。该条件下 能被
能被 氧化的原因可能是
氧化的原因可能是 增强了
增强了 的
的________ 。
(3)实验Ⅱ中 片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体
片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体 的离子方程式为
的离子方程式为________ ,白色固体消失的离子方程式为________ ,由此对比实验Ⅰ和实验Ⅱ,推测 在实验Ⅱ中的作用是
在实验Ⅱ中的作用是________ 。产生大量红褐色沉淀的原因是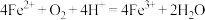 ,导致
,导致 、
、 增大,形成
增大,形成 沉淀。
沉淀。
(4)实验Ⅲ所得溶液的颜色不是蓝色,小组同学猜测反应中生成了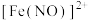 ,设计并实施了以下实验,验证了其猜想。
,设计并实施了以下实验,验证了其猜想。
综合以上实验, 盐溶液与
盐溶液与 反应的多样性与阴离子种类、生成物存在形式等有关。
反应的多样性与阴离子种类、生成物存在形式等有关。
 的盐溶液与
的盐溶液与 的反应,设计并进行了如下实验。
的反应,设计并进行了如下实验。实验装置 | 序号 | 试剂 | 实验现象 |
| Ⅰ | 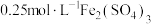 溶液 溶液 | 溶液逐渐变为蓝色。2天后, 片有较大量剩余,溶液仍为蓝色 片有较大量剩余,溶液仍为蓝色 |
Ⅱ | 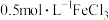 溶液 溶液 | 溶液逐渐变为蓝绿色,铜片表面覆盖有白色固体(经检验为 )。2天后,白色固体消失, )。2天后,白色固体消失, 片无剩余,溶液中产生大量红褐色沉淀 片无剩余,溶液中产生大量红褐色沉淀 | |
Ⅲ | 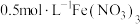 溶液 溶液 | 溶液逐渐变为绿色,实验过程中未见气泡产生。2天后, 片少量剩余,溶液中产生大量红褐色沉淀 片少量剩余,溶液中产生大量红褐色沉淀 |
 、
、 是难溶于水的白色固体;
是难溶于水的白色固体;ⅱ.
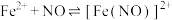 (棕色)。
(棕色)。(1)Ⅰ、Ⅱ、Ⅲ溶液
 均约为1.3,溶液显酸性且
均约为1.3,溶液显酸性且 相近的原因
相近的原因(2)小组同学取
 实验Ⅰ中反应2天后的溶液于试管中,加入2滴
实验Ⅰ中反应2天后的溶液于试管中,加入2滴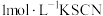 溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中
溶液,观察到溶液迅速变红,产生大量白色沉淀。甲同学猜想:实验Ⅰ原溶液中 可能已反应完,
可能已反应完, 可能在该条件下被
可能在该条件下被 氧化。并通过实验证实了其猜想,其实验方案是:向
氧化。并通过实验证实了其猜想,其实验方案是:向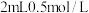
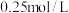
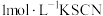 溶液,观察实验现象。该条件下
溶液,观察实验现象。该条件下 能被
能被 氧化的原因可能是
氧化的原因可能是 增强了
增强了 的
的(3)实验Ⅱ中
 片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体
片无剩余,说明实验Ⅱ反应比实验Ⅰ快,实验Ⅱ中产生白色固体 的离子方程式为
的离子方程式为 在实验Ⅱ中的作用是
在实验Ⅱ中的作用是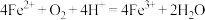 ,导致
,导致 、
、 增大,形成
增大,形成 沉淀。
沉淀。(4)实验Ⅲ所得溶液的颜色不是蓝色,小组同学猜测反应中生成了
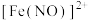 ,设计并实施了以下实验,验证了其猜想。
,设计并实施了以下实验,验证了其猜想。步骤 | 实验操作 | 实验现象 |
① | 向盛有 金属 金属 片的烧杯中加入 片的烧杯中加入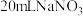 与 与 的混合溶液[ 的混合溶液[ 与约为1.3、 与约为1.3、 ] ] | 2天后溶液颜色无明显变化,铜片表面有细小气泡附着 |
② | 继续加入少量 | 溶液迅速变为浅棕色 |
 盐溶液与
盐溶液与 反应的多样性与阴离子种类、生成物存在形式等有关。
反应的多样性与阴离子种类、生成物存在形式等有关。
您最近一年使用:0次
名校
解题方法
6 . 下列离子方程式书写正确的是
A.乙酰胺与盐酸混合共热:CH3CONH2+H2O+H+ CH3COOH+NH CH3COOH+NH |
| B.向硝酸银溶液中滴入少量氨水:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O |
C.向Na2S2O3溶液中加入足量稀硝酸:S2O +2H+=S↓+SO2↑+H2O +2H+=S↓+SO2↑+H2O |
D.一定条件下,由乳酸[CH3CH(OH)COOH]合成聚乳酸的化学方程式: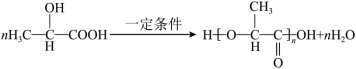 |
您最近一年使用:0次
名校
7 . 下列表达不正确 的是
A.用FeCl3溶液清洗银镜: |
B.氢氧化亚铁露置在空气中变为红褐色: |
C.碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀: |
D.向K2Cr2O7溶液中滴加少量硫酸,溶液橙色加深: |
您最近一年使用:0次
名校
解题方法
8 . 下列反应式与所述事实相符且正确的是
A.用氨水吸收烟气中的二氧化硫: |
B.在 和 和 混合溶液中加入少量的Fe: 混合溶液中加入少量的Fe: |
C.NaClO溶液与浓盐酸混合: |
D.明矾与纯碱混合: |
您最近一年使用:0次
名校
9 . 三氯化铬是常用的媒染剂和催化剂,易潮解,易升华,高温下易被氧气氧化。实验室用Cr2O3和CCl4(沸点76.8℃)在高温下制备无水CrCl3,同时生成COCl2气体。可利用下面装置模拟制取三氯化铬(K1、K2为气流控制开关)
已知:① 气体有毒,遇水发生水解产生两种酸性气体。②碱性条件下,
气体有毒,遇水发生水解产生两种酸性气体。②碱性条件下, 可将
可将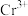 氧化为
氧化为 (黄色):酸性条件下,
(黄色):酸性条件下, 将
将 (橙色)还原为
(橙色)还原为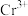 (绿色)。
(绿色)。
(1)实验装置合理的连接顺序为a-h-i-______ (填仪器接口字母标号)。
(2)步骤如下:
i.连接装置,检查装置气密性,装入药品并通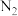 ;
;
ii.加热反应管至400℃;
iii.控制开关,加热 ,温度保持在50℃~60℃之间;
,温度保持在50℃~60℃之间;
iv.加热石英管继续升温至650℃,直到E中反应基本完成,切断管式炉的电源;
v.停止A装置水浴加热,……;
vi.装置冷却后,结束制备实验。
①步骤i中,开关 、
、 的状态分别为
的状态分别为______ 。
②补全步骤v的操作:______ ,其目的是______ 。
(3)从安全的角度考虑,整套装置的不足是______ 。
(4)装置D中反应的离子方程式为______ 。
(5)测定产品中CrCl3质量分数的实验步骤如下:
Ⅰ.取5g CrCl3产品,在强碱性条件下,加入过量的30% H2O2溶液,小火加热使CrCl3完全转化为 ,继续加热一段时间;
,继续加热一段时间;
Ⅱ.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使 转化为
转化为 ,再加适量的蒸馏水将溶液稀释至100mL;
,再加适量的蒸馏水将溶液稀释至100mL;
Ⅲ.取25.00mL溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的1.000mol/L的(NH4)2Fe(SO4)2标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗(NH4)2Fe(SO4)2标准溶液21.00mL。
①该样品中CrCl3的质量分数为______ %(保留小数点后两位,Mr(CrCl3)=158.5)
②下列操作将导致产品中CrCl3质量分数测定值偏低的是______ (填标号)。
A.步骤Ⅰ中未继续加热一段时间 B.步骤Ⅲ中所用(NH4)2Fe(SO4)2溶液已变质
C.步骤 Ⅱ中未加浓磷酸 D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视


已知:①
 气体有毒,遇水发生水解产生两种酸性气体。②碱性条件下,
气体有毒,遇水发生水解产生两种酸性气体。②碱性条件下, 可将
可将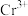 氧化为
氧化为 (黄色):酸性条件下,
(黄色):酸性条件下, 将
将 (橙色)还原为
(橙色)还原为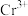 (绿色)。
(绿色)。(1)实验装置合理的连接顺序为a-h-i-
(2)步骤如下:
i.连接装置,检查装置气密性,装入药品并通
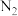 ;
;ii.加热反应管至400℃;
iii.控制开关,加热
 ,温度保持在50℃~60℃之间;
,温度保持在50℃~60℃之间;iv.加热石英管继续升温至650℃,直到E中反应基本完成,切断管式炉的电源;
v.停止A装置水浴加热,……;
vi.装置冷却后,结束制备实验。
①步骤i中,开关
 、
、 的状态分别为
的状态分别为②补全步骤v的操作:
(3)从安全的角度考虑,整套装置的不足是
(4)装置D中反应的离子方程式为
(5)测定产品中CrCl3质量分数的实验步骤如下:
Ⅰ.取5g CrCl3产品,在强碱性条件下,加入过量的30% H2O2溶液,小火加热使CrCl3完全转化为
 ,继续加热一段时间;
,继续加热一段时间;Ⅱ.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使
 转化为
转化为 ,再加适量的蒸馏水将溶液稀释至100mL;
,再加适量的蒸馏水将溶液稀释至100mL;Ⅲ.取25.00mL溶液,加入适量浓硫酸混合均匀,滴入3滴试亚铁灵作指示剂,用新配制的1.000mol/L的(NH4)2Fe(SO4)2标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗(NH4)2Fe(SO4)2标准溶液21.00mL。
①该样品中CrCl3的质量分数为
②下列操作将导致产品中CrCl3质量分数测定值偏低的是
A.步骤Ⅰ中未继续加热一段时间 B.步骤Ⅲ中所用(NH4)2Fe(SO4)2溶液已变质
C.步骤 Ⅱ中未加浓磷酸 D.步骤Ⅲ中读数时,滴定前俯视,滴定后平视
您最近一年使用:0次
名校
10 . 工业上,从有机催化剂(主要含钴和锌)回收金属的简易流程如下:
(1)“灼烧”的目的是___________ 。“酸浸”时加入稀硫酸,浸出液含有 、
、 、
、 、
、 、
、 等,检验
等,检验 的试剂是
的试剂是___________ (填化学式)。
(2)“净化”中加入 ,生成
,生成 和
和 。书写离子方程式:
。书写离子方程式:___________ 。
(3) (已知其中硫为+6价)中含
(已知其中硫为+6价)中含___________ mol过氧键 ,“沉钴”中加入
,“沉钴”中加入 ,还原产物为
,还原产物为 。
。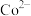 转化成
转化成 ,理论上消耗
,理论上消耗___________ mol 。
。
(4)“沉钴”的 不能太高,原因是
不能太高,原因是___________ 。
(5)“沉锌”加入 ,反应的离子方程式为
,反应的离子方程式为___________ ;沉锌的温度不能太高,原因是___________ 。
(6)“沉钴”中, 时
时 的数量级为
的数量级为___________ 。

(1)“灼烧”的目的是
 、
、 、
、 、
、 、
、 等,检验
等,检验 的试剂是
的试剂是(2)“净化”中加入
 ,生成
,生成 和
和 。书写离子方程式:
。书写离子方程式:(3)
 (已知其中硫为+6价)中含
(已知其中硫为+6价)中含 ,“沉钴”中加入
,“沉钴”中加入 ,还原产物为
,还原产物为 。
。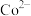 转化成
转化成 ,理论上消耗
,理论上消耗 。
。(4)“沉钴”的
 不能太高,原因是
不能太高,原因是(5)“沉锌”加入
 ,反应的离子方程式为
,反应的离子方程式为(6)“沉钴”中,
 时
时 的数量级为
的数量级为
您最近一年使用:0次