解题方法
1 . 硼氢化钠是重要的贮氢材料,水解可以释放出氢气: (未配平),下列说法正确的是(
(未配平),下列说法正确的是( 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
 (未配平),下列说法正确的是(
(未配平),下列说法正确的是( 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)A. 中氢元素的化合价是+1价 中氢元素的化合价是+1价 | B. 是氧化产物, 是氧化产物, 是还原产物 是还原产物 |
C.生成1mol  转移电子的数目为 转移电子的数目为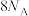 | D.水中加少量盐酸,会加快化学反应速率 |
您最近一年使用:0次
名校
2 . 对燃油尾气污染物进行脱硝处理有助于减少空气污染,可使用氨将氮氧化物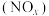 转化为无害气体,发生的反应为
转化为无害气体,发生的反应为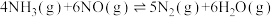 。下列说法正确的是
。下列说法正确的是
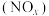 转化为无害气体,发生的反应为
转化为无害气体,发生的反应为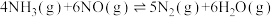 。下列说法正确的是
。下列说法正确的是A.标准状况下,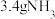 的体积约为 的体积约为 |
B. 可用作食品的保护气,原因是 可用作食品的保护气,原因是 的化学性质不活泼 的化学性质不活泼 |
C.该反应中, 与足量的 与足量的 反应,理论上可得到 反应,理论上可得到 |
D.该反应中,每断裂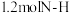 键,同时转移电子的物质的量为 键,同时转移电子的物质的量为 |
您最近一年使用:0次
名校
解题方法
3 . 水中溶解的氧气高温下对锅炉有很强的腐蚀性,可以用联氨(N2H4)处理锅炉水中的溶解氧。其中一种反应机理如图所示。下列说法错误的是

| A.联氨(N2H4)易溶于水,所得溶液中存在四种氢键 |
| B.稳定性:H2O2<N2H4,是因为H2O2分子中孤电子对较多 |
C.①中发生的反应为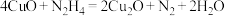 |
D.该过程中产生的氮气和消耗的氧气之比为: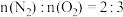 |
您最近一年使用:0次
2024-04-05更新
|
168次组卷
|
2卷引用:湖北省云学名校联盟2023-2024学年高二下学期3月联考化学试卷
名校
4 . 石墨烯可以看作是单层石墨,利用如下方法对石墨烯进行“切割”。已知①→③反应慢于③→④反应。下列说法错误的是
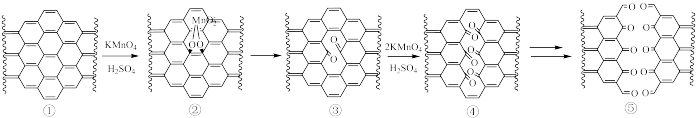

| A.导电性:①>④ | B.抗氧化性:①<③ |
| C.水溶性:①<⑤ | D.每形成1mol碳氧双键转移2mol电子 |
您最近一年使用:0次
2024-04-03更新
|
403次组卷
|
2卷引用:山东省枣庄市第八中学三校区2023-2024学年高二下学期联考化学试卷
解题方法
5 . 中国科学院大连化学物理研究所研究员邓德会团队直接将室温下空气转化制硝酸。装置如图所示。

下列叙述错误的是

下列叙述错误的是
A.a极为阳极,产生的 导入b极区作原料 导入b极区作原料 | B.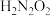 是中间产物, 是中间产物, 作催化剂 作催化剂 |
C.b极反应式为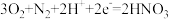 | D.每制备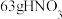 时转移电子数约为 时转移电子数约为 |
您最近一年使用:0次
名校
6 . 氢能源是最具应用前景的能源之一,高纯氢的制备是目前的研究热点。
I.电解水制备法 ),同时产生的氢原子会重组成
),同时产生的氢原子会重组成 。该过程如图所示:
。该过程如图所示:
(1)基态铜原子的价层电子轨道表示式为___________ 。
(2)已知:i.醛极易被氧化;ii.电解反应越难发生,电解所需电压越高
①在碱性条件下电解水制氢时,阳极发生的电极反应为___________ 。
②推测醛氧化制氢所需电压比电解水制氢___________ (填“低”、“高”或“相同”)。
③补全醛催化氧化时,阳极的电极反应式:___________ 。
 □
□ □
□
(3)上述电解装置工作时,每转移1 mol电子时,生成 的物质的量为
的物质的量为___________ 。
Ⅱ.甲烷水蒸气催化重整法
恒温恒压下甲烷和水蒸气的反应为: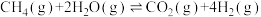

(4)达到平衡后通入氮气,分析 平衡转化率的变化及原因
平衡转化率的变化及原因___________ 。
(5)反应的过程中发生副反应
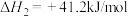 ,将
,将 混合气体通入反应体系,平衡时各组分的物质的量分数与温度的关系如图所示。分析750℃以后曲线a下降的原因是
混合气体通入反应体系,平衡时各组分的物质的量分数与温度的关系如图所示。分析750℃以后曲线a下降的原因是___________ 。
I.电解水制备法

 ),同时产生的氢原子会重组成
),同时产生的氢原子会重组成 。该过程如图所示:
。该过程如图所示:(1)基态铜原子的价层电子轨道表示式为
(2)已知:i.醛极易被氧化;ii.电解反应越难发生,电解所需电压越高
①在碱性条件下电解水制氢时,阳极发生的电极反应为
②推测醛氧化制氢所需电压比电解水制氢
③补全醛催化氧化时,阳极的电极反应式:
 □
□ □
□
(3)上述电解装置工作时,每转移1 mol电子时,生成
 的物质的量为
的物质的量为Ⅱ.甲烷水蒸气催化重整法
恒温恒压下甲烷和水蒸气的反应为:
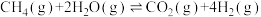

(4)达到平衡后通入氮气,分析
 平衡转化率的变化及原因
平衡转化率的变化及原因(5)反应的过程中发生副反应

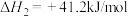 ,将
,将 混合气体通入反应体系,平衡时各组分的物质的量分数与温度的关系如图所示。分析750℃以后曲线a下降的原因是
混合气体通入反应体系,平衡时各组分的物质的量分数与温度的关系如图所示。分析750℃以后曲线a下降的原因是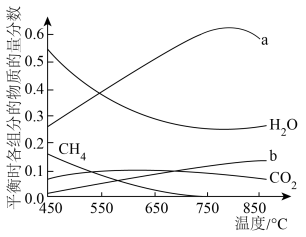
您最近一年使用:0次
2024-03-03更新
|
119次组卷
|
2卷引用: 北京市第十二中学2023-2024学年高二下学期开学考试化学试题
解题方法
7 . 锰是冶金工业中不可缺少的添加剂,它的作用是增加合金金属材料的硬度、韧性、耐磨性和耐腐性,应用最广泛的有不锈钢、高锰钢、锰铝合金等。位于遵义市红花岗区坪桥工业园区的遵义天磁锰业集团有限公司就是一家电解锰公司;以碳酸锰为主要原料,其中含有少量铁、铝、钙、硅的氧化物或硫化物等杂质,以下是电解锰的简化工艺流程图:

(1)粉碎的目的___________ 。
(2)写出浸出时主要的离子反应___________ ,同时会产生的有毒气体是___________ 。
(3)加双氧水的作用方程式表示出来___________ 。
(4)加入氨水的作用是___________ ,除铁的离子反应___________ 。
(5)电解制锰的电极反应___________ ,当外电路转移2mol电子时,生成的气体是___________ ,在标准状况下的体积为___________ L,阳极液中产生的___________ 可循环使用。

(1)粉碎的目的
(2)写出浸出时主要的离子反应
(3)加双氧水的作用方程式表示出来
(4)加入氨水的作用是
(5)电解制锰的电极反应
您最近一年使用:0次
名校
8 . 氯化铬( )是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡(
)是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡( )可制备少量氯化铬:
)可制备少量氯化铬:

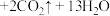 。回答下列问题:
。回答下列问题:
(1)上述反应中,还原剂是_________ ,还原产物与氧化产物的物质的量之比是________ 。
(2)该制备操作方法中,需加稍过量的乙醇,目的是________ 。
(3)制备的氯化铬粗样品利用下列滴定方法测定其纯度(杂质不参加反应):

已知:I.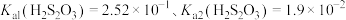 。
。
Ⅱ.上述过程发生反应: 、
、 。
。
① 标准液应盛放在
标准液应盛放在_______ 中进行滴定。
②滴定终点时,溶液由蓝色变为无色,则滴定时加入的指示剂名称是_______ 。
③滴定时,平行测定3次,平均消耗 标准液的体积为
标准液的体积为 ,则该氯化铬粗样品中
,则该氯化铬粗样品中 的纯度是
的纯度是______ (保留四位有效数字)。
 )是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡(
)是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡( )可制备少量氯化铬:
)可制备少量氯化铬:

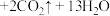 。回答下列问题:
。回答下列问题:(1)上述反应中,还原剂是
(2)该制备操作方法中,需加稍过量的乙醇,目的是
(3)制备的氯化铬粗样品利用下列滴定方法测定其纯度(杂质不参加反应):

已知:I.
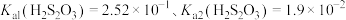 。
。Ⅱ.上述过程发生反应:
 、
、 。
。①
 标准液应盛放在
标准液应盛放在②滴定终点时,溶液由蓝色变为无色,则滴定时加入的指示剂名称是
③滴定时,平行测定3次,平均消耗
 标准液的体积为
标准液的体积为 ,则该氯化铬粗样品中
,则该氯化铬粗样品中 的纯度是
的纯度是
您最近一年使用:0次
解题方法
9 . 锰酸锂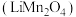 作为一种新型锂电池正极材料受到广泛关注。工业上利用
作为一种新型锂电池正极材料受到广泛关注。工业上利用 溶液多途径制备锰酸锂的流程如下,回答下列问题:
溶液多途径制备锰酸锂的流程如下,回答下列问题:

已知:①硫酸的结构为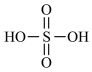
②干冰的晶胞结构见图。
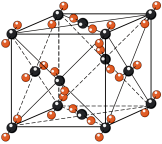
(1)将干冰晶胞沿体对角线投影,●代表 分子,则
分子,则 的投影图为______(选填序号)
的投影图为______(选填序号)
(2)工艺1中, 中S元素的化合价为
中S元素的化合价为 ,画出
,画出 的结构式
的结构式______ 。
(3)工艺2中,发生电解反应的离子方程式为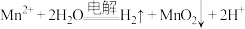 。随着电解反应进行,为保持电解液成分和浓度稳定,应不断加入
。随着电解反应进行,为保持电解液成分和浓度稳定,应不断加入______ (填化学式)。
(4)工艺3中,“沉锰、过滤”得到 和
和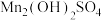 ;若“控温、氧化”时溶液的pH显著减小,此时
;若“控温、氧化”时溶液的pH显著减小,此时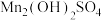 发生反应的化学方程式为
发生反应的化学方程式为______ 。
(5)为控制碳排放,用NaOH溶液吸收焙烧窑中释放的 并转化为正盐,理论上消耗的
并转化为正盐,理论上消耗的 和NaOH的物质的量之比为
和NaOH的物质的量之比为______ 。
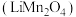 作为一种新型锂电池正极材料受到广泛关注。工业上利用
作为一种新型锂电池正极材料受到广泛关注。工业上利用 溶液多途径制备锰酸锂的流程如下,回答下列问题:
溶液多途径制备锰酸锂的流程如下,回答下列问题:
已知:①硫酸的结构为

②干冰的晶胞结构见图。

(1)将干冰晶胞沿体对角线投影,●代表
 分子,则
分子,则 的投影图为______(选填序号)
的投影图为______(选填序号)A.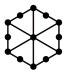 | B.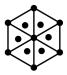 |
C.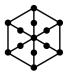 | D. |
(2)工艺1中,
 中S元素的化合价为
中S元素的化合价为 ,画出
,画出 的结构式
的结构式(3)工艺2中,发生电解反应的离子方程式为
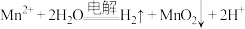 。随着电解反应进行,为保持电解液成分和浓度稳定,应不断加入
。随着电解反应进行,为保持电解液成分和浓度稳定,应不断加入(4)工艺3中,“沉锰、过滤”得到
 和
和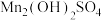 ;若“控温、氧化”时溶液的pH显著减小,此时
;若“控温、氧化”时溶液的pH显著减小,此时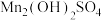 发生反应的化学方程式为
发生反应的化学方程式为(5)为控制碳排放,用NaOH溶液吸收焙烧窑中释放的
 并转化为正盐,理论上消耗的
并转化为正盐,理论上消耗的 和NaOH的物质的量之比为
和NaOH的物质的量之比为
您最近一年使用:0次
10 . Ⅰ.无水 与
与 作用会生成
作用会生成 。现有
。现有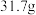 无水
无水 ,吸收
,吸收 后变成
后变成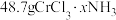 ,试回答下列问题:
,试回答下列问题:
(1) 中
中
______ 。
(2) 为配合物,其中
为配合物,其中 的配位数为6,经测定
的配位数为6,经测定 该配合物和足量
该配合物和足量 溶液反应得到
溶液反应得到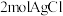 沉淀,则该配合物的化学式可表示为
沉淀,则该配合物的化学式可表示为______ 。
Ⅱ.将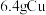 溶于
溶于 过量的硝酸溶液中,假设硝酸的还原产物只有
过量的硝酸溶液中,假设硝酸的还原产物只有 和
和 。反应结束后,将所得的溶液加水稀释至
。反应结束后,将所得的溶液加水稀释至 ,测得
,测得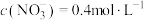 。(假设生成气体完全逸出)。请计算:
。(假设生成气体完全逸出)。请计算:
(3)稀释后溶液中 的物质的量浓度
的物质的量浓度______ 
(4)生成的气体中 物质的量
物质的量______  (用含有
(用含有 的表达式表示)
的表达式表示)
 与
与 作用会生成
作用会生成 。现有
。现有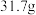 无水
无水 ,吸收
,吸收 后变成
后变成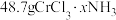 ,试回答下列问题:
,试回答下列问题:(1)
 中
中
(2)
 为配合物,其中
为配合物,其中 的配位数为6,经测定
的配位数为6,经测定 该配合物和足量
该配合物和足量 溶液反应得到
溶液反应得到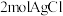 沉淀,则该配合物的化学式可表示为
沉淀,则该配合物的化学式可表示为Ⅱ.将
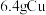 溶于
溶于 过量的硝酸溶液中,假设硝酸的还原产物只有
过量的硝酸溶液中,假设硝酸的还原产物只有 和
和 。反应结束后,将所得的溶液加水稀释至
。反应结束后,将所得的溶液加水稀释至 ,测得
,测得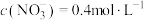 。(假设生成气体完全逸出)。请计算:
。(假设生成气体完全逸出)。请计算:(3)稀释后溶液中
 的物质的量浓度
的物质的量浓度
(4)生成的气体中
 物质的量
物质的量 (用含有
(用含有 的表达式表示)
的表达式表示)
您最近一年使用:0次



