1 . 已知反应 ,
, 为阿伏加德罗常数的值,若生成22.4L
为阿伏加德罗常数的值,若生成22.4L (标况),下列说法错误的是
(标况),下列说法错误的是
 ,
, 为阿伏加德罗常数的值,若生成22.4L
为阿伏加德罗常数的值,若生成22.4L (标况),下列说法错误的是
(标况),下列说法错误的是A.转移的电子数目为 |
B. 是由非极性共价键形成的非极性分子 是由非极性共价键形成的非极性分子 |
C.参与反应的 含有孤电子对数为 含有孤电子对数为 |
| D.生成的还原产物质量为56g |
您最近半年使用:0次
名校
2 . 设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.等物质的量的 和 和 混合气体中,所含的原子总数为 混合气体中,所含的原子总数为 |
B.向含有 的溶液中通入适量 的溶液中通入适量 ,当有 ,当有 被氧化时,该反应转移的电子数为 被氧化时,该反应转移的电子数为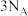 |
C.若 溶液中 溶液中 数目为 数目为 ,则等体积的 ,则等体积的 溶液中 溶液中 数目为 数目为 |
D.已知反应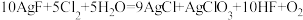 ,该反应中被氧化的 ,该反应中被氧化的 的物质的量为 的物质的量为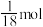 时,转移的电子数为 时,转移的电子数为 |
您最近半年使用:0次
名校
3 . 对燃油尾气污染物进行脱硝处理有助于减少空气污染,可使用氨将氮氧化物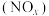 转化为无害气体,发生的反应为
转化为无害气体,发生的反应为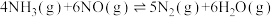 。下列说法正确的是
。下列说法正确的是
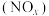 转化为无害气体,发生的反应为
转化为无害气体,发生的反应为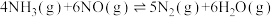 。下列说法正确的是
。下列说法正确的是A.标准状况下,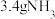 的体积约为 的体积约为 |
B. 可用作食品的保护气,原因是 可用作食品的保护气,原因是 的化学性质不活泼 的化学性质不活泼 |
C.该反应中, 与足量的 与足量的 反应,理论上可得到 反应,理论上可得到 |
D.该反应中,每断裂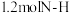 键,同时转移电子的物质的量为 键,同时转移电子的物质的量为 |
您最近半年使用:0次
解题方法
4 . 钉(Ru)为重要的稀有元素,广泛应用于电子、航空航天、化工等领域。某含钌的废渣主要成分为Ru、Pb、 、
、 ,回收钌的工艺流程如图:
,回收钌的工艺流程如图: 、
、 。
。
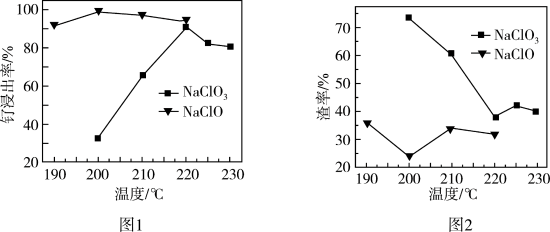
(1)“氧化碱浸”时,两种氧化剂在不同温度下对钌浸出率和渣率的影响分别如图1、图2所示,则适宜选择的氧化剂为________ ;最佳反应温度为________ 。 。则“还原”过程中每生成
。则“还原”过程中每生成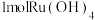 时,氧化剂和还原剂的物质的量之比为
时,氧化剂和还原剂的物质的量之比为________ 。
(3)“蒸馏”过程的化学反应方程式为________ 。
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为________ 、________ 。
(5)可用氢还原重量法测定产品的纯度,其原理为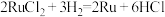 。实验所得数据记录如表,则产品的纯度为
。实验所得数据记录如表,则产品的纯度为________ 。
 、
、 ,回收钌的工艺流程如图:
,回收钌的工艺流程如图: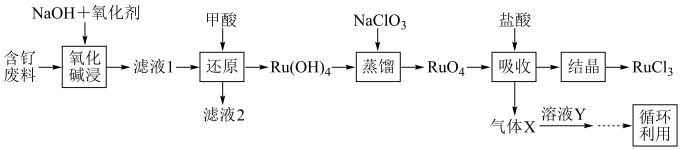
 、
、 。
。(1)“氧化碱浸”时,两种氧化剂在不同温度下对钌浸出率和渣率的影响分别如图1、图2所示,则适宜选择的氧化剂为
 。则“还原”过程中每生成
。则“还原”过程中每生成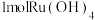 时,氧化剂和还原剂的物质的量之比为
时,氧化剂和还原剂的物质的量之比为(3)“蒸馏”过程的化学反应方程式为
(4)“吸收”过程产生的气体X经Y溶液吸收后,经进一步处理可以循环利用,则X和Y的化学式分别为
(5)可用氢还原重量法测定产品的纯度,其原理为
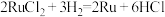 。实验所得数据记录如表,则产品的纯度为
。实验所得数据记录如表,则产品的纯度为实验序号 | 产品质量/g | 固体Ru质量/g |
① | 5.000 | 2.0210 |
② | 5.000 | 2.0190 |
③ | 5.000 | 2.0200 |
您最近半年使用:0次
解题方法
5 . 高铁酸钠( )是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为
)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为 。下列说法错误的是
。下列说法错误的是
 )是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为
)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用离子方程式表示为 。下列说法错误的是
。下列说法错误的是A. 中 中 原子的杂化轨道类型为 原子的杂化轨道类型为 |
B.该反应中氧化产物与还原产物的物质的量之比为 |
| C.依据该反应原理,可设计原电池 |
D.完全反应后,可用 溶液检验反应后的溶液中是否存在 溶液检验反应后的溶液中是否存在 |
您最近半年使用:0次
6 . 工业废水中含有的重铬酸根离子(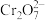 )有毒,必须处理达标后才能排放。工业上常用绿矾(
)有毒,必须处理达标后才能排放。工业上常用绿矾( )作处理剂,反应的离子方程式为
)作处理剂,反应的离子方程式为 ,下列说法正确的是
,下列说法正确的是
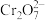 )有毒,必须处理达标后才能排放。工业上常用绿矾(
)有毒,必须处理达标后才能排放。工业上常用绿矾( )作处理剂,反应的离子方程式为
)作处理剂,反应的离子方程式为 ,下列说法正确的是
,下列说法正确的是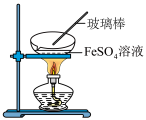
A.氧化性: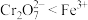 |
B.每转移 电子,同时消耗 电子,同时消耗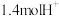 |
C.可采用如图所示装置来获得纯净的 固体 固体 |
D.基态 的价层电子轨道表示式为 的价层电子轨道表示式为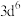 |
您最近半年使用:0次
名校
7 . 火箭推进发生反应的化学方程式为: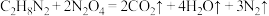 (
( 中C、N元素的化合价相等),下列说法正确的是
中C、N元素的化合价相等),下列说法正确的是
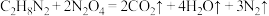 (
( 中C、N元素的化合价相等),下列说法正确的是
中C、N元素的化合价相等),下列说法正确的是A. 是氧化剂 是氧化剂 | B.氧化产物与还原产物之比为2∶3 |
C. 被氧化 被氧化 | D.1mol 完全反应,转移电子数为 完全反应,转移电子数为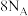 |
您最近半年使用:0次
8 . 研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
您最近半年使用:0次
9 . 在微生物作用下电解有机废水 含
含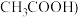 ,可获得清洁能源
,可获得清洁能源 ,其原理如图所示,下列有关说法不正确的是
,其原理如图所示,下列有关说法不正确的是
 含
含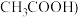 ,可获得清洁能源
,可获得清洁能源 ,其原理如图所示,下列有关说法不正确的是
,其原理如图所示,下列有关说法不正确的是
A.电极 极为负极 极为负极 |
B.与电源 极相连的惰性电极上发生的反应为: 极相连的惰性电极上发生的反应为: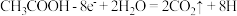  |
C.通电后,  通过质子交换膜向右移动。若导线中转移 通过质子交换膜向右移动。若导线中转移  电子,左侧溶液质量减轻 电子,左侧溶液质量减轻 |
D.通电后,若有   生成,则转移 生成,则转移  电子 电子 |
您最近半年使用:0次
解题方法
10 . 高品质MnO2可用于生产锂离子电池正极材料锰酸锂。以软锰矿与黄铁矿为主要原料采用“两矿一步浸出法”制备高品质MnO2的某工艺流程如图所示:
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下:
回答下列问题:
(1)“酸浸”操作中需先后分批加入H2SO4、H2O2。加入H2SO4后发生酸浸过程的主要反应离子方程式为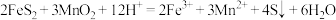 ,
,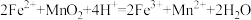 。
。
已知滤渣1的主要成分为S、SiO2、CaSO4等,其附着在矿粉颗粒表面使上述反应受阻,此时加入H2O2,利用其迅速分解产生的大量气泡可破除该不利影响。分析导致H2O2迅速分解的因素是____ 。
(2)加氨水“调pH”时调节溶液pH范围为4.7~6.0,此时“滤渣2”的主要成分为____ (填化学式)。
(3)加NH4F“调pH”时,溶液体系中的Ca2+和Mg2+形成氟化物沉淀。
①若沉淀后上层清液中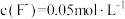 ,则
,则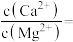
____ 。
②可以用MnF2代替NH4F,以Mg2+为例,结合反应的平衡常数解释能用MnF2除去Mg2+(和Ca2+)的原因是____ 。
(已知:Ksp(MnF2)=5×10-3,Ksp(MgF2)=5×10-11,Ksp(CaF2)=2.5×10-9)
(4)NH4HCO3“调pH”时,发生主要反应的离子方程式为____ 。
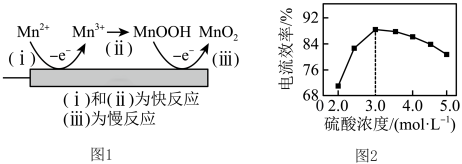
(5)利用惰性电极电解H2SO4—MnSO4—H2O体系获得MnO2的机理(部分)如图1所示,硫酸浓度与电流效率的关系如图2所示。硫酸浓度超过3.0 mol·L−1时,电流效率降低的原因是____ 。 +I2=2I-+
+I2=2I-+ ,计算粗品中MnO2的质量分数
,计算粗品中MnO2的质量分数_______ (写出计算过程)。
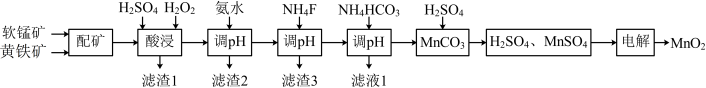
②该工艺条件下,相关金属离子完全形成氢氧化物沉淀的pH如下:
| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 6.9 | 1.9 | 6.6 | 9.1 | 3.4 |
沉淀完全(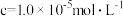 )的pH )的pH | 8.3 | 3.2 | 10.1 | 10.9 | 4.7 |
(1)“酸浸”操作中需先后分批加入H2SO4、H2O2。加入H2SO4后发生酸浸过程的主要反应离子方程式为
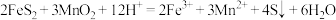 ,
,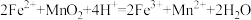 。
。已知滤渣1的主要成分为S、SiO2、CaSO4等,其附着在矿粉颗粒表面使上述反应受阻,此时加入H2O2,利用其迅速分解产生的大量气泡可破除该不利影响。分析导致H2O2迅速分解的因素是
(2)加氨水“调pH”时调节溶液pH范围为4.7~6.0,此时“滤渣2”的主要成分为
(3)加NH4F“调pH”时,溶液体系中的Ca2+和Mg2+形成氟化物沉淀。
①若沉淀后上层清液中
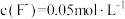 ,则
,则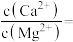
②可以用MnF2代替NH4F,以Mg2+为例,结合反应的平衡常数解释能用MnF2除去Mg2+(和Ca2+)的原因是
(已知:Ksp(MnF2)=5×10-3,Ksp(MgF2)=5×10-11,Ksp(CaF2)=2.5×10-9)
(4)NH4HCO3“调pH”时,发生主要反应的离子方程式为
(5)利用惰性电极电解H2SO4—MnSO4—H2O体系获得MnO2的机理(部分)如图1所示,硫酸浓度与电流效率的关系如图2所示。硫酸浓度超过3.0 mol·L−1时,电流效率降低的原因是
 +I2=2I-+
+I2=2I-+ ,计算粗品中MnO2的质量分数
,计算粗品中MnO2的质量分数
您最近半年使用:0次



